J BUON/ The PabMed, 2017 Nov-Dec;22(6):1372-1377.
Ehsan Saburi , Jalil Tavakol-Afshari, Sajjad Biglari, Yousef Mortazavi
Is α-N-acetylgalactosaminidase the key to curing cancer?
A mini-review and hypothesis
A mini-review and hypothesis
Является ли α-N-ацетилгалактозаминидаза ключом к лечению рака? Мини-обзор и гипотеза
Резюме
В постоянной борьбе с раковыми клетками огромное значение имеют макрофаги.
Их активация происходит с помощью различных механизмов, таких как белок, связывающий витамин D (VDBP или Gc).
После модификации под действием ферментов, выделяемых стимулированными лимфоцитами, VDBP превращается в форму/фактор активатора макрофагов (Gc-MAF).
В некоторых исследованиях (в частности, посвященных раку) сообщалось, что фермент, известный как α-N-ацетилгалактозаминидаза (нагалаза), способствует дегликозилированию Gc-MAF, что, в свою очередь, ингибирует активацию макрофагов.
Цель данного обзора — оценить исследования, связанные с нагалазой и ее эскалацией при различных заболеваниях, и предложить гипотетические решения для нейтрализации эффектов нагалазы у онкологических больных.
Ключевые слова: α-N-ацетилгалактозаминидаза, фактор активации макрофагов, новообразования, витамин D-связывающий белок.
Введение и история вопроса
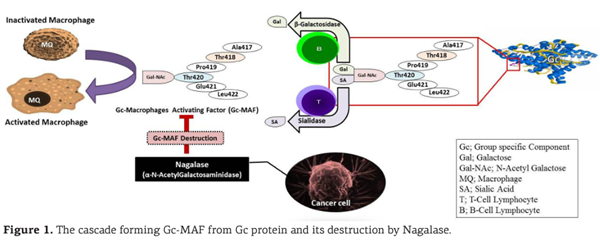
Макрофаги играют ключевую роль в борьбе с раковыми клетками, но только после сложного механизма активации.
После модификации сиалидазой и галактозидазой, секретируемыми соответственно Т- и В-лимфоцитами, витамин D-связывающий белок (также известный как Gc-глобулин, Gc-протеин и D-связывающий белок) приобретает способность активировать макрофаги; эта форма называется Gc-MAF (Group specific component macrophage activating factor) [1,2]. Этот 56-кД член суперсемейства альбуминов секретируется печенью и способствует повышению способности макрофагов генерировать супероксид [2], увеличивает общую и антителозависимую фагоцитарную способность, а также индуцирует транслокацию рецепторов FcgR1 и FcgR2 [3].
Противоопухолевые эффекты Gc-MAF включают антиангиогенные свойства [4], адъювантные эффекты, активацию остеокластов, облегчение хемотаксиса (с помощью производного пептида C5) и удаление циркулирующего G-актина [5].
Доказано, что белок, связывающий витамин D, влияет на восприимчивость организма ко многим заболеваниям, включая, в частности, хроническую обструктивную болезнь легких (ХОБЛ) [6], эндометриоз [7], остеопороз [8], аутизм [9], системную красную волчанку (СКВ) [9] и многочисленные виды рака, такие как меланома [10], плоскоклеточная карцинома [11] и рак полости рта [12].
В большинстве случаев деградация GcMAF опосредована ферментом α-N-ацетилгалактозаминидазой (нагалазой).
α-N-ацетилгалактозаминидаза и рак 1373 JBUON 2017; 22(6):1373
Нагалаза:
Структура и функция
Повышенный уровень нагалазы в сыворотке крови отмечается у многих онкологических больных, поэтому было высказано предположение, что этот фермент отвечает за дегликозилирование Gc-MAF [13] (рис. 1). Несмотря на то что внутриклеточная (лизосомальная) форма нагалазы жизненно важна для нормального функционирования печеночных клеток, внеклеточная форма (секретируемая раковыми клетками), по-видимому, только способствует прогрессированию рака [14].
Лизосомальная форма приобретает оптимальную активность в кислой среде (pH~5), но внеклеточная форма функционирует при уровне pH плазмы, примерно 7,4 [8].
До сих пор не выяснено, совпадает ли структура циркулирующей нагалазы с природной лизосомальной формой.
Возможно, различия в активном сайте, карбоксильных или аминных концах, гликозилированных боковых ответвлениях или добавлении кофактора/шаперона обусловливают эту вновь обретенную способность функционировать при уровне рН плазмы [14]. Требует уточнения и механизм секреции нагалазы.
Возможно, раковые клетки обладают способностью изменять структуру фермента для облегчения его секреции.
Существуют убедительные доказательства роли О-связей между соседними раковыми клетками или между раковыми клетками и внеклеточным матриксом (ECM).
Исходя из роли нагалазы в разрушении гликопротеинов, а также типа связей между клетками и ЭКМ, нагалаза может рассматриваться как важный биомаркер рака.
Нагалаза как биомаркер рака/маркер прогноза лечения
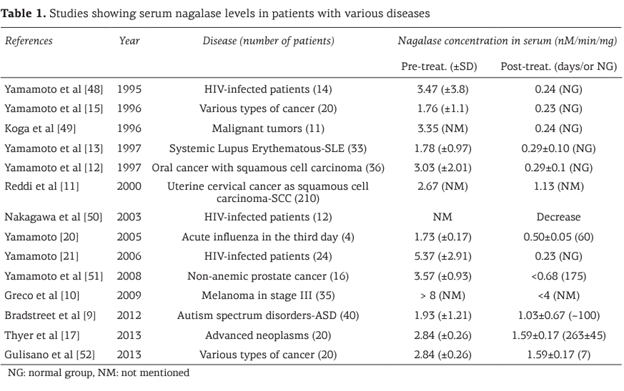
Предыдущие исследования показали повышение уровня нагалазы в плазме крови при многих видах рака (табл. 1).
Ямамото и коллеги впервые сообщили об этом повышении у пациентов с различными типами рака в 1996 году [15], и впоследствии это повышение было подтверждено в многочисленных исследованиях других авторов [11,16].
Дальнейшие исследования показали корреляцию между повышением уровня нагалазы и патогенезом раковых клеток в клеточных культурах и на животных моделях [14].
На уровень нагалазы в плазме влияет множество различных факторов, включая тип рака и его тяжесть, способность к метастазированию, наличие первичной или рецидивирующей опухоли, а также выбранная схема лечения рака [12,16].
В большинстве случаев терапия рака приводит к снижению уровня нагалазы в плазме крови при различных видах рака.
В исследовании, проведенном Thyer и коллегами, уровень нагалазы в плазме крови был снижен почти вдвое.
Сегодня стратегия многих перспективных методов лечения рака заключается в том, чтобы повысить уровень Gc-MAF и при этом надеяться на снижение уровня нагалазы в плазме. Хотя внутривенное введение Gc-MAF является еще не утвержденной терапией, благодаря имеющимся данным о ее успешности она применяется некоторыми практикующими врачами по всему миру [17].
По данным ряда статей и исследовательских центров, рекомендуемый референсный диапазон содержания нагалазы в сыворотке крови здоровых людей составляет от 0,32 до 0,95 нМ/мин/мг субстрата, хотя в некоторых статьях нормальный диапазон несколько ниже (до 0,65 нМ/мин/мг).
Безусловно, для определения универсального и надежного порога нормы необходимо провести дополнительные исследования.
Нагалаза в линиях раковых клеток.
Несколько исследований изучали уровень нагалазы в линиях раковых клеток, и их результаты показывают, что значения в различных клеточных линиях отличаются. Несмотря на нормальные уровни в фибробластах и кератиноцитах, таких как эмбриональные фибробласты легких человека (HEL299), фибробласты десны человека (HGF) и кератиноциты десны человека (HGK), повышенный уровень нагалазы наблюдался в клеточных линиях аденокарциномы слюнных желез человека (HSG) и клеточных линиях сквамозной карциномы (SCCTM) [18,19].
Нагалаза в микроорганизмах
Существует множество доказательств в пользу присутствия и роли нагалазы в различных патогенах.
Патогенез некоторых вирусов, таких как грипп [20], ВИЧ [21] или Herpes Simplex Virus-HSV [22], приписывается нагалазе.
Существуют доказательства того, что этот фермент играет важную роль в различных бактериях, особенно в микробиоте кишечника, таких как Bifidobacterium spp. (особенно B. longum) [23], Streptococcus mitis [24] или S. pneumonia [25], Enterococcus faecalis [26], enterobacteria spp. [27], Pseudomonas aeruginosa [28], Paenibacillus spp. [29] и, что особенно важно, Clostridium perfringens [30] и другие.
Использование нагалазы для разрушения ЭКМ было доказано в трофозоитах Entamoeba histolytica [32], хотя нагалаза была обнаружена и в других паразитах, таких как Toxoplasma gondii [33], Giardia lamblia [34], Schistosoma mansoni [35], Clonorchis sinensis [36] и даже в одном из видов комаров, Phlebotomus papatasi [37].
Хотя исследования о присутствии нагалазы в грибах ограничены, некоторые работы показывают ее наличие в Aspergillus spp. (особенно A. Niger) [38], Penicillium oxalicum [39], Streptomyces spp. [40] и Acremonium spp. [41].
В некоторых исследованиях был обнаружен аналог или сходный с нагалазой фермент бета-нацетилгалактозаминидаза в Bacillus spp. [42].
Исходя из многочисленных данных, указывающих на присутствие нагалазы в различных патогенных организмах, необходимо провести дополнительные исследования для выяснения точного механизма ее действия.
Гипотеза
Снижение экспрессии нагалазы
Глушение генов — одна из многочисленных категорий генной терапии, которая в последние десятилетия приобретает все большее значение.
Однако возникновение непредвиденных побочных эффектов привело к тому, что этот метод лечения до сих пор не утвержден во всем мире.
Глушение генов может быть достигнуто с помощью siRNA, shRNA или crisper-cas9, но эти методы пока ограничены рамками исследовательских лабораторий и еще не нашли своего места в клинической терапии [43,44].
Мы прогнозируем, что с помощью методов сайленсинга генов можно добиться снижения экспрессии нагалазы и, как следствие, уменьшения способности раковых клеток к инвазии.
Наиболее вероятным вариантом использования этого метода будет применение siRNA/shRNA, нацеленных на ген NAGA, его энхансер или гипотетическую последовательность, которая позволяет нагалазе секретироваться.
Ингибирование фермента
В случае если новый псевдосубстрат (гликопротеин с α-N-ацетилгалактозаминовой ветвью) будет представлен нагалазе в качестве конкурентного/альтернативного ингибитора, приманка сможет снизить дегликолизацию Gc-MAF.
Та же идея лежит в основе нынешнего внутривенного введения GcMAF, хотя и с большими финансовыми затратами.
Возможно, для снижения активности нагалазы можно использовать неконкурентный или неконкурентный ингибитор фермента, как предложили Ayers и коллеги [45].
Также эффективными могут быть изменения на посттрансляционной стадии, например манипуляции с шаперонами [46].
Моноклональные антитела для терапии и отслеживания метастазов
Синтез моноклонального антитела против нагалазы в плазме крови может дать значительные преимущества, включая возможность повысить восприимчивость нагалазы к идентификации, представлению и уничтожению иммунной системой пациента.
В случае, если эти антитела будут мечеными, можно будет обнаружить отдаленные и местные метастазы (предыдущие исследования показали, что самые высокие уровни нагалазы могут быть расположены вокруг раковых клеток), поэтому вероятные преимущества могут включать более быстрое и эффективное обнаружение и лечение метастатических очагов.
С другой стороны, исходя из этого и того факта, что нагалаза предпочитает кислую среду, при локальном повышении pH вокруг таких участков можно добиться потери функции фермента.
Такое локальное ингибирование было бы особенно эффективно в сочетании с внутривенным введением Gc-MAF [47] или в сочетании с таргетной химиотерапией (антитела к нагалазе, прикрепленные к липосомам, транспортирующим химиотерапевтические препараты).
Благодарность
Мы благодарим доктора Сейеда Аббаса Мирзаеи и Марка Маккарти за научную поддержку.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
References
- Naraparaju VR, Yamamoto N. Roles of beta-galactosidase of B lymphocytes and sialidase of T lymphocytes in inflammation-primed activation of macrophages. Immunol Lett 1994;43:143-8.
- Yamamoto, N., Kumashiro, R. Conversion of vitamin D3 binding protein (group-specific component) to a macrophage activating factor by the stepwise action of beta-galactosidase of B cells and sialidase of T cells. J Immunol 1993;151:2794-802.
- Ono T, Ichikawa H, Asami R, Yamamoto I. Enzymatically modified Gc globulin induces the translocation of FcgRI and FcgRII from intracellular storage compartments to the cell surface in murine peritoneal macrophages. Jpn J Inflamm 1995;15:293-9.
- Kanda S, Mochizuki Y, Miyata Y, Kanetake H, Yamamoto N. Effects of vitamin D(3)-binding protein-derived macrophage activating factor (GcMAF) on angiogenesis. J Natl Cancer Inst 2002;94:1311-9.
- Gomme PT, Bertolini J. Therapeutic potential of vitamin D-binding protein. Trends Biotechnol 2004;22:340-5.
- Wang YL, Kong H, Xie WP, Wang H. Association of vitamin D-binding protein variants with chronic obstructive pulmonary disease: a meta-analysis. Genet Mol Res 2015;14:10774-85.
- Sayegh L, Fuleihan Gel H, Nassar AH. Vitamin D in endometriosis: a causative or confounding factor? Metabolism 2014;63:32-41.
- Fang Y, van Meurs JB, Arp P et al. Vitamin D binding protein genotype and osteoporosis. Calcif Tissue Int 2009;85:85-93.
- Bradstreet JJ, Vogelaar E, Thyer L. Initial observations of elevated alpha-N-acetylgalactosaminidase activity associated with autism and observed reductions from Gc protein—macrophage activating factor injections. Autism Insights 2012;4:31.
- Greco M, Mitri MD, Chiriaco F, Leo G, Brienza E, Maffia M. Serum proteomic profile of cutaneous malignant melanoma and relation to cancer progression: association to tumor derived alpha-N-acetylgalactosaminidase activity. Cancer Lett 2009;283:222-9.
- Reddi AL, Sankaranarayanan K, Arulraj HS, Devaraj N, Devaraj H. Serum alpha-N-acetylgalactosaminidase is associated with diagnosis/prognosis of patients with squamous cell carcinoma of the uterine cervix. Cancer Lett 2000;158:61-4.
- Yamamoto N, Naraparaju VR, Urade M. Prognostic utility of serum alpha-N-acetylgalactosaminidase and immunosuppression resulted from deglycosylation of serum Gc protein in oral cancer patients. Cancer Res 1997;57:295-9.
- Yamamoto N, Naraparaju VR, Moore M, Brent LH. Deglycosylation of serum vitamin D3-binding protein by alpha-N-acetylgalactosaminidase detected in the plasma of patients with systemic lupus erythematosus. Clin Immunol Immunopathol 1997;82:290-8.
- Mohamad SB, Nagasawa H, Uto Y, Hori H. Tumor cell alpha-N-acetylgalactosaminidase activity and its involvement in GcMAF-related macrophage activation. Comp Biochem Physiol A Mol Integr Physiol 2002;132:1-8.
- Yamamoto N, Naraparaju VR, Asbell SO. Deglycosylation of serum vitamin D3-binding protein leads to immunosuppression in cancer patients. Cancer Res 1996;56:2827-31.
- Korbelik M, Naraparaju VR, Yamamoto N. The value of serum alpha-N-acetylgalactosaminidase measurement for the assessment of tumour response to radio- and α-N-acetylgalactosaminidase and cancer 1376 JBUON 2017; 22(6): 1376 photodynamic therapy. Br J Cancer 1998;77:1009-14.
- Thyer L, Ward E, Smith R et al. GC protein-derived macrophage-activating factor decreases alpha—acetylgalactosaminidase levels in advanced cancer patients. Oncoimmunology 2013;2 e25769.
- Uematsu T, Matsuura T, Doto R, Naramoto H, Yamaoka M, Furusawa K. Head and neck cancer cell-derived a-N-acetylgalactosaminidase deglycosilates O-linked glycoproteins. In The Preliminary Program for IADR General Session & Exhibition (June 28-July 1,2006). 2006.
- Matsuura T, Uematsu T, Yamaoka M, Furusawa K. Effect of salivary gland adenocarcinoma cell-derived alpha-N-acetylgalactosaminidase on the bioactivity of macrophage activating factor. Int J Oncol 2004;24: 521-8.
- Yamamoto N, Urade M. Pathogenic significance of alpha-N-acetylgalactosaminidase activity found in the hemagglutinin of influenza virus. Microbes Infect 2005;7:674-81.
- Yamamoto N. Pathogenic significance of alpha-Nacetylgalactosaminidase activity found in the envelope glycoprotein gp160 of human immunodeficiency virus Type 1. AIDS Res Hum Retroviruses 2006;22:262-71.
- Biller M, Mardberg K, Hassan H et al. Early steps in O-linked glycosylation and clustered O-linked glycans of herpes simplex virus type 1 glycoprotein C: effects on glycoprotein properties. Glycobiology 2000;10: 1259-69.
- Ruas-Madiedo P, Gueimonde M, Fernandez-Garcia M, de los Reyes-Gavilan CG, Margolles A. Mucin degradation by Bifidobacterium strains isolated from the human intestinal microbiota. Appl Environ Microbiol 2008;74:1936-40.
- Kirchherr JL, Bowden GH, Cole MF et al. Physiological and serological variation in Streptococcus mitis biovar 1 from the human oral cavity during the first year of life. Arch Oral Biol 2007;52:90-9.
- Gregg KJ, Boraston AB. Cloning, recombinant production, crystallization and preliminary X-ray diffraction analysis of a family 101 glycoside hydrolase from Streptococcus pneumoniae. Acta Crystallogr Sect F Struct Biol Cryst Commun 2009;65(Pt 2):133-5.
- Goda HM, Ushigusa K, Ito H, Okino N, Narimatsu H, Ito M. Molecular cloning, expression, and characterization of a novel endo-alpha-N-acetylgalactosaminidase from Enterococcus faecalis. Biochem Biophys Res Commun 2008;375:441-6.
- Ashida H, Maki R, Ozawa H et al. Characterization of two different endo-alpha-N-acetylgalactosaminidases from probiotic and pathogenic enterobacteria, Bifidobacterium longum and Clostridium perfringens. Glycobiology 2008;18:727-34.
- Aristoteli LP, Willcox MD. Mucin degradation mechanisms by distinct Pseudomonas aeruginosa isolates in vitro. Infect Immun 2003;71:5565-75.
- Sumida T, Fujimoto K, Ito M. Molecular cloning and catalytic mechanism of a novel glycosphingolipiddegrading beta-N-acetylgalactosaminidase from Paenibacillus sp. TS12. J Biol Chem 2011;286:14065-72.
- Hsieh HY, Calcutt MJ, Chapman LF, Mitra M, Smith DS. Purification and characterization of a recombinant alpha-N-acetylgalactosaminidase from Clostridium perfringens. Protein Expr Purif 2003;32:309-16.
- Bakunina IY, Kuhlmann RA, Likhosherstov LM et al. Alpha-N-acetylgalactosaminidase from marine bacterium Arenibacter latericius KMM 426T removing blood type specificity of A-erythrocytes. Biochemistry (Mosc) 2002;67:689-95.
- Mittal K, Welter BH, Temesvari LA. Entamoeba histolytica: lipid rafts are involved in adhesion of trophozoites to host extracellular matrix components. Exp Parasitol 2008;120:127-34.
- O’Connor RM, Kim K, Khan F, Ward HD. Expression of Cpgp40/15 in Toxoplasma gondii: a surrogate system for the study of Cryptosporidium glycoprotein antigens. Infect Immun 2003;71:6027-34.
- Connaris S, Greenwell P. Glycosidases in mucin-dwelling protozoans. Glycoconj J 1997;14:879-82.
- Bickle QD, Oldridge J. Characterization of a stage-specific Mr16000 schistosomular surface glycoprotein antigen of Schistosoma mansoni. Mol Biochem Parasitol 1999;100:85-94.
- Lee MR, Yoo WG, Kim YJ et al. Molecular characterization of an alpha-N-acetylgalactosaminidase from Clonorchis sinensis. Parasitol Res 2012;111:2149-56.
- Jacobson RL, Studentsky L, Schlein Y. Glycolytic and chitinolytic activities of Phlebotomus papatasi (Diptera: Psychodidae) from diverse ecological habitats. Folia Parasitol (Praha) 2007;54:301-9.
- Kulik N, Weignerova L, Filipi T et al. The alpha-galactosidase type A gene aglA from Aspergillus niger encodes a fully functional alpha-N-acetylgalactosaminidase. Glycobiology 2010;20:1410-9.
- Weignerova L, Vavruskova P, Pisvejcova A, Thiem J, Kren V. Fungal beta-N-acetylhexosaminidases with high beta-N-acetylgalactosaminidase activity and their use for synthesis of beta-GalNAc-containing oligosaccharides. Carbohydr Res 2003;338:1003-8.
- Ajisaka K, Miyasato M, Ishii-Karakasa I. Efficient synthesis of O-linked glycopeptide by a transglycosylation using endo alpha-N-acetylgalactosaminidase from Streptomyces sp. Biosci Biotechnol Biochem 2001;65:1240-3.
- Ashida H, Tamaki H, Fujimoto T, Yamamoto K, Kumagai H. Molecular cloning of cDNA encoding alphaN-acetylgalactosaminidase from Acremonium sp. and its expression in yeast. Arch Biochem Biophys 2000;384:305-10.
- Tanaka A, Ozaki S. Purification and characterization of beta-N-acetylgalactosaminidase from Bacillus sp. AT173-1. J Biochem 1997;122:330-6.
- Potaczek DP, Garn H, Unger SD, Renz H. Antisense molecules: A new class of drugs. J Allergy Clin Immunol 2016;137:1334-46.
- Saburi E, Tavakolafshari J, Mortazavi Y et al. shRNA-mediated downregulation of α-NAcetylgalactosaminidase inhibits migration and invasion of cancer cell lines. Iran J Basic Med Sci 2017;20:1021-8.α-N-acetylgalactosaminidase and cancer 1377 JBUON 2017; 22(6):1377
- Ayers BJ, Hollinshead J, Saville AW et al. Iteamine, the first alkaloid isolated from Itea virginica L. inflorescence. Phytochemistry 2014;100:126-31.
- Clark NE, Metcalf MC, Best D, Fleet GW, Garman SC. Pharmacological chaperones for human α-Nacetylgalactosaminidase. Proc Natl Acad Sciences USA 2012;109:17400-5.
- Saburi E, Saburi A, Ghanei M. Promising role for GcMAF in cancer immunotherapy: from bench to bedside. Caspian J Intern Med 2017;8:228-38.
- Yamamoto N, Naraparaju VR, Srinivasula SM. Structural modification of serum vitamin D3-binding protein and immunosuppression in AIDS patients. AIDS Res Hum Retroviruses 1995;11:1373-8.
- Koga Y, Naraparaju V, Yamamoto N. Enzyme assay of alpha-n-acetylgalactosaminidase on ehrlich tumor bearing mice and clinical cancer patients. Cancer Detect Prev 1996;20:202. 50.
- Nakagawa Y, Sirivichayakul S, Phanuphak P, Suda T, Mito K, Hori H. Beneficial effect of macrophage activating agent NK-4 on Thai HIV-infected patients. Anticancer Res 2003;23:4389-94.
- Yamamoto N, Suyama H. Immunotherapy for Prostate Cancer with Gc Protein-Derived Macrophage-Activating Factor, GcMAF. Transl Oncol 2008;1:65-72.
52. Gulisano M, Pacini S, Thyer L et al. Alpha-N-acetylgalactosaminidase levels in cancer patients are affected by Vitamin D binding protein-derived macrophage activating factor. It J Anatom Embryol 2013;118:104.
