NCBI Literature J Neuroinflammation. 2014; 11: 78. Published online 2014 Apr 17.
Dario SiniscalcoJames, Jeffrey Bradstreet, Alessandra Cirillo, Nicola Antonucci
The in vitro GcMAF effects on endocannabinoid system transcriptionomics, receptor formation, and cell activity of autism-derived macrophages
Влияние in vitro GcMAF на транскрипциономику эндоканнабиноидной системы, формирование рецепторов и клеточную активность макрофагов аутистического происхождения
Содержание
Фон
Дисрегуляция иммунной системы хорошо известна при аутизме и считается частью этиологии этого расстройства.
Эндоканнабиноидная система является ключевым регулятором иммунной системы через каннабиноидный рецептор типа 2 (CB2R), который высоко экспрессируется на макрофагах и клетках микроглии.
Ранее мы публиковали достоверные различия в экспрессии гена CB2R мононуклеарных клеток периферической крови в популяции аутизма.
Использование фактора активации макрофагов (GcMAF), полученного из белка Gc, эндогенного гликозилированного белка, связывающего витамин D, ответственного за активацию клеток макрофагов, продемонстрировало положительный эффект в лечении детей-аутистов.
В этом текущем исследовании мы изучили влияние in vitro лечения GcMAF на экспрессию генов эндоканнабиноидной системы, а также клеточную активацию в моноцитарных макрофагах крови (МПДМ) у пациентов с аутизмом по сравнению с контрольной группой здорового развития.
Методика
Для достижения поставленных целей использовались биомолекулярные, биохимические и иммуноцитохимические методы.
Результаты
Лечение GcMAF смогло нормализовать наблюдаемые различия в дисрегулируемой экспрессии генов эндоканнабиноидной системы в группе аутизма. GcMAF также подавляет чрезмерную активацию МПДМ у аутичных детей.
Выводы
В этом исследовании представлены первые наблюдения за влиянием GcMAF на транскрипциономику эндоканнабиноидной системы и экспрессию белка CB2R. Эти данные указывают на потенциальную связь между эндоканнабиноидами, витамином D и его белками-переносчиками, а также иммунными нарушениями, наблюдаемыми при аутизме.
Ключевые слова: GcMAF, эндоканнабиноиды, экспрессия генов, макрофаги, аутизм
Знакомство
Аутизм и расстройства аутистического спектра (РАС) представляют собой сложные гетерогенные состояния развития нервной системы [1], возникающие в результате взаимодействия генетических факторов и факторов окружающей среды [2]. Установленные категории симптомов включают дисфункции в коммуникативных навыках и социальных взаимодействиях в сочетании с повторяющимся, ограничительным и стереотипным вербальным и невербальным поведением.
Несмотря на обширные научные усилия, этиопатологии РАС остаются недостаточно изученными [3-5]. В качестве потенциальных механизмов предложены ранние воспалительные процессы, включая иммунные взаимодействия матери и плода и связанные с ними иммунологические дисфункции [6-9].
Преобладающая гипотеза заключается в том, что некоторая комбинация иммунных факторов, включая выработанные матерью антитела к мозгу плода, запускает микроглию таким образом, чтобы исключить ее нормальные функции по управлению миграцией нейронов и обрезке [10,11].
Функциональная роль витамина D в центральной нервной системе недавно была пересмотрена и включает нейрогенез, нейропластичность и нейропротекцию [12].
Доказано, что дефицит витамина D является причиной невынашивания беременности, а прием добавок с D3 значительно снижает секрецию ИФН-γ и ФНО-α из естественных клеток-киллеров (NK) [13].
Существует сложное взаимодействие между витамином D и полиморфизмами рецептора витамина D (VDR), а также риском аутоиммунных заболеваний и чувствительностью к добавкам витамина D [14].
При аутизме дефицит витамина D во время беременности или в раннем детстве, по-видимому, вносит значительный вклад в риск [ 15 ].
Потенциально с этими процессами связаны недавние наблюдения повышенного уровня N-ацетилгалактозаминидазы (Нагалаза) в крови детей с РАС [16].
Нагалаза — это фермент, который катализирует дегликозилирование белка Gc, также известного как белок, связывающий витамин D3 (VDBP), что делает его неспособным к преобразованию в регуляторный белок, фактор активации макрофагов Gc (GcMAF). GcMAF является иммунологически важным белком, ответственным за активацию макрофагов [17], таким образом, нагалаза снижает способность организма к активации макрофагов, а повышенный уровень нагалазы был зарегистрирован при аутоиммунных заболеваниях, включая системную красную волчанку (СКВ) [18].
Недавно мы продемонстрировали, что передача сигналов каннабиноидных рецепторов типа 2 (CB2R) была значительно повышена в мононуклеарных клетках периферической крови (PBMC), выделенных у детей с аутизмом, предполагая, что дисрегуляция эндоканнабиноидной (ЭК) системы может быть вовлечена в РАС-опосредованные иммунные нарушения [19].
Используя новую методологию радиоактивного мечения, распределение CB2R недавно было картировано с помощью позитронно-эмиссионной томографии всего тела (ПЭТ) [20].
У здоровых людей без патологии, связанной с головным мозгом, было продемонстрировано, что CB2R соответствует периферической лимфоидной иммунной системе. Кроме того, CB2R экспрессируется как на макрофагах, так и на клетках микроглии, и было продемонстрировано, что активация CB2R подавляет индуцированное ишемией воспаление макрофагов и микроглии на животной модели [21].
Организм вырабатывает липиды на основе арахидоната — анандамид (N-арахидоноилэтаноламид, AEA) и 2-арахидоноилглицерин (2-AG), которые являются связывающими лигандами для каннабиноидных рецепторов [ 22 ]. CB2R, по-видимому, обладает первичным иммуномодулирующим действием, а CB2R-специфические агонисты и фитоканнабиниоиды (например, каннабидиол (CBD)) не обладают психоактивными свойствами [22].
Лечение GcMAF, по-видимому, облегчает симптомы аутизма у некоторых детей [16]; Тем не менее, клеточные и молекулярные пути, участвующие в очевидном терапевтическом эффекте, не изучены. Мы предположили, что потенциальный терапевтический механизм GcMAF связан с транскрипционной регуляцией генов EC. Мы стремились исследовать этот механизм in vitro, используя моноцитарные макрофаги крови (МПДМ) у пациентов с аутизмом и контрольной группы.
Материалы и методы
Мы обследовали 22 ребенка с аутизмом и сравнили их с 20 здоровыми детьми соответствующего возраста и пола, использованными в качестве контрольной группы (возраст от 3 до 11 лет; средний возраст: 7,06 ± 1,52 против 7,38 ± 2,33 у аутичных и здоровых людей соответственно).
Испытуемые с аутизмом были набраны для участия в исследовании из амбулаторного Биомедицинского центра исследований и лечения аутизма, Бари, Италия. Перед тем, как приступить к исследованию, всем детям была предложена пересмотренная версия Autism Diagnostic Interview [23], Шкалы оценки детского аутизма (CARS) [24] и Outism Diagnostic Observation Schedule-Generic [25] для документирования диагноза аутизма.
Все пациенты, включенные в исследование, соответствовали критериям аутизма «Диагностическое и статистическое руководство по психическим расстройствам-IV» (DSM-IV-TR) [1].
В дополнение к соответствию критериям аутистического расстройства, испытуемые должны были набрать не менее 30 баллов по шкале CARS. Среди членов семей сотрудников было набрано 20 здоровых детей.
Потенциальные субъекты исключались, если у них было что-либо из следующего: неврологическое или коморбидное психическое расстройство, эпилепсия, наличие в анамнезе заболеваний печени, почек или эндокринной системы, текущая инфекция любого происхождения.
Умственная отсталость или поведенческие расстройства, в том числе первазивное расстройство развития (PDD-NOS), а также критерии включения синдрома дефицита внимания и гиперактивности, считались критериями исключения для контрольных детей.
Дети с диагнозом синдром Аспергера, синдром ломкой Х-хромосомы и туберозный склероз также были исключены из исследования. Тест на IQ не проводился. Ни аутичные испытуемые, ни контрольная группа не получали фармакологического вмешательства.
Другими критериями исключения были целиакия и/или другие серьезные заболевания кишечного тракта, такие как воспалительные заболевания кишечника или печеночные расстройства.
Было получено информированное согласие от родителей всех детей, включенных в это исследование, и было получено согласие здоровых контрольных групп в соответствии с итальянским законодательством и Кодексом этических принципов медицинских исследований с участием человека Всемирной медицинской ассоциации (Хельсинкская декларация).
Выделение мононуклеарных клеток периферической крови (МПКМ)
Мононуклеарные клетки экстрагировали, как описано ранее [9,19]. Вкратце, менее 10 мл свежих образцов периферической крови аутичных испытуемых и контрольных доноров были взяты и собраны в стерильные пробирки ЭДТА (Бектон Дикинсон, Франклин Лейкс, Нью-Джерси, США).
Мононуклеарные клетки периферической крови (ПМБК) выделяли центрифугированием по градиенту плотности Histopaque 1077 (Sigma Chemical, Сент-Луис, Миссури, США). Вкратце, кровь разбавляли 1:1 в PBS (Sigma, Сент-Луис, Миссури, США), накладывали на среду для разделения лимфоцитов (Lymphocyte Separation Medium — Lonza, Walkersville, MD, США), центрифугировали при 2,200 об/мин в течение 30 минут при комнатной температуре и удаляли плазму.
Мононуклеарную клеточную фракцию собирали и дважды промывали в PBS. Готовую гранулу повторно суспендировали в полной среде RPMI 1640 (Lonza, Verviers, Бельгия), содержащей 10% FBS (EuroClone-Celbio, Милан, Италия), 2 мМ L-глютамина, 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина (все Lonza, Verviers, Бельгия) и инкубировали при 37°C с 5% CO2. Лимфоциты (неадгезивные клетки) были удалены.
Дифференциация макрофагов от ПБМК
Для получения полностью дифференцированных макрофагов, полученных из моноцитов крови человека (МПДМ), МПМК культивировали в течение примерно десяти дней в присутствии 25 нг/мл рекомбинантного колониестимулирующего фактора макрофагов человека (Peprotech, Лондон, Великобритания) [26,27] 1).
Репрезентативная оптическая микрофотография моноцитарных макрофагов крови (МПДМ) in vitro у детей с аутизмом.
Лечение in vitro
GcMAF добавляли в конечной концентрации 0,1 нг/мл к МПДМ у здоровых пациентов и пациентов с аутизмом. Доза GcMAF была выбрана на основании предыдущей работы, показывающей, что максимальная стимуляция PBMCs достигается при 0,1 нг/мл [28]. GcMAF любезно предоставлен компанией Immuno Biotech (Сент-Питер-Порт, Гернси, Великобритания).
После инкубации клеток в течение 24 часов в присутствии GcMAF некоторые клетки лизировали для экстракции и анализа РНК (полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР)) и белков с помощью вестерн-блоттинг-анализа; В качестве альтернативы были зафиксированы другие клетки для флуоресцентного иммуноцитохимического анализа.
Сравнения между уровнями экспрессии РНК и белка до лечения были проведены как для аутичных людей, так и для здоровой контрольной группы.
Экстракция РНК и ОТ-ПЦР
РНК извлекали из БМДМ с помощью РНК-триреагента (Molecular Research Center Inc., Цинциннати, Огайо, США) в соответствии с протоколом производителя. Общую концентрацию и целостность РНК определяли с помощью УФ-спектрофотометра Nanodrop® ND-1000 (Nano-Drop® Technologies, Thermo Scientific, Уилмингтон, Германия, США). Уровни мРНК анализируемых генов EC измеряли методом ОТ-ПЦР-амплификации, как сообщалось ранее [19].
Обратная транскриптаза вируса птичьего миелобластоза (AMV-RT; Promega, Madison, WI, США). Для синтеза первой цепи кДНК 200 нг общей РНК, случайные гексамеры, dNTP (Promega, Madison, WI, США), буфер AMV, AMV-RT и рекомбинантный ингибитор РНКазинрибонуклеазы (Promega, Madison, WI, США) собирали в воде, обработанной диэтилпирокарбонатом, до конечного объема 20 мкл и инкубировали в течение десяти минут при 65 °C и одного часа при 42 °C.
Для проверки потенциального загрязнения геномной ДНК был проведен контроль RT минус. Эти ОТ минус контроль проводили без использования фермента обратной транскриптазы в реакционной смеси. Аликвоты 2 мкл кДНК переносили в реакционную смесь ПЦР объемом 25 мкл, содержащую dNTP, MgCl2, реакционный буфер, специфические праймеры и ДНК-полимеразу GoTaq Flexi (Promega, Madison, WI, США), а также реакции амплификации с использованием специфических праймеров и условий для анализируемых генов человека.
Последовательности мРНК человека из GeneBank (DNASTAR Inc., Мэдисон, Висконсин, США) были использованы для разработки специфических пар праймеров для ОТ-ПЦР (программное обеспечение OLIGO 4.05, National Biosciences Inc., Плимут, Миннесота, США) (таблица 1) [19]. Каждая ОТ-ПЦР повторялась не менее трех раз для достижения наилучших воспроизводимых данных. Измеренные уровни мРНК нормализовались по отношению к глицеральдегид-3-фосфатдегидрогеназе (GAPDH), которая была выбрана в качестве гена, отвечающего за домашнее хозяйство.
Действительно, GAPDH является одним из наиболее стабильно экспрессируемых генов в периферической крови человека [29]. Насколько нам известно, нет молекулярных доказательств вариабельности уровней мРНК GAPDH при расстройствах аутизма [19]. Значения экспрессии генов выражались в виде произвольных единиц ± SEM. Амплификацию интересующих генов и GAPDH проводили одновременно. Продукты ПЦР растворяли в 2% агарозном геле. Полуколичественный анализ уровней мРНК проводили с помощью УФ-системы Gel Doc EZ (Bio-Rad, Hercules, CA, США).
Таблица 1

Экстракция белка и вестерн-блоттинг-анализ
Для экстракции белка БМДМ суспендировали в буфере лизиса белка (HEPES 25 мМ; ЭДТА 5 мМ; СДС 1%; Тритон Х-100 1%; ПМСФ 1 мМ; MgCl2 5 мМ; Коктейль ингибиторов протеазы (Roche, Мангейм, Германия); Коктейль ингибиторов фосфатазы (Roche, Мангейм, Германия)). Концентрацию белка определяли по методике, описанной Брэдфордом [30].
Для обнаружения CB2R каждый образец загружали, электрофорезировали в 15% полиакриламидный гель SDS и электроблотировали на нитроцеллюлозную мембрану. Мембрана блокировалась в 5% молоке, 1X Tris-буферном физиологическом растворе и 0,05% Tween-20.
Первичные антитела для детектирования CB2R (Calbiochem-Merck, Дармштадт, Германия) использовали в соответствии с инструкцией производителя в разведении 1:250 [19].
Кроличье антитело к CB2R обнаруживает эндогенные уровни человеческого фрагмента белка CB2R с молекулярной массой 45 кДа. Антитело не вступает в перекрестную реакцию с белком-рецептором CB1 и, по словам производителя, было валидировано рекомбинантным белком, состоящим из первых 33 аминокислот человеческого CB2R, используемым в качестве положительного контроля.
Для детектирования рецепторов маннозы каждый образец загружали, электрофорезировали в сборном градиентном геле SDS-полиакриламида с градиентом от 4 до 12% с использованием системы Bolt® (Life Technologies, Монца, Италия) и электроблотировали на нитроцеллюлозную мембрану.
Мембрана блокировалась в 5% молоке, 1X Tris-буферном физиологическом растворе и 0,05% Tween-20. Первичные антитела для обнаружения рецептора маннозы (ab64693 Abcam, Кембридж, Великобритания) использовали в соответствии с инструкцией производителя в разведении 1:1000.
Иммунореактивные сигналы детектировали вторичным антителом, конъюгированным пероксидазой хрена, и реагировали с системой ECL (Amersham Pharmacia, Уппсала, Швеция).
Для оценки равной нагрузки уровни белка нормализовали по отношению к сигналу, полученному при окрашивании Coomassie Blue, о чем сообщалось ранее [31]. В качестве равного контроля нагрузки мы использовали окрашивание Coomassie Blue, так как этот метод преодолевает возможность того, что хозяйственные белки могут варьироваться при данной патологии или насыщаться на уровнях нагрузки [19].
Тем не менее, мы подтвердили сигналы, полученные с помощью окрашивания Coomassie Blue, в отношении сигнала, полученного анти-β-тубулиновыми моноклональными антителами (A2066 Sigma Chemical, Сент-Луис, Миссури, США; разведение 1:1000).
Полуколичественный анализ уровней белка был проведен с помощью ChemiDoc-It 5000 с использованием программного обеспечения VisionWorks Life Science Image Acquisition and Analysis (UVP, Upland, CA, США).
Иммуноцитохимия
Для иммуноцитохимического анализа БМДМ повторно суспендировали при 1х106 клетка/мл в полной среде RPMI 1640 (Lonza, Verviers, Бельгия), содержащей 10% FBS (EuroClone-Celbio, Милан, Италия), 2 мМ L-глютамина, 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина (все Lonza, Verviers, Бельгия), наносили на предметные стекла с 12-луночным планшетом и инкубировали при 37°С с 5% CO2. Затем клетки фиксировали 4%-ным фиксатором параформальдегида.
После промывки в PBS связывание неспецифических антител ингибировали инкубацией в течение 30 мин в блокирующем растворе (1% BSA в PBS). Первичные антитела разводили в PBS-блокирующем буфере, а предметные стекла инкубировали в течение ночи при 4°C в первичных антителах к человеку Notch (1:100; Santa Cruz Biotechnology, Санта-Крус, Калифорния, США) или к маркеру пролиферации Ki67 человека (1:200; Santa Cruz Biotechnology, Санта-Крус, Калифорния, США).
Флуоресцентно меченные вторичные антитела (1:1,000; Alexa Fluor 488, молекулярный зонд; Invitrogen, Carlsbad, CA, США), специфичные для видов IgG, используемых в качестве первичного антитела, были использованы для обнаружения специфических антигенов в каждом предметном стекле.
Клетки окрашивали бисбензимидом (Hoechst 33258; Hoechst, Франкфурт-на-Майне, Германия) и монтируется с монтажной средой (90% глицерина в PBS). Флуоресцентно меченые предметные стекла рассматривали с помощью флуоресцентного микроскопа (Leica, Wetzlar, Германия) и флуоресцентного конфокального микроскопа (LSM 710, Zeiss, Oberkochen, Германия).
Иммунофлуоресцентные изображения анализировали с помощью программного обеспечения Leica FW4000 (Leica, Вецлар, Германия) и программного обеспечения Zen Zeiss (Zeiss, Оберкохен, Германия).
Количественная оценка профилей Ki67-ir проводилась наблюдателем, слепым к лечению. Количественная оценка положительного профиля клеток проводилась на каждом оцифрованном изображении, и представленные данные представляют собой средние значения интенсивности ± SE на окрашенных клетках в каждой группе.
Только бисбензимидные контрокрашенные клетки рассматривались как положительные профили, чтобы избежать пересчета клеток.
Статистический анализ
Биомолекулярные данные выражаются в виде средних ± SEM. Для определения статистической значимости среди групп использовали ANOVA, за которым следовал тест Стьюдента-Ноймана-Кеулса. P < 0,05 считали статистически значимым.
Результаты
GcMAF смог нормализовать дисрегуляцию генов эндоканнабиноидной системы в моноцитарных макрофагах крови (МПДМ) у детей с аутизмом
Как мы уже показали [19], изучение экспрессии генов системы ЕС преимущественно методом ОТ-ПЦР гораздо более чувствительно для выявления экспрессии генов, чем иммуноцитохимия [9,32].
Мы оценили влияние GcMAF на NAPE-PLD (N-ацилфосфатидилэтаноламинфосфолипазу D), белок-кодирующий ген [GC07M102742]. Ген кодирует фермент, который гидролизует N-ацил-фосфатидилэтаноламины (NAPE) с образованием N-ацилэтаноламинов (NAE) и фосфатидной кислоты и, в частности, генерацию анандамида (N-арахидоноилэтаноламин), лиганда каннабиноидных рецепторов.
По сравнению со здоровыми контрольными группами, полуколичественный анализ уровней мРНК, выделенных с помощью МПДМ, измеренных с помощью амплификации ОТ-ПЦР, показал увеличение гена NAPE-PLD в МПДМ пациентов с аутизмом (среднее ± SE условных единиц: 1,20 ± 0,34 против 0,71 ± 0,11, P < 0,05 у МПДМ у детей с аутизмом и здоровых людей соответственно).
Мы также оценили ген амидгидролазы жирных кислот (FAAH) [GC01P046860]. FAAH представляет собой мембраноассоциированный фермент, который гидролизует биологически активные амиды, в том числе EC, анандамид.
Мы наблюдали снижение уровня мРНК гена фермента FAAH (среднее ± SE условных единиц: 0,40 ± 0,08 против 1,60 ± 0,06, P < 0,05 у МПДМ детей с аутизмом и здоровых испытуемых соответственно); достоверно увеличено соотношение NAPE-PLD/FAAH (среднее ± SE условных единиц: 3,00 ± 0,84 против 0,44 ± 0,07 в МПДМ у детей с аутизмом по сравнению со здоровыми испытуемыми, соответственно); Уровни мРНК гена CB2R (среднее ± SE условных единиц: 0,40 ± 0,01 против 0,43 ± 0,02, P > 0,05 в МПДМ детей с аутизмом и здоровых людей соответственно) не изменялись (рис. 2).
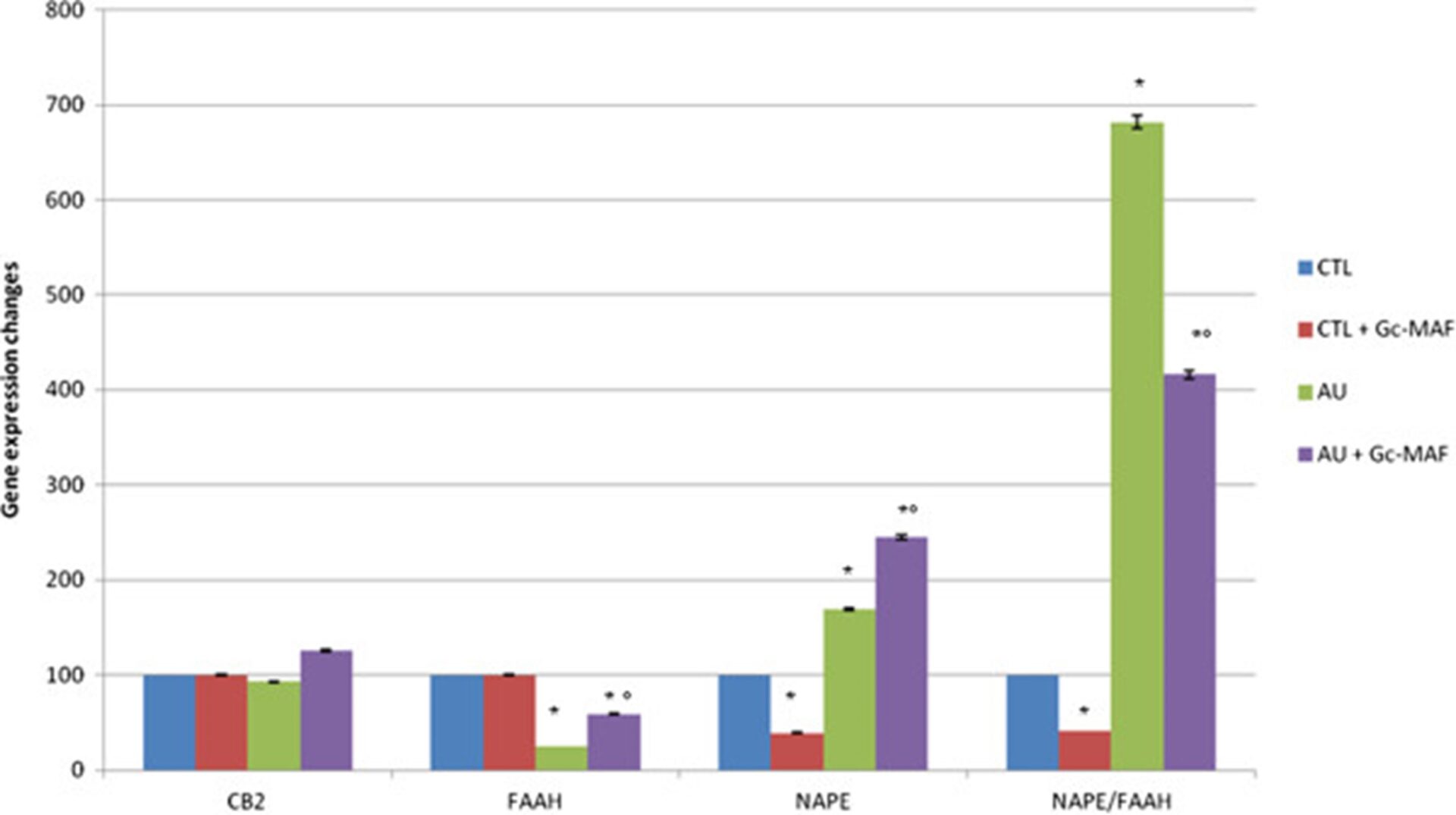
Экспрессия ферментов NAPE-PLD и FAAH, а также генов CB2R в моноцитарных макрофагах крови (BMDM). Также сообщалось о соотношении NAPE/FAAH. Измеренные уровни мРНК были нормализованы по отношению к GAPDH (ген домохозяйки), а значения экспрессии генов были выражены в процентах от произвольных единиц ± SEM. * указывает на существенную разницу по сравнению со здоровыми контрольными группами; ° указывает на значимую разницу по сравнению с нелеченными БМДМ с аутизмом GcMAF. P-значения <0,05 считались статистически значимыми. CTL, здоровые испытуемые контроля; AU, аутичные пациенты. Значения были представлены в процентах по сравнению со здоровыми контрольными значениями.
При МПДМ детей с аутизмом лечение GcMAF было способно значительно увеличить экспрессию генов как NAPE-PLD (среднее ± SE условных единиц: 1,20 ± 0,34 и 1,74 ± 0,18, P < 0,05, до и после лечения GcMAF при МПДМ с аутизмом соответственно), так и FAAH (среднее ± SE условных единиц: 0,40 ± 0,08 против 0,95 ± 0,04, P < 0,05, до и после лечения GcMAF при МПДМ с аутизмом, соответственно), в то время как соотношение NAPE-PLD/FAAH было достоверно снижено (среднее ± SE условных единиц: 3,00 ± 0,84 против 1,83 ± 0,19 до и после лечения GcMAF при БМДМ с аутизмом, соответственно).
На уровни мРНК гена CB2R лечение GcMAF не влияло (среднее ± SE условных единиц: 0,40 ± 0,01 против 0,54 ± 0,01, P > 0,05 до и после лечения GcMAF при МПДМ с аутизмом соответственно). Не наблюдалось никаких изменений в МПДМ, получавших GcMAF, у здоровых детей контрольной группы по сравнению с необработанными МПДМ, за исключением незначительного снижения экспрессии гена NAPE-PLD (не влияющего на соотношение NAPE-PLD/FAAH) (рисунок 2).
GcMAF повлиял на уровень белка CB2R в БМДМ
GcMAF также смог снизить уровень белка CB2R в МПДМ у детей с аутизмом по сравнению с МПДМ, получавшими лечение у здоровых людей из контрольной группы. Поскольку CB2R являются рецепторами, связанными с G-белком, у них наблюдается посттрансляционная регуляция [33]. Поэтому мы определили уровень белка CB2R с помощью вестерн-блоттинг-анализа.
Вестерн-блоттинг показал сильное снижение уровня белка CB2R в МПДМ, получавших GcMAF от детей с аутизмом, по сравнению с необработанными макрофагами (среднее ± SE условных единиц: 3,24 ± 0,54 против 1,66 ± 0,39, P < 0,05 до и после лечения GcMAF у аутичных МПДМ соответственно).
Интересно, что GcMAF также смог снизить уровни белка CB2R в МПДМ, получавших GcMAF из здоровой контрольной группы, по сравнению с необработанными МПДМ (Рисунок 3) (среднее ± СЭ условных единиц: 5,97 ± 0,34 против 2,39 ± 0,43, P < 0,05 до и после обработки GcMAF у здоровых контрольных МПДМ соответственно).
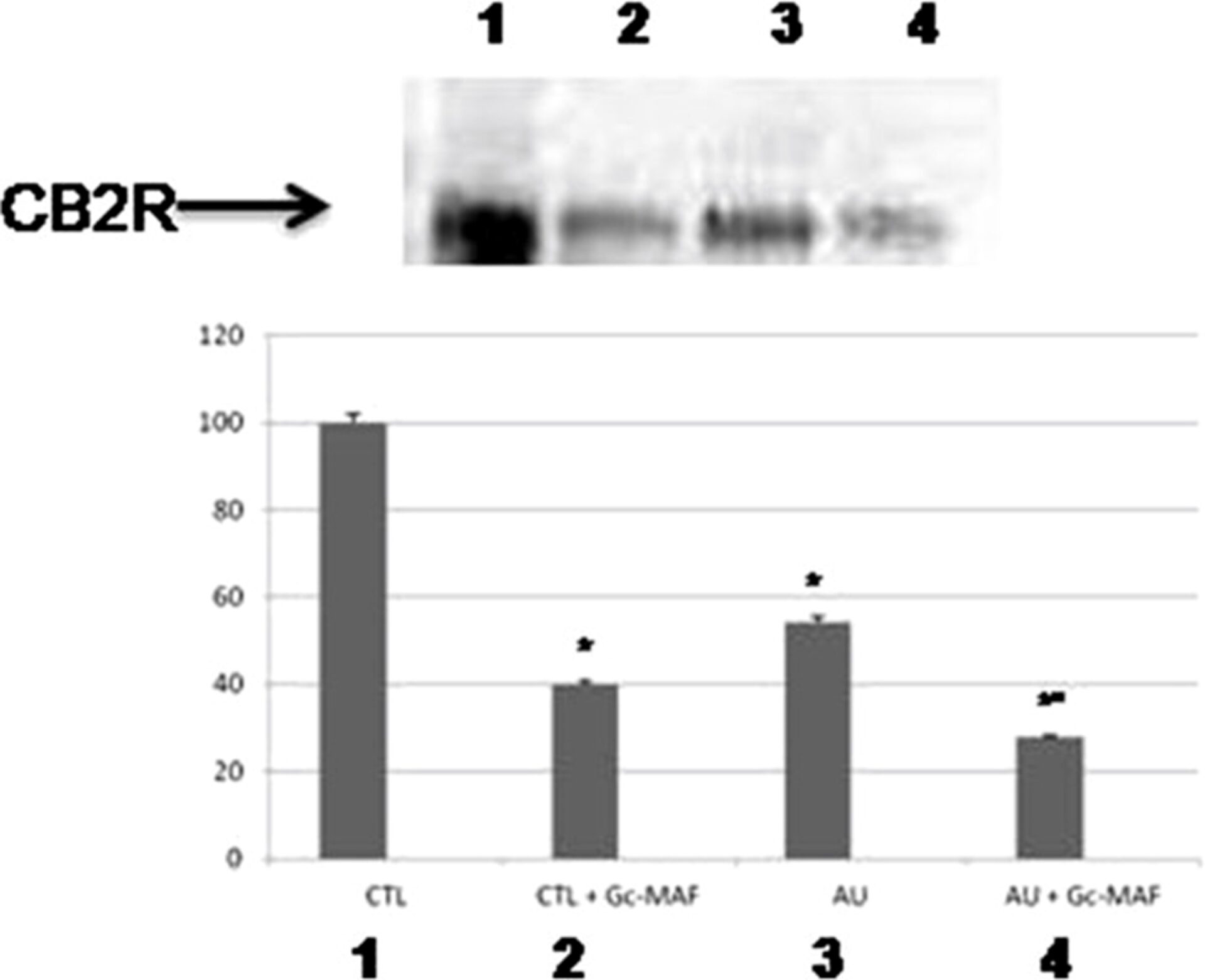
Репрезентативный вестерн-блоттинг-анализ уровней белка CB2R в моноцитарных макрофагах крови (МПДМ), полученных от детей с аутизмом и здоровых детей контрольной группы. (1) необработанные МПДМ от здоровых контрольных субъектов; (2) БМДМ, обработанные GcMAF, от здоровых контрольных субъектов; (3) нелеченные МПДМ у пациентов с аутистическими расстройствами; (4) МПДМ, обработанные Gc-MAF, у пациентов с аутистическими расстройствами.
Гистограммы показывают процентные колебания уровней белка CB2R в МПДМ. * указывает на значительную разницу по сравнению со здоровыми контрольными группами; ° указывает на существенную разницу по сравнению с нелеченными МПДМ с аутизмом GcMAF.
Разница между неизмененными уровнями мРНК CB2R и снижением уровня белка CB2R в аутичных клетках, обработанных GcMAF, не удивительна, как мы уже показали [19]. Действительно, посттрансляционный контроль влияет на уровень и функции белка. Уровни CB2R в клетке строго регулируются в многоуровневой системе регуляции [34], и прямой корреляции между транскриптами мРНК и уровнями белка нет [19].
GcMAF способен вызвать общую деактивацию макрофагов в образцах с аутизмом
Для проверки клеточной активации проводили флуоресцентный иммуноцитохимический анализ на культуре клеток макрофагов. В частности, ранее было проведено окрашивание Notch. Notch — белок, в основном участвующий в поддержании стволовых клеток, клеточной дифференцировке и регуляции клеточного гомеостаза [35]; тем не менее, сигнальный путь Notch был обнаружен в активированных провоспалительных макрофагах и участвует в регуляции экспрессии il12p40 [36].
Недавно было высказано предположение о предполагаемой роли Notch-сигнализации при аутизме [37]. Мы не обнаружили каких-либо изменений в профилях иммуноокрашивания Notch в обработанных GcMAF макрофагах, полученных из моноцитов крови детей с аутизмом, по сравнению с необработанными клетками макрофагов, проанализированных с помощью флуоресцентной микроскопии (рис. 4).
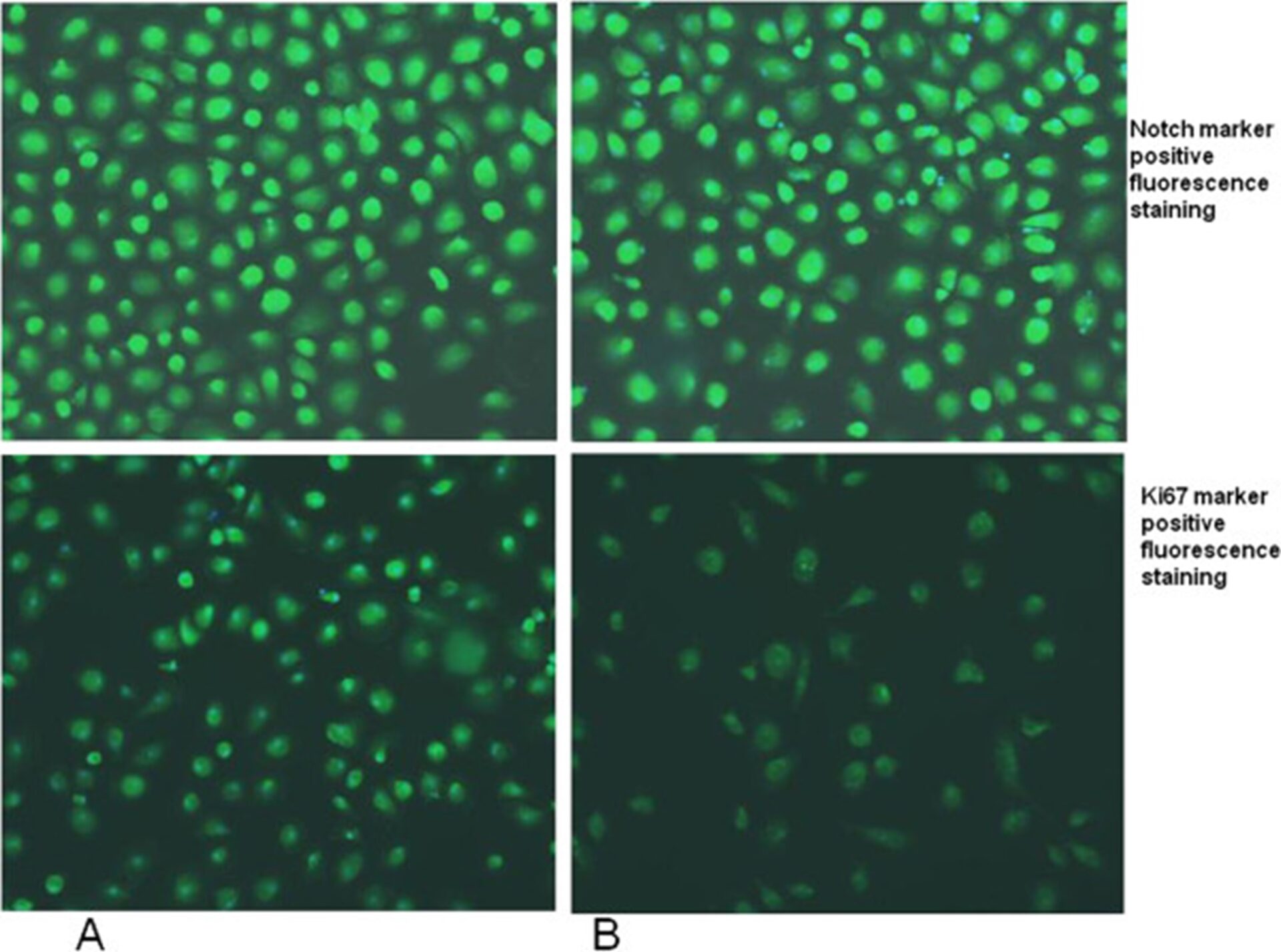
Репрезентативная флуоресцентная микрофотография моноцитарных макрофагов крови (МПДМ) пациентов с аутизмом, демонстрирующая иммуноцитохимию (зеленая флуоресцентная) на маркеры Notch (вверху) и Ki67 (внизу). Чтобы правильно идентифицировать клетки, их ядра окрашивали бисбензимидом (синяя флуоресценция). (А) необработанные БМДМ; (B) БМДМ, обработанные GcMAF.
Поскольку макрофаги обладают способностью к пролиферации [38], мы исследовали влияние GcMAF на эту клеточную активность с помощью иммуноокрашивания маркером пролиферации Ki67.
Интересно, что лечение GcMAF показало снижение иммуноокрашивающих профилей маркера пролиферации Ki67 у обработанных GcMAF моноцитарных макрофагов у детей с аутизмом по сравнению с необработанными клетками макрофагов (рис. 4). Мы количественно оценили это снижение с помощью конфокальной флуоресцентной микроскопии, показав снижение на 23% моноцитарных макрофагов у детей с аутизмом, получавших лечение GcMAF, по сравнению с необработанными клетками макрофагов (среднее ± SE условных единиц: 0,32 ± 0,04 против 0,24 ± 0,06, P < 0,05, до и после лечения GcMAF у аутичных МПДМ, соответственно) (Рисунок 5).
GcMAF также был способен снижать иммуноокрашивание Ki67 в МПДМ здоровой контрольной группы по сравнению с необработанными клетками макрофагов (среднее ± SE произвольных единиц: 0,17 ± 0,01 против 0,012 ± 0,003, P < 0,05 до и после лечения GcMAF у здоровых контрольных МПДМ, соответственно) (рисунок не показан).
Следует отметить, что МПДМ у аутичных детей были более активированы, чем МПДМ у здоровых людей (среднее ± СЭ условных единиц: 0,32 ± 0,04 против 0,17 ± 0,01, P < 0,05 у МПДМ у детей с аутизмом и здоровых людей соответственно).
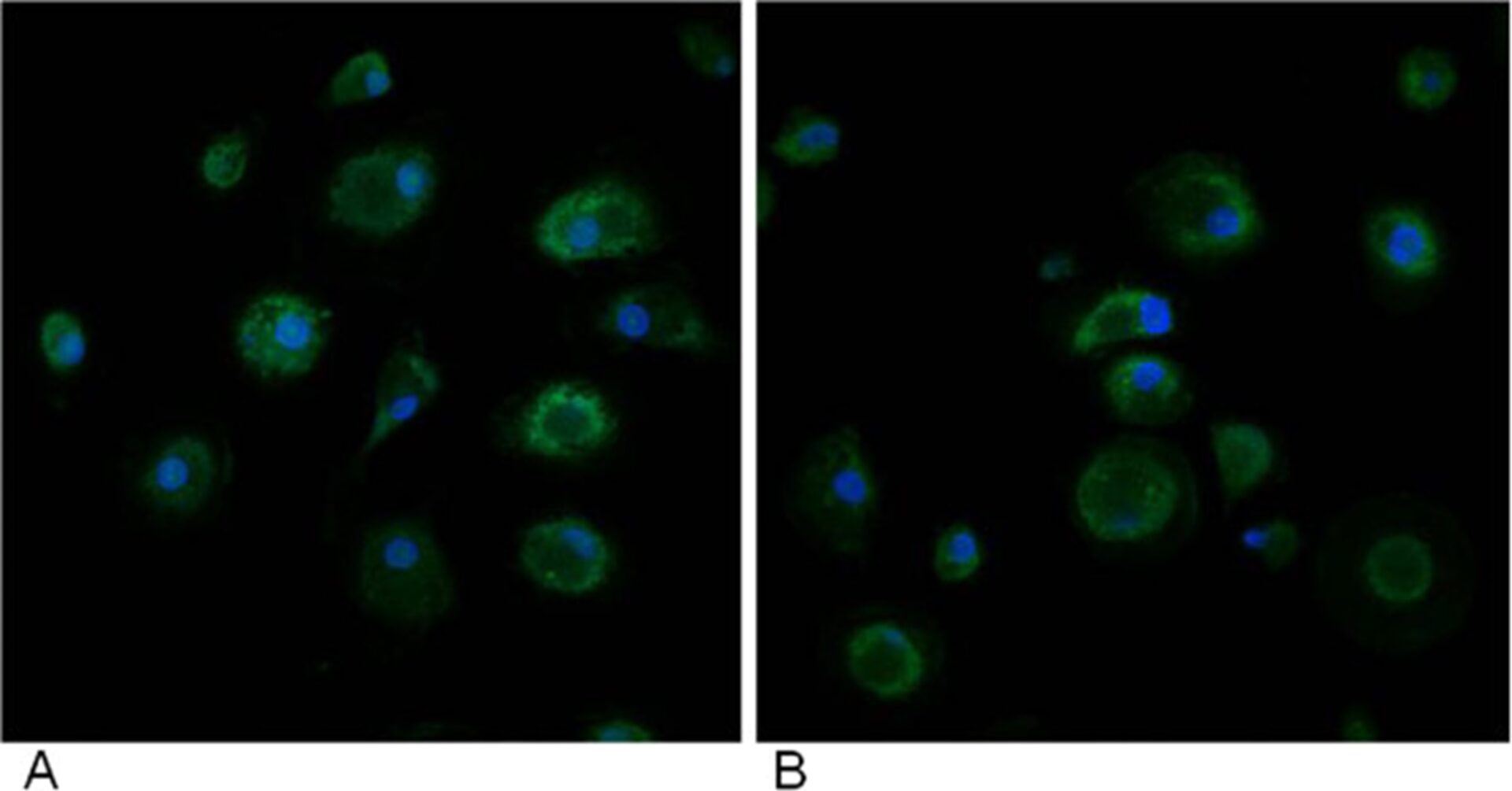
Репрезентативная количественная флуоресцентная конфокально-микрофотография моноцитарных макрофагов крови (МПДМ) у пациентов с аутизмом, демонстрирующая иммуноцитохимию (зеленая флуоресцентная) на маркер Ki67.
Чтобы правильно идентифицировать клетки, их ядра окрашивали бисбензимидом (синяя флуоресценция). (А) необработанные БМДМ; (B) БМДМ, обработанные Gc-MAF.
GcMAF смог снизить уровень белка альтернативного активированного маркера макрофагов фенотипа М2
Для дальнейшего изучения эффекта GcMAF в специфической клеточной активации в макрофагах мы количественно определяли уровни белка рецептора маннозы с помощью вестерн-блоттинг-анализа.
Рецептор маннозы макрофагов (альтернативное название CD206) опосредует эндоцитоз гликопротеинов макрофагами и считается специфическим маркером для альтернативных активированных макрофагов фенотипа М2 [39,40].
Вестерн-блоттинг показал снижение уровня белка рецептора маннозы у МПДМ аутичных детей, получавших GcMAF, по сравнению с необработанными макрофагами (среднее ± SE условных единиц: 28,1 ± 0,41 против 16,7 ± 0,94, P < 0,05, до и после лечения Gc-MAF у аутичных МПДМ, соответственно) (рис. 6).
GcMAF также смог снизить уровни белка маннозных рецепторов в МПДМ, получавших GcMAF из здоровой контрольной группы, по сравнению с необработанными МПДМ (среднее ± SE условных единиц: 26,8 ± 0,21 против 18,9 ± 0,47, P < 0,05, до и после обработки GcMAF у здоровых контрольных МПДМ, соответственно) (Рисунок 6).
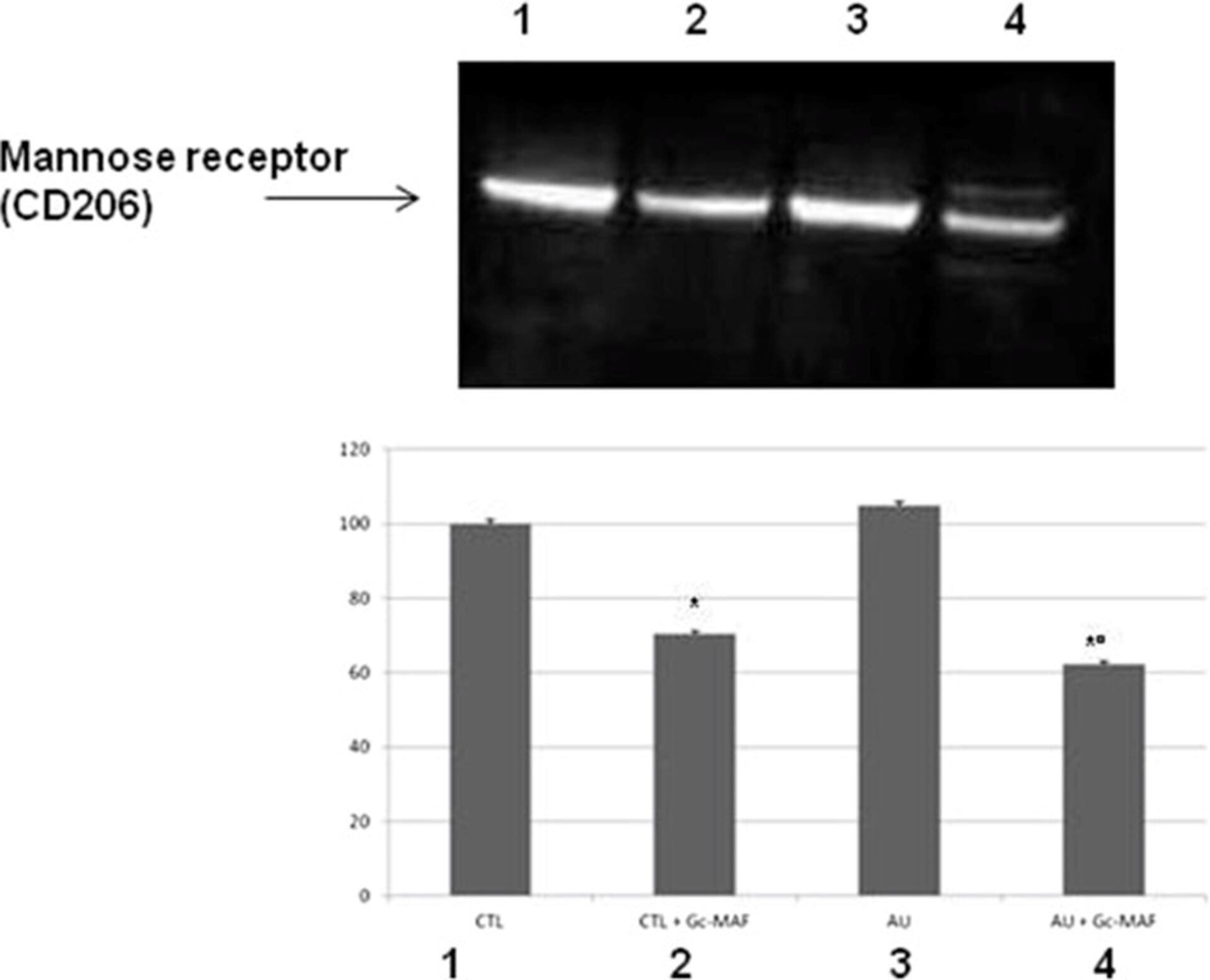
Репрезентативный вестерн-блоттинг-анализ уровней белка рецептора маннозы в моноцитарных макрофагах крови (МПДМ), полученных от детей с аутизмом и здоровых детей контрольной группы. (1) необработанные МПДМ от здоровых контрольных субъектов; (2) БМДМ, обработанные GcMAF, от здоровых контрольных субъектов; (3) нелеченные МПДМ у пациентов с аутистическими расстройствами; (4) МПДМ, обработанные GcMAF, у пациентов с аутистическими расстройствами. Гистограммы показывают процентные колебания уровней белка рецептора маннозы в МПДМ. * указывает на значительную разницу по сравнению со здоровыми контрольными группами; ° указывает на существенную разницу по сравнению с нелеченными БМДМ с аутизмом GcMAF.
Обсуждение
В этом исследовании мы впервые продемонстрировали, что каннабиноидная система опосредована биомолекулярным механизмом и клеточным эффектом GcMAF в культивируемых BMDM, полученных от аутичных пациентов.
Противораковые эффекты GcMAF были описаны с тех пор, как Yamamoto, et al. [41] впервые продемонстрировали активирующие макрофаги белок витамина D и связь со специфическим гликозилированием белка-предшественника Gc [41]. Было высказано предположение, что GcMAF обладает опухолеубивающей активностью за счет активации макрофагов [42]. Макрофаги, активированные GcMAF, действительно способны распознавать аномалии поверхности опухолевых клеток благодаря значительной вариативности своих рецепторов: таким образом, они оказывают один мощный опухолецидный эффект [43].
Kanda et al., [44] впервые описали еще один противоопухолевый эффект GcMAF, связанный с ингибированием ангиогенеза, предположительно опосредованным через рецептор CD36, в то время как Solinas et al., [45] наблюдали непсихоактивный CB2R-связывающий каннабиноид CBD также ингибировал неоангиогенез. Аналогичным образом, кальцитриол (1,25-дигидроксивитамин D3) также оказывает антиангиогенезное действие, создавая интересную потенциальную связь между витамином D, GcMAF и системой EC в этиологии и патологии многочисленных иммуноопосредованных расстройств, включая аутизм [46,47].
Что касается аутизма, гипотеза дефицита витамина D была широко исследована, при этом пренатальный и/или ранний постнатальный дефицит витамина D демонстрирует повышенный риск развития [48,49]. В настоящее время аутизм рассматривается как многофакторное заболевание, связанное со сложными генетическими и средовыми взаимодействиями, способствующими различным факторам риска [2].
Более того, диетический витамин D, по-видимому, участвует в сложных эпигенетических событиях. Витамин D через свой рецептор ядерного гормона, активируемый лигандом, участвует в регуляции провоспалительных генов, а также в ключевых клеточных событиях [2].
Активность нагалазы повышена в сыворотке крови детей с аутизмом [16]. Как мы уже упоминали ранее, нагалаза является ферментом, ответственным за дегликозилирование витамина D-связывающего белка (VDBP), также известного как Gc-глобулин (группоспецифический компонент).
Gc-глобулин является предшественником GcMAF, поэтому Nagalase вмешивается в регуляцию макрофагов, снижая продукцию GcMAF [50]. Таким образом, предсказуемым следствием повышенной активности нагалазы в сыворотке крови детей с аутизмом является иммуносупрессия, аналогичная наблюдаемым эффектам у аутоиммунных больных, например, СКВ [18].
Показано, что в МПМК GcMAF способен увеличивать продукцию второго мессенджера циклического АМФ [28]. Эти данные, в сочетании с нашими текущими наблюдениями, демонстрирующими, что GcMAF нормализует экспрессию гена EC, усиливают гипотезу о потенциальном действии GcMAF на систему EC.
Действительно, в основе системы ЕС лежат рецепторы, связанные с белками G(i/o), которые ассоциированы с ингибированием циклического образования АМФ [51]. В случае с МПДМ у детей с аутизмом мы оценили, может ли участие ЭК-сигналов привести к снижению циклического АМФ.
Мы обнаружили увеличение АЭА-биосинтетического фермента NAPE-PLD вместе со снижением экспрессии катаболического фермента АЭА FAAH, что указывает на общее повышение уровня АЭА ЕС. AEA является естественным агонистом CB2R и подавляет циклическую выработку АМФ. Агонист-индуцированное ингибирование аденилатциклазы в клетках, экспрессирующих CB2R человека [52].
Наши результаты подтверждают влияние GcMAF на систему EC, что может привести к нормализации циклической активности AMP.
Наши текущие результаты еще раз подтверждают участие системы ЭК в иммунологических нарушениях, связанных с аутизмом. Ранее мы обнаружили, что CB2R были сильно повышены в PBMC у аутичных детей [19].
Наблюдения, сделанные в настоящем исследовании, согласуются с нашей гипотезой о том, что система ЭК при аутизме управляет очевидной связью периферических и центральных нейроиммунологически опосредованных эффектов при аутизме. Интересно, что в то время как в нашей предыдущей работе CB2R был чрезмерно активирован в PBMC у аутичных детей, в настоящем исследовании мы обнаружили снижение уровня белка CB2R в МПДМ у аутичных пациентов.
Принимая во внимание различие между двухклеточными системами, поскольку клетки МПДМ путем дифференцировки получают из PBMC, этот результат может указывать на двойственную роль CB2R: активация в моноцитах для запуска иммунного дисбаланса и дезактивация в дифференцированных макрофагах для дальнейшего сохранения иммунной дисрегуляции [19].
Тот факт, что GcMAF смог уменьшить окрашивание маркеров пролиферации Ki67 вместе со снижением CD206-положительных профилей в BMDM, не удивителен. Действительно, было продемонстрировано, что макрофаги изменены при аутизме, и эта патология сопровождается активацией макрофагов вместе с иммунными изменениями и избыточной продукцией провоспалительных цитокинов (то есть IL-1β) [53,54].
В частности, Al-Ayadhi и Mostafa [55] обнаружили хемокин, происходящий из макрофагов (MDC) и тимуса и активационно-регулируемый хемокин (TARC), оба были значительно повышены в сыворотке крови с РАС и в дальнейшем продемонстрировали уровень повышения обоих маркеров, напрямую коррелирующих с тяжестью аутизма [55].
Molloy et al., (2006) также продемонстрировали преимущественно цитокиновый сдвиг Th2 в сыворотке крови детей с аутизмом [56]. В этом исследовании наши результаты до и после Ki67 и CD206 согласуются с наблюдениями за макрофагами Th2/M2 и тенденцией к аутоиммунным заболеваниям. Макрофаги не статичны и могут легко переходить из незрелых форм в состояния М1 и М2 в зависимости от местной тканевой сигнализации [57].
Недавно другая когорта итальянских детей была оценена на наличие антител к мозгу [58]. В этом исследовании наличие специфических профилей антител к мозгу было связано с тяжестью когнитивных нарушений при аутизме.
Способность комменсальных или патогенных микробов вызывать иммунную дисрегуляцию и аутоиммунные заболевания с возникающими нейропсихиатрическими симптомами была недавно рассмотрена Hornig [59].
Профиль CB2R, наблюдаемый в этом исследовании, согласуется с этими механизмами и может быть связан либо с инфекцией, либо с изменением микробиома кишечника, как показано на мышиной модели аутизма [60]. В этом исследовании на мышах изменение короткоцепочечных жирных кислот в результате воздействия вальпроата смоделировало аутичные характеристики у мышей.
EC получают из пищевых жирных кислот. Несколько исследований иллюстрируют влияние диеты на уровень ЭК в крови, тканях и головном мозге [61,62]. Таким образом, измеренные различия в этом исследовании в CB2R могут быть следствием изменений в диете и/или микробиоме в популяции аутизма по сравнению с контрольной группой.
Выводы
Это исследование демонстрирует биомолекулярный эффект GcMAF при МПДМ у пациентов с аутизмом, предоставляя дополнительные доказательства положительного использования этой молекулы в лечении аутизма. Также представляется вероятным, что CB2R является потенциальной терапевтической мишенью для вмешательств при РАС. Эти первоначальные результаты потребуют дальнейшего изучения, чтобы лучше прояснить молекулярные пути, участвующие в эффектах GcMAF.
Сокращения
РАС: расстройство аутистического спектра; АЭА: N-арахидоноилэтаноламид; 2-AG: 2-арахидоноилглицерин; БМДМ: макрофаги, полученные из моноцитов крови; КБД: каннабидиол; CB2R: каннабиноидный рецептор типа 2; DSM-IV-TR: Диагностическое и статистическое руководство по психическим расстройствам-IV критерии аутизма; ЭК: эндоканнабиноид; FAAH: амидгидролаза жирных кислот; FBS: фетальная сыворотка крупного рогатого скота; NK: натуральный убийца; ГАПДГ: глицеральдегид-3-фосфатдегидрогеназа; GcMAF: фактор активации макрофагов Gc; ИЛ: интерлейкин; NAPE-PLD: N-ацилфосфатидилэтаноламинфосфолипаза D; ПЭТ: позитронно-эмиссионная томография; ПБМК: мононуклеарные клетки периферической крови; PBS: Фосфатный буферный раствор; PDD-NOS: первазивное расстройство развития — не указано иное; ОТ-ПЦР: полимеразная цепная реакция с обратной транскриптазой; RPMI: Мемориальный институт Розуэлл-Парка; СКВ: системная красная волчанка; VDBP: белок, связывающий витамин D3.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Вклад авторов
Д.С. спроектировал исследование, провел биохимический и иммуноцитохимический эксперименты, выполнил статистический анализ и написал рукопись. JJB участвовал в дизайне исследования, написал рукопись и отредактировал английский язык. Компания AC проводила биомолекулярные эксперименты. НС задумал исследование, участвовал в его разработке и оказал финансовую поддержку. Все авторы прочитали и одобрили окончательный вариант рукописи.
Подтверждения
Прежде всего, мы благодарим многие семьи с аутизмом, которые добровольно согласились принять участие в этом исследовании. Авторы выражают благодарность г-же Джованне Галлоне, г-ну Энцо Абате и некоммерческим организациям ‘Cancellautismo’ и ‘La Forza del Silenzio’ — Италия за их полезную помощь. Мы благодарим Дэвида Ноукса и компанию Immuno Biotech — St. Peter Port, Гернси, за предоставление GcMAF.
Ссылки
Американская психиатрическая ассоциация. Диагностическое и статистическое руководство по психическим расстройствам, пересмотр текста. 4. Вашингтон, округ Колумбия, США: Американская психиатрическая ассоциация; 2000. [Google Scholar]
Синискалько Д., Чирилло А., Брэдстрит Дж.Дж., Антонуччи Н. Эпигенетические находки при аутизме: новые перспективы терапии. Int J Environ Res Public Health. 2013; 10(9):4261–4273. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Синискалько Д. Современные результаты и перспективы исследований в области расстройств аутистического спектра. Аутизм. 2013; S2:e001. [Google Академия]
Синискалко Д., Кубала-Кухарска М. Лечение ребенка с аутизмом – новейшие медицинские тенденции. Аутизм. 2013; 3:110. [Google Академия]
Синискалько Д., Сапоне А., Чирилло А., Джордано С., Майоне С., Антонуччи Н. Расстройства аутистического спектра: будущее за персонализированной терапией мезенхимальными стволовыми клетками? J Biomed Biotechnol. 2012; 2012:480289. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Лайалл К., Эшвуд., Ван де Уотер Дж., Герц-Пиччотто И. Материнские иммуноопосредованные состояния, расстройства аутистического спектра и задержка развития. J Аутизм Дев Дисорд. 2013. Epub перед печатью. [Бесплатная статья о PMC] [PubMed]
Синискалько Д., Брэдстрит Дж.Дж., Антонуччи Н. Терапевтическая роль гемопоэтических стволовых клеток при воспалении, связанном с расстройством аутистического спектра. Передний Иммунол. 2013; 4:140. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Оноре К., Кареага М., Эшвуд. Роль иммунной дисфункции в патофизиологии аутизма. Поведение мозгаИммунный. 2012; 26(3):383–392. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Синискалько Д., Сапоне А., Джордано К., Чирилло А., де Новеллис В., де Магистрис Л., Росси Ф., Фазано А., Майоне С., Антонуччи Н. Экспрессия каспаз усиливается в мононуклеарных клетках периферической крови пациентов с расстройствами аутистического спектра. J Аутизм Дев Дисорд. 2012; 42(7):1403–1410. DOI: 10.1007/s10803-011-1373-z. [PubMed] [Перекрестная ссылка] [Google Академия]
Гезундхайт Б., Розенцвейг Дж.., Наор Д., Лерер Б., Захор Д.А., Прохазка В., Меламед М., Кристт Д.А., Стейнберг А., Шульман С., Хван., Корен Г., Вальфиш А., Пассвег Дж.Р., Сноуден Дж.А., Тамуза Р., Лебойе М., Фарж-Бансель Д., Эшвуд. Иммунологические и аутоиммунные аспекты расстройств аутистического спектра. J Аутоиммун. 2013; 44:1–7. [PubMed] [Google Академия]
Бауман М.Д., Иосиф А.М., Эшвуд., Брауншвейг Д., Ли А., Шуман С.М., Ван де Уотер Дж., Амарал Д.Г. Материнские антитела от матерей детей с аутизмом изменяют рост мозга и развитие социального поведения у макак-резусов. Трансл Психиатрия. 2013; 3:э278. DOI: 10.1038/TP.2013.47. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
ДеЛука Г.К., Кимбалл С.М., Коласински Дж., Рамагопалан С.В., Эберс Г.К. Обзор: роль витамина D в здоровье и болезнях нервной системы. Нейропатол Аппл Нейробиол. 2013; 39(5):458–484. DOI: 10.1111/nan.12020. [PubMed] [Перекрестная ссылка] [Google Академия]
Ота К., Дамбаева С., Хан А.Р., Биман К., Гилман-Сакс А., Квак-Ким Дж. Хум Репрод. 2014; 29(2):208–219. DOI: 10.1093/humrep/det424. [PubMed] [Перекрестная ссылка] [Google Академия]
Флетчер Дж.М., Басдео С.А., Аллен А.К., Данн.Дж. Терапевтическое применение витамина D и его аналогов при аутоиммунных заболеваниях. Недавний препарат от аллергии Pat Inflamm Discov. 2012; 6(1):22–34. DOI: 10.2174/187221312798889239. [PubMed] [Перекрестная ссылка] [Google Академия]
Кэннелл Дж.Дж., Грант В.Б. Какова роль витамина D при аутизме? Дерматоэндокринол. 2013; 5(1):199–204. DOI: 10.4161/derm.24356. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Брэдстрит Дж.Дж., Вогелаар Э., Тайер Л. Первоначальные наблюдения повышенной активности альфа-N-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдаемого снижения от инъекций Gcprotein-макрофагального активирующего фактора. Аналитика аутизма. 2012; 4:31–38. [Google Академия]
Ямамото Н., Нарапараджу В.Р. Иммунотерапия мышей BALB/c, несущих асцит Эрлиха, опухолью с активирующим фактором макрофагов на основе витамина D. Cancer Res. 1997; 57(11):2187–2192. [PubMed] [Google Академия]
Ямамото Н., Нарапараджу В.Р., Мур М., Брент Л.Х. Дегликозилирование сывороточного витамин-D3-связывающего белка альфа-N-ацетилгалактозаминидазой, выявленное в плазме крови пациентов с системной красной волчанкой. Клин Иммунол Иммунопатол. 1997; 82(3):290–298. DOI: 10.1006/clin.1996.4320. [PubMed] [Перекрестная ссылка] [Google Академия]
Синискалько Д., Сапоне А., Джордано С., Чирилло А., де Маджистрис Л., Росси Ф., Фазано А., Брэдстрит Дж.Дж., Майоне С., Антонуччи Н. Каннабиноидный рецептор типа 2, но не типа 1, повышается в мононуклеарных клетках периферической крови детей, страдающих аутистическими расстройствами. J Аутизм Дев Дисорд. 2013; 43(11):2686–2695. DOI: 10.1007/s10803-013-1824-9. [PubMed] [Перекрестная ссылка] [Google Академия]
Ахмад Р., Куле М., Ивенс Н., Сердонс К., Вербрюгген А., Борманс Г., Ван Лаэре К. Биораспределение всего тела и дозиметрия излучения лиганда рецептора каннабиноида 2-го типа [11C]-NE40 у здоровых людей. Mol Imaging Biol. 2013; 15(4):384–390. DOI: 10.1007/s11307-013-0626-y. [PubMed] [Перекрестная ссылка] [Google Академия]
Заррук Дж.Г., Фернандес-Лопес Д., Гарсия-Йебенес И., Гарсия-Гутьеррес М.С., Виванкос Х., Номбела Ф., Торрес М., Бургете М.С., Мансанарес Дж., Лизасоаин И., Моро М.А. Активация каннабиноидных рецепторов 2-го типа подавляет индуцированную инсультом классическую и альтернативную активацию макрофагов/микроглии головного мозга, сопутствующую нейропротекции. Удар. 2012; 43(1):211–219. DOI: 10.1161/STROKEAHA.111.631044. [PubMed] [Перекрестная ссылка] [Google Академия]
Пачер., Баткай С., Кунос Г. Система ЭК как новая мишень фармакотерапии. Pharmacol Rev. 2006; 58(3):389–462. DOI: 10.1124/pr.58.3.2. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Лорд К., Раттер М., Ле Кутёр А. Пересмотренное диагностическое интервью с аутизмом: пересмотренная версия диагностического интервью для лиц, осуществляющих уход за лицами с возможными первазивными нарушениями развития. J Аутизм Дев Дисорд. 1994; 24(5):659–685. DOI: 10.1007/BF02172145. [PubMed] [Перекрестная ссылка] [Google Академия]
Шоплер Э., Райхлер Р.Дж., Реннер Б.Р. Шкала оценки детского аутизма (CARS) Лос-Анджелес, Калифорния: Западная психологическая служба; 1993. [Google Scholar]
Лорд К., Ризи С., Ламбрехт Л., Кук Э.Х. мл., Левенталь Б.Л., ДиЛавор.К., Пиклз А., Раттер М. Диагностический график наблюдения за аутизмом — общий: стандартная мера социального и коммуникативного дефицита, связанного со спектром аутизма. J Аутизм Дев Дисорд. 2000; 30(3):205–223. doi: 10.1023/A:1005592401947. [PubMed] [Перекрестная ссылка] [Google Академия]
Росси Ф., Синискалько Д., Луонго Л., Де Петрочеллис Л., Беллини Г., Петрозино С., Торелла М., Санторо К., Нобили Б., Перротта С., Ди Марцо В., Майоне С. Эндованиллоидная/эндоканнабиноидная система в остеокластах человека: возможное участие в формировании и резорбции костной ткани. Кость. 2009; 44(3):476–484. DOI: 10.1016/j.bone.2008.10.056. [PubMed] [Перекрестная ссылка] [Google Академия]
Креспо Х., Рейна Р., Глария И., Рамирес Х., де Андрес Х., Хауреги., Лухан Л., Мартинес-Помарес Л., Аморена Б., де Андрес Д.Ф. Идентификация рецептора маннозы овец и его возможная роль в инфицировании вирусом Висна/Маэди. Vet Res. 2011; 42:28. DOI: 10.1186/1297-9716-42-28. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Пачини С., Моруччи Г., Пунци Т., Гулизано М., Руджеро М. Макрофагально-активирующий фактор (GcMAF) на основе белка Gc стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоической мембраны эмбриона цыпленка. Рак Иммунол Иммунотер. 2011; 60(4):479–485. DOI: 10.1007/s00262-010-0953-7. [PubMed] [Перекрестная ссылка] [Google Академия]
Стамова Б.С., Апперсон М., Уокер В.Л., Тянь Ю., Сюй Х., Адамци., Чжань Х., Лю Д.З., Андер Б.., Ляо И.Х., Грегг Дж.., Тернер Р.Дж., Джиклинг Г., Лит Л., Шарп Ф.Р. Идентификация и валидация подходящих эндогенных референсных генов для исследований экспрессии генов в периферической крови человека. БМК Мед Геномика. 2009; 2:49. DOI: 10.1186/1755-8794-2-49. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Брэдфорд М.М. Быстрый и чувствительный метод квантования микрограммовых количеств белка, использующий принцип связывания белка с красителем. Анальный биохим. 1976; 72:248–254. DOI: 10.1016/0003-2697(76)90527-3. [PubMed] [Перекрестная ссылка] [Google Академия]
Ли Р., Шэнь Ю. Старый метод, столкнувшийся с новой проблемой: повторный пересмотр хозяйственных белков в качестве внутреннего референсного контроля для исследований в области нейробиологии. Наука о жизни. 2013; 92(13):747–751. DOI: 10.1016/j.lfs.2013.02.014. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Джордано К., Синискалько Д., Мелизи Д., Луонго Л., Курчо А., Соукупова М., Палаццо Э., Марабезе И., Де Кьяро М., Римоли М.Г., Росси Ф., Майоне С., де Новеллис В. Галактозилирование N(ω)-нитро-L-аргинина усиливает его антиноцифенсивные или антиаллодинические эффекты, воздействуя на глию у здоровых и нейропатических мышей. Eur J Pharmacol. 2011; 656(1–3):52–62. [PubMed] [Google Академия]
Ардура Дж.А., Фридман.А. Регуляция функции рецепторов, связанных с G-белком, с помощью регуляторных факторов обмена Na+/H+. Pharmacol Rev. 2011; 63(4):882–900. DOI: 10.1124/pr.110.004176. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Перальта Л., Агиррегойтия Э., Мендоса Р., Экспозито А., Касис Л., Маторрас Р., Агиррегойтия Н. Экспрессия и локализация каннабиноидных рецепторов в незрелых ооцитах человека и неоплодотворенных ооцитах метафазы-II. Reprod Biomed Online. 2011; 23(3):372–379. DOI: 10.1016/j.RBMO.2011.05.011. [PubMed] [Перекрестная ссылка] [Google Академия]
Буньятеха Н., Сангпхеч Н., Вонгчана В., Куеанджинда., Палага Т. Участие сигнального пути Notch в регуляции экспрессии IL-12 через c-Rel в активированных макрофагах. Мол Иммунол. 2012; 51(3–4):255–262. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Чжан И., Юань С., Ван З., Ли Р. Канонический Wnt-сигнальный путь при аутизме. Лекарственные мишени для ЦНС NeurolDisord. 2013. [Epub перед печатью] [PubMed]
Хаазе Й., Вейер У., Иммиг К., Клётинг Н., Блюхер М., Эйлерс Дж., Бехманн И., Герике М. Локальная пролиферация макрофагов в жировой ткани при воспалении, вызванном ожирением. Диабетология. 2014; 57(3):562–71. DOI: 10.1007/s00125-013-3139-y. [PubMed] [Перекрестная ссылка] [Google Академия]
Киттан Н.А., Аллен Р.М., Даливал А., Кавассани К.А., Шаллер М., Галлахер К.А., Карсон В.Ф. 4-й, Мукерджи С., Грембека Дж., Черпицки Т., Джарай Г., Вествик Дж., Кункель С.Л., Хогабоам С.М. Цитокин-индуцированные фенотипические и эпигенетические сигнатуры являются ключом к установлению специфических фенотипов макрофагов. PLoS One. 2013; 8(10):Э78045. DOI: 10.1371/journal.pone.0078045. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Синискалько Д., Джордано С., Галдеризи У., Луонго Л., де Новеллис В., Росси Ф., Майоне С. Долгосрочные эффекты системного введения мезенхимальных стволовых клеток человека на болевое поведение, клеточные и биомолекулярные модификации у нейропатических мышей. Передний интегральный невроз. 2011; 5:79. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Ямамото Н., Уиллетт Н.., Линдсей Д.Д. Участие сывороточных белков в активации макрофагов, вызванной воспалением. Воспаление. 1994; 18(3):311–322. DOI: 10.1007/BF01534272. [PubMed] [Перекрестная ссылка] [Google Академия]
Нонака К., Онидзука С., Исибаси Х., Уто Ю., Хори Х., Накаяма Т., Мацуура Н., Канэмацу Т., Фудзиока Х. Фактор активации белка и макрофагов витамина D ингибирует ГЦК у мышей с ТКИН. J Surg Res. 2012; 172(1):116–122. DOI: 10.1016/j.jss.2010.07.057. [PubMed] [Перекрестная ссылка] [Google Академия]
Ямамото Н., Суяма Х., Ямамото Н. Иммунотерапия рака предстательной железы с помощью фактора, активирующего макрофаги, полученные из Gcprotein. GcMAF TranslOncol. 2008; 1(2):65–72. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Канда С., Мотидзуки Ю., Мията Ю., Канетаке Х., Ямамото Н. Влияние фактора активации макрофагов на основе витамина D (3)-связывающего белка (GcMAF) на ангиогенез. J Natl Cancer Inst. 2002; 94(17):1311–1319. DOI: 10.1093/jnci/94.17.1311. [PubMed] [Перекрестная ссылка] [Google Академия]
Солинас М., Масси., Кантельмо А.Р., Каттанео М.Г., Каммарота Р., Бартолини Д., Чинквина В., Валенти М., Вичентини Л.М., Нунан Д.М., Альбини А., Пароларо Д. Каннабидиол ингибирует ангиогенез по нескольким механизмам. Бр Дж Фармакол. 2012; 167(6):1218–1231. DOI: 10.1111/j.1476-5381.2012.02050.x. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Сюй Дж., Ли В., Ма Дж., Лю Дж., Ша Х., Чжоу С., Ван Ф., Ма К. Витамин D — ключевой нутрицевтик в регуляции метастазирования рака и ангиогенеза. Curr Med Chem. 2013; 20(33):4109–4120. DOI: 10.2174/09298673113209990194. [PubMed] [Перекрестная ссылка] [Google Академия]
Пачини С., Моруччи Г., Пунци Т., Гулизано М., Руджеро М., Амато М., Атерини С. Влияние парикальцитола и GcMAF на ангиогенез и пролиферацию и передачу сигналов мононуклеарных клеток периферической крови человека. Дж.2012; 25(4):577–581. DOI: 10.5301/jn.5000035. [PubMed] [Перекрестная ссылка] [Google Академия]
Бакаре М.О., Мунир К.М., Кинни Д.К. Связь гипомеланотических кожных заболеваний с аутизмом: связь с возможной этиологической ролью уровня витамина D при аутизме? Гипотеза (Tor) 2011; 9(1):e2. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Мостафа Г.А., Аль-Айяди Л.Ю. Снижение сывороточных концентраций 25-гидроксивитамина D у детей с аутизмом: связь с аутоиммунными заболеваниями. J Нейровоспаление. 2012; 9:201. DOI: 10.1186/1742-2094-9-201. [Бесплатная статья о PMC] [PubMed] [CrossRef] [Google Scholar]
Ямамото Н., Нарапараджу В.Р., Асбелл С.О. Дегликозилирование сывороточного витамин-D3-связывающего белка приводит к иммуносупрессии у онкологических больных. Cancer Res. 1996; 56(12):2827–2831. [PubMed] [Google Академия]
Бёрнер С., Смида М., Хёлльт В., Шравен Б., Краус Й. Каннабиноидный рецептор типа 1- и 2-опосредованное увеличение циклического АМФ ингибирует передачу сигналов, запускаемых Т-клеточными рецепторами. J BiolChem. 2009; 284(51):35450–35460. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
Бёрнер С., Смида М., Хёлльт В., Шравен Б., Краус Дж. Опосредованное каннабиноидными рецепторами 1 и 2 типа увеличение циклического АМФ ингибирует передачу сигналов, запускаемую Т-клеточными рецепторами. J БиолХим. 2009 г.; 284 (51): 35450–35460. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
Чжэн С., Чен Л., Чен Икс, Хе Х, Ян Дж., Ши Ю, Чжоу Н. Вторая внутриклеточная петля человеческого каннабиноидного рецептора CB2 управляет связыванием G-белка в координации с карбоксильным концевым доменом. ПЛОС Один. 2013; 8 (5): e63262. doi: 10.1371/journal.pone.0063262. doi:10.1371/journal.pone.0063262. [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
Аль-Аяди Л.И. Провоспалительные цитокины у детей с аутизмом в центральной Саудовской Аравии. Нейронауки (Эр-Рияд), 2005 г.; 10 (2): 15515–15518. [ PubMed ] [ Академия Google ]
Синискалько Д., Антонуччи Н. Возможное использование яиц Trichurissuis в терапии расстройств аутистического спектра. Мед. гипотезы. 2013; 81 (1): 1–4. дои: 10.1016/j.mehy.2013.03.024. [ PubMed ] [ CrossRef ] [ Академия Google ]
Аль-Аядхи Л.Ю., Мостафа Г.А. Повышенные уровни в сыворотке хемокинов, происходящих из макрофагов и тимуса, а также хемокинов, регулируемых активацией, у детей с аутизмом. J Нейровоспаление. 2013; 10:72 . дои: 10.1186/1742-2094-10-72. [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
Моллой К.А., Морроу А.Л., Мейнцен-Дерр Дж., Шлейфер К., Дингер К., Мэннинг-Кортни П., Алтай М., Уиллс-Карп М. Повышенные уровни цитокинов у детей с расстройством аутистического спектра. Дж Нейроиммунол. 2006 г.; 172 (1–2): 198–205. [ PubMed ] [ Академия Google ]
Хьюм Д.А. Макрофаги как АПК и миф о дендритных клетках. Дж Иммунол. 2008 г.; 181 : 5829–5835. doi: 10.4049/jimmunol.181.9.5829. [ PubMed ] [ CrossRef ] [ Академия Google ]
Пирас И.С., Хаапанен Л., Наполиони В., Сакко Р., Ван де Уотер Дж., Персико А.М. Антимозговые антитела связаны с более тяжелыми когнитивными и поведенческими профилями у итальянских детей с расстройством аутистического спектра. Мозговой иммунитет. 2014 г.; 38 : 91–99. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
Хорниг М. Роль микробов и аутоиммунитета в патогенезе нервно-психических заболеваний. Курр Опин Ревматол. 2013; 25 (4): 488–795. doi: 10.1097/BOR.0b013e32836208de. [ PubMed ] [ CrossRef ] [ Академия Google ]
Де Тейе К.Г., Вопереис Х., Рамадан М., ван Эйндтовен Т., Ламберт Дж., Кнол Дж., Гарссен Дж., Краневельд А.Д., Оозир Р. Измененная микробиота кишечника и активность на мышиной модели расстройств аутистического спектра. Мозговой иммунитет. 2014 г.; 37 : 197–206. [ PubMed ] [ Академия Google ]
Вуд Дж.Т., Уильямс Дж.С., Пандаринатан Л., Джанеро Д.Р., Ламми-Киф С.Дж., Макрияннис А. Диетические добавки докозагексаеновой кислоты изменяют некоторые физиологические метаболиты эндоканнабиноидной системы в мозге и плазме. J Липид Рез. 2010 г.; 51 (6): 1416–1423. doi: 10.1194/jlr.M002436. [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
Артманн А, Петерсен Г, Хеллгрен Л.И., Боберг Дж, Сконберг С, Неллеманн С, Хансен Ш., Хансен Х.С. Влияние пищевых жирных кислот на уровни эндоканнабиноидов и N-ацилэтаноламина в мозге, печени и тонком кишечнике крыс. Биохим Биофиз Акта. 2008 г.; 1781 (4): 200–212. дои: 10.1016/j.bbalip.2008.01.006. [ PubMed ] [ CrossRef ] [ Академия Google ]
