Ikiru Immunotherapy Clinic 14-JUN-2012 Department of Biological Science and Technology, University of Tokushima
H Mukai, Y Uto.
Stability of GcMAF in serum
Стабильность GcMAF в сыворотке крови
Отчет об экспериментах
Этот эксперимент был проведен в Университете Токусимы в Японии с использованием нашего GcMAF второго поколения, демонстрирующего фагоцитарную активность макрофагов после краткосрочного и длительного хранения. Результаты показывают, что GcMAF второго поколения в сыворотке стабилен в течение 1 года при 4 °C, в течение 14 дней при комнатной температуре (около 20 °C) и в течение 7 дней при 40 °C.
Обратите внимание, что это исследование применимо только к GcMAF второго поколения, произведенному с использованием нашего производственного процесса, патент на который заявлен.
GcMAF, полученный традиционным методом с использованием аффинной хроматографии с витамином D, не обладает такой же стабильностью, как GcMAF второго поколения, поскольку он подвержен гораздо более быстрому окислению. Эта разница в стабильности связана с другим производственным процессом, а не с самим GcMAF.
Анализ фагоцитарной активности макрофагов Gcmaf второго поколения
GcMAF второго поколения тестировали на фагоцитарную активность макрофагов с использованием макрофагов мыши и эритроцитов овец в Университете Токусимы. Эритроциты были опсонизированы, что пометило их для проглатывания и разрушения активированными макрофагами, что выглядело как фиолетовые области в прозрачных клетках. На основании этого рассчитывали индекс фагоцитоза (PI).
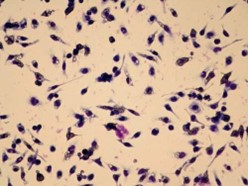
Срезы фиолетового цвета представляют собой макрофаги, активированные GcMAF, фагоцитирующим (поглощающим) опсонизированные эритроциты, которые имеют прозрачный цвет. Фото любезно предоставлено Университетом Токусимы.
Предварительные результаты экспериментов in vivo на мышах, несущих рак.
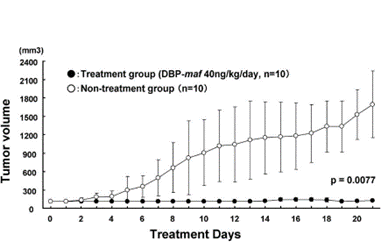
Эксперименты на мышах, несущих рак, in vivo были проведены с нашим GcMAF второго поколения. Мышей с раком лечили GcMAF второго поколения, очищенным GcMAF, полученным с использованием метода Ямамото, и контрольным физиологическим раствором. В этих экспериментах GcMAF второго поколения оказался гораздо более эффективным, чем очищенный GcMAF. (Неопубликованные результаты, Университет Токусимы. Ожидается, что исследовательская работа будет опубликована в 2013 году).
Опубликованные исследовательские работы по Gcmaf нашими сотрудниками
Мы сотрудничаем с исследователями GcMAF из Университета Токусимы, Япония, над разработкой GcMAF второго поколения. Ниже показаны опубликованные исследовательские статьи по GcMAF в рецензируемых научных журналах, написанные исследователями Университета Токусимы за последние 10 лет. Исследования GcMAF продолжаются, и новые статьи готовятся к публикации в будущем.
2010 Фактор активации белка-макрофага, связывающий витамин D, ингибирует ГЦК у мышей SCID
К. Нонака, С. Онидзука, Х. Исибаши, Ю. Уто, Х. Хори, Т. Накаяма, Н. Мацуура, Т. Канемацу, Х. Фудзиока.
Фон. Высокая частота рецидивов после лечения является наиболее серьезной проблемой гепатоцеллюлярной карциномы (ГЦК). Поэтому необходима новая стратегия лечения заболевания.
Целью настоящего исследования было выяснить, способен ли витамин D-связывающий белок-макрофагальный фактор активации (DBPmaf) ингибировать рост ГЦК.
Заключение.
DBP-maf обладает по меньшей мере двумя новыми функциями, а именно: антиангиогенной активностью и активностью по уничтожению опухолей за счет активации макрофагов.
Таким образом, DBP-maf может представлять собой новую стратегию лечения ГЦК.
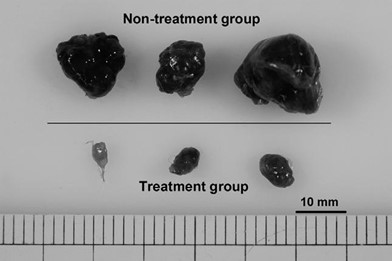
Репрезентативные опухоли удалялись через 21 день после введения DBP-maf (40 нг/кг/день).
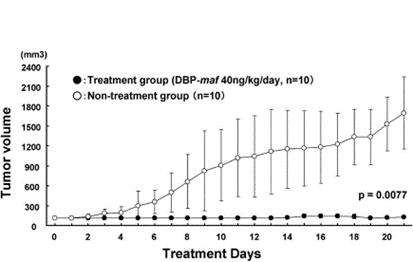
Репрезентативные опухоли удалялись через 21 день после введения DBP-maf (40 нг/кг/день).
Количество микрососудов в трансплантированных опухолях HepG2. Количество микрососудов в опухолях обработанных мышей было значительно меньше, чем в необработанных опухолях.
Комментарии автора
Гепатоцеллюлярная карцинома (ГЦК) – одно из наиболее распространенных злокачественных новообразований во всем мире. Терапевтические возможности ГЦК ограничены, и даже после радикального лечения развиваются частые рецидивы. Солидные опухоли, включая ГЦК, должны создать адекватную сосудистую сеть для получения питания. Опухолевой ангиогенез является одним из фундаментальных требований для роста и пролиферации опухоли.
Ранее мы сообщали, что фактор активации макрофагов, полученный из витамина D-связывающего белка (DBP), является новым ингибитором ангиогенеза, обнаруженным в среде линии клеток рака поджелудочной железы человека BxPC-3. Настоящее исследование in vivo продемонстрировало, что DBPmaf может замедлять прогрессирование опухоли ксенотрансплантированных клеток HCC у мышей SCID.
Исследование in vitro также показало, что DBP-maf выполняет как минимум две биологические функции; антиангиогенная активность и усиление активации макрофагов.
Антиангиогенез считается одним из наиболее эффективных методов индукции регрессии или покоя опухоли. Сообщения других подтверждают наши результаты, согласно которым DBP-maf действует как антиангиогенный агент и ингибирует рост ГЦК у мышей.
Сообщалось, что при гепатоцеллюлярной карциноме наблюдается увеличение MVD, а также повышение уровней VEGF в сыворотке или опухолевой ткани. Бевацизумаб (Авастин; гуманизированное мышиное моноклональное антитело против VEGF) клинически используется для лечения колоректального рака. В нескольких исследованиях изучалось применение бевацизумаба в качестве монотерапии или в комбинации с цитотоксическими или молекулярно-направленными препаратами у пациентов с распространенным ГЦК.
Было показано, что DBP-maf оказывает антиангиогенное действие посредством ингибирования сигнального каскада VEGF аналогично бевацизумабу. Все эти результаты указывают на то, что DBP-maf является многообещающим ингибитором ангиогенеза , хотя необходимы дальнейшие исследования механизма его действия.
Наши настоящие исследования показали, что DBP-maf индуцирует массивную инфильтрацию макрофагов в трансплантированные клетки HCC, а также активирует макрофаги как антигенпрезентирующие клетки против опухолевых антигенов. Таким образом, эти макрофаги не только действовали как врожденные иммунные клетки, но и играли ту же роль, что и дендритные клетки.
Мы не наблюдали антипролиферативного действия на клетки ГЦК со стороны самого DBP-maf, что позволяет предположить, что DBP-maf действует синергически, ингибируя ангиогенез и убивая опухолевые клетки в результате активированных макрофагов.
Мы впервые показали, что лечение мышей SCID с подкожным введением HepG2 DBP-maf приводило к подавлению роста опухоли.
2005 Белок Gc (белок, связывающий витамин D): генотипирование Gc и активность предшественника GcMAF
Х. Нагасава, Ю. Уто, Х. Сасаки, Н. Окамура, А. Мураками, С. Кубо, К. Л. Кирк, Х. Хори
Белок Gc (белок, связывающий витамин D): генотипирование Gc и активность предшественника GcMAF
Абстрактный. Белок Gc (специфичный для человеческой группы компонент (Gc), витамин D-связывающий белок или Gc-глобулин) выполняет важные физиологические функции, которые включают участие в транспорте и хранении витамина D, очистку внеклеточного G-актина, усиление хемотаксической активности.
C5a для нейтрофилов при воспалении и активации макрофагов (опосредовано GalNAc-модифицированным белком Gc (GcMAF)). В этом обзоре структуре и функции белка Gc уделяется особое внимание в отношении генотипирования Gc и активности предшественника GcMAF. Обсуждение исследовательской стратегии «GcMAF как цель для открытия лекарств» включено на основе наших собственных исследований.
2004 Ассоциация активности предшественника фактора активации макрофагов (MAF) с полиморфизмом витамина D-связывающего белка
Х. Нагасава, Х. Сасаки, Ю. Уто, С. Кубо, Х. Хори.
Ассоциация активности предшественника фактора активации макрофагов (MAF) с полиморфизмом витамина D-связывающего белка
Фон. Сывороточный витамин D-связывающий белок (белок Gc или DBP) представляет собой высокоэкспрессируемый полиморфный белок, который является предшественником фактора активации макрофагов, активирующего воспаление, GcMAF, в результате каскада реакций переработки углеводов.
Чтобы выяснить связь между полиморфизмом Gc и активностью предшественника GcMAF, мы оценили фагоцитарную способность трех гомотипов белка Gc: Gc1F-1F, Gc1S-1S и Gc2-2, путем процессинга их углеводной части.
Методы. Мы провели Gc-типирование образцов сыворотки человека методом изоэлектрофокусирования (ИЭФ). Белок Gc из сыворотки человека очищали аффинной хроматографией с 25-гидроксивитамин D3-сефарозой. Был проведен анализ фагоцитоза белков Gc, модифицированных бета-гликозидазой и сиалидазой.
Полученные результаты. Было обнаружено, что фенотип Gc1F-1F обладает связью Galbeta1-4GalNAc путем анализа активности предшественника GcMAF с использованием галактозидазы, специфичной для связи бета1-4, из фасоли. Активность предшественника GcMAF фенотипа Gc1F-1F была самой высокой среди трех гомотипов Gc.
Заключение. Полиморфизм Gc и разнообразие углеводов белка Gc имеют важное значение из-за их плейотропных эффектов.
2003 Характеристика фактора активации макрофагов, полученного из белка Gc человека (GcMAF), и его функциональная роль в противоопухолевой активности макрофагов
С. Мохамад, Х. Хори, Х. Нагасава, К. Усуи, Ю. Уто.
Характеристика фактора активации макрофагов, полученного из белка Gc человека (GcMAF), и его функциональная роль в противоопухолевой активности макрофагов
Введение
Макрофаги необходимы для защиты хозяина и играют важную роль в организации иммунного ответа хозяина на сигналы угрозы.
Также известно, что макрофаги играют решающую роль в противоопухолевом иммунитете, могут проникать в опухоли и обнаруживаются в большинстве участков опухоли.
Между тем, белок Gc (также известный как белок, связывающий витамин D3) представляет собой сывороточный белок с многофункциональными свойствами и, как сообщается, является предшественником фактора активации макрофагов.
Белок Gc может быть преобразован индуцибельной B-галактозидазой B-клеток и нейраминидазой T-клеток в мощный фактор активации макрофагов (GcMAF), белок с N-ацетилгалактозамином (GalNAc) в качестве оставшегося сахарного фрагмента.
Активированные макрофаги проявляют туморицидную активность за счет поглощения опухолевых клеток и высвобождения активных форм кислорода (АФК) и активных форм азота (РНС) или того и другого.
Мы сообщили, что модификация белка Gc in situ с помощью B-галактозидазы и нейраминидазы увеличивала высвобождение супероксида в перитонеальных макрофагах мышей, выявленных тиогликолатом.
Ямамото и др. сообщили о возможности использования GcMAF в качестве иммуномодулятора для лечения рака, поэтому важно обеспечить анализ GcMAF.
Кэнан и др. сообщили о количественном анализе GcMAF из сыворотки человека. Однако сахарная часть GcMAF никогда качественно не изучалась. Здесь мы представляем исследование качественного анализа GcMAF из очищенной сыворотки человека, а также его влияния на активность макрофагов.
2003 Фактор активации макрофагов, происходящий из белка Gc (GcMAF): характер изоэлектрической фокусировки и опухолевая активность
С. Мохамад, Х. Нагасава, Х. Сасаки, Ю. Уто, Ю. Накагава, К. Кавасима, Х. Хори
Фактор активации макрофагов, происходящий из белка Gc (GcMAF): характер изоэлектрической фокусировки и опухолевая активность
Фон. Белок Gc является предшественником фактора активации макрофагов, происходящего из белка Gc (GcMAF), с тремя фенотипами: Gc1f, Gc1s и Gc2, в зависимости от его электрофоретической подвижности.
Разница в электрофоретической подвижности обусловлена разницей в составе посттрансляционных сахарных группировок. Материалы и методы. Мы сравнили разницу между белком Gc и электрофоретической подвижностью GcMAF, используя метод изоэлектрофокусирования (ИЭФ). Туморицидную активность макрофагов, обработанных GcMAF, оценивали после совместного культивирования с клетками L-929. Механизм туморицида был исследован с использованием биоанализа TNF и высвобождения оксида азота (NO).
Полученные результаты. Обнаружена разница в электрофоретической подвижности белка Gc и GcMAF. Была обнаружена опухолевая активность макрофагов, обработанных GcMAF, но не наблюдалось высвобождения TNF и NO.
Заключение. Разница в изоэлектрофокусирующей подвижности белка Gc и GcMAF сделала бы полезной разработку метода обнаружения GcMAF. GcMAF-увеличивал туморицидную активность макрофагов, однако в этот механизм были вовлечены высвобождение TNF и NO.
2002 Активность альфа-N-ацетилгалактозаминидазы опухолевых клеток и ее участие в Gcmaf-связанной активации макрофагов
С. Мохамад, Х. Нагасава, Ю. Уто, Х. Хори
Активность альфа-N-ацетилгалактозаминидазы опухолевых клеток и ее участие в Gcmaf-связанной активации макрофагов
Сообщалось,
что альфа-N-ацетилгалактозаминидаза (альфа-NaGalase) накапливается в сыворотке больных раком и отвечает за дегликозилирование белка Gc, который является предшественником GcMAF-опосредованного каскада активации макрофагов, что в конечном итоге приводит к иммуносупрессии у больных раком на поздних стадиях.
Мы изучили биохимические характеристики альфа-NaGalase из нескольких линий опухолевых клеток человека. Мы также исследовали его влияние на способность GcMAF активировать перитонеальные макрофаги мыши с целью производства супероксида в каскаде активации макрофагов, опосредованном GcMAF.
Специфическую активность альфа-NaGalase из линии клеток опухоли толстой кишки человека HCT116, линии клеток гепатомы человека HepG2 и нормальных клеток печени человека (линия клеток печени Chang) оценивали с использованием двух типов субстратов; GalNAc-альфа-PNP (субстрат экзо-типа) и Gal-бета-GalNAc-альфа-PNP (субстрат эндо-типа).
Альфа-NaGalase опухолевого происхождения, имеющая более высокую активность, чем нормальная альфа-NaGalase, имела более высокую субстратную специфичность к субстрату экзо-типа, чем к субстрату эндо-типа, сохраняя при этом свою активность при pH 7. GcMAF усиливает выработку супероксида в макрофагах мыши во время предварительной терапии. -обработка GcMAF лизатом опухолевых клеток снижает эту активность.
Мы пришли к выводу, что по своим биохимическим характеристикам альфа-НаГалаза, полученная из опухоли, отличается от нормальной альфа-НаГалазы из нормальных клеток печени Чанга. Кроме того, альфа-NaGalase, полученная из опухолевых клеток, снижает эффективность GcMAF при активации макрофагов.
2002 Получение фактора активации макрофагов, полученного из белка Gc (GcMAF), его структурной характеристики и биологической активности,
С. Мохамад, Х. Нагасава, Ю. Уто, Х. Хори.
2002 Получение фактора активации макрофагов, полученного из белка Gc (GcMAF), его структурная характеристика и биологическая активность.
Фон. Сообщается, что белок Gc является предшественником фактора активации макрофагов, происходящего из белка Gc (GcMAF), в каскаде активации макрофагов, вызванном воспалением. Индуцибельная бета-галактозидаза В-клеток и нейраминидаза Т-клеток превращают белок Gc в GcMAF.
Полученные результаты. Мы успешно очистили белок Gc из сыворотки человека. GcMAF был обнаружен методом лектин-блоттинга и показал высокую биологическую активность.
Заключение. Наши результаты подтверждают важность терминального фрагмента N-ацетилгалактозамина в GcMAF-опосредованном каскаде активации макрофагов и существование конститутивного GcMAF в сыворотке человека. Эти предварительные данные важны для создания низкомолекулярных имитаторов GcMAF.
Другие опубликованные исследовательские работы по Gc-MAF
2011 Полиморфизм витамина D-связывающего белка как генетический фактор риска в патогенезе эндометриоза,
К. Фазерл, Г. Голдерер, Л. Кремсер, Х. Линднер, Б. Сарг, Л. Вильдт, Б. Сибер.
2011 Полиморфизм витамина D-связывающего белка как генетический фактор риска в патогенезе эндометриоза.
Предыдущие исследования выявили дефицит воспалительной реакции у женщин, у которых развивается эндометриоз. Специфические иммунологические дефициты до конца не выяснены.
Цель.
Нашей целью было выявить различия в экспрессии белков в сыворотке, которые могли бы пролить свет на патофизиологию эндометриоза. Метод. Это поперечное исследование женщин, перенесших лапароскопию в период с 2003 по 2005 год, проводилось в университетском медицинском центре. Среди пациентов были женщины в возрасте 18–49 лет, согласившиеся пройти операцию по поводу боли и/или бесплодия или плановую перевязку маточных труб. Кровь собирали перед операцией. Основной показатель результата. Протеомный анализ сыворотки проводили с использованием двумерного разностного гель-электрофореза.
Полученные результаты. Мы обнаружили 25 белковых пятен со значительной разницей в количестве между женщинами с эндометриозом и контрольной группой, включая белки острой фазы и компоненты комплемента. Содержание витамина D-связывающего белка было выше во всех пулах эндометриоза примерно в 3 раза по сравнению с контрольным пулом.
Анализ продуктов конкретных аллелей с использованием наномасштабной жидкостной хроматографии-ионизации-масс-спектрометрии электрораспылением показал, что именно продукт аллеля GC*2 находился в большей концентрации в пулах сыворотки, а также в отдельных проверочных образцах у женщин с эндометриозом. В отличие от продукта аллели GC*1, который легко превращается в мощный макрофагальный фактор (фактор активации макрофагов, полученный из белка Gc), продукт аллели GC*2 практически не подвергается такому преобразованию.
Заключение.
Мы предполагаем, что неспособность достаточно активировать фагоцитарную функцию макрофагов у лиц, несущих полиморфизм GC*2 (более распространенный при эндометриозе), может позволить эндометриоидным тканям имплантироваться в брюшную полость. Необходимы будущие исследования, оценивающие специфические полиморфизмы белка, связывающего витамин D, как фактор риска эндометриоза в больших популяциях женщин.
Комментарии автора
Эндометриоз – распространенное заболевание женщин репродуктивного возраста. Им страдают около 10% всех женщин и более 40% женщин с бесплодием. У женщин с эндометриозом могут наблюдаться нарушения иммунной системы и воспалительные реакции, способствующие развитию эндометриоидных поражений.
Нашим самым впечатляющим открытием является дифференциальная распространенность продукта специфической аллели DBP, GC*2. Экспрессия продукта аллеля GC*2 была в 3 раза выше во всех пулах эндометриоза по сравнению с контрольным пулом.
Помимо действия в качестве переносчика метаболитов витамина D, DBP является наиболее мощным активатором макрофагов в форме фактора активации макрофагов, полученного из белка Gc (GcMAF).
Продукты аллели GC*1 гликозилируются с общей скоростью 10–30%, тогда как продукт аллели GC*2 гликозилируются с общей скоростью 1–5%. Таким образом, форма DBP, кодируемая аллелем GC*1, гораздо легче конвертируется в GcMAF, тогда как форма, кодируемая GC*2, практически не конвертируется.
Те, у кого есть только продукты аллеля GC*2, непропорционально представленные в группе эндометриоза, имеют значительно сниженную способность конвертировать DBP в GcMAF, критический активатор макрофагов.
Основываясь на результатах нашего исследования, мы предполагаем, что иммунный дефект может заключаться, по крайней мере частично, в неспособности достаточно активировать фагоцитарную функцию макрофагов у тех, кто несет аллель GC*2 ДАД.
Активация макрофагов посредством таргетной иммунотерапии у больных женщин может лечь в основу новой стратегии лечения эндометриоза.
