Neuropsychiatry Journal (London) Review Article — Neuropsychiatry (2017) Volume 7, Issue 3
Haruka Amitani, Robert A Sloan, Nanami Sameshima, Koichi Yoneda, Marie Amitani, Akinori Morinaga, Yoshihiro Uto, Toshio Inui, Akio Inui, Akihiro Asakawa
Development of colostrum MAF and its clinical application
Разработка МАФ из молозива и его клиническое применение
Содержание
В последнее время иммунотерапия стала новой и привлекательной стратегией лечения рака и других острых и хронических заболеваний.
Основные компоненты естественной иммунной системы — фагоцитарные клетки, называемые макрофагами, — размножаются в ответ на инфекцию в организме. Использование терапии, активирующей макрофаги, такой как фактор активации макрофагов (MAF), имеет широкое применение для лечения многочисленных заболеваний путем активации естественных макрофагов организма для стимуляции иммунной системы.
Цель этого обзора — дать представление об особенностях и клинической эффективности нового типа фактора активации макрофагов, полученного из молозива, называемого молозивом MAF.
Ключевые слова
Иммунотерапия, фактор активации макрофагов (MAF), молозиво MAF
Введение
Многие заболевания, включая рак и СПИД, развиваются из-за нарушения или отказа естественной иммунной системы. В настоящее время исследователи узнали, что стимуляция естественной иммунной системы может остановить или даже обратить вспять такие заболевания, как рак и СПИД. В последнее время новая стратегия иммунотерапии стала привлекательной стратегией лечения рака, а также лечения различных других острых и хронических заболеваний [ 1 ].
Основной самозащитой организма от болезней является иммунная система [ 2 ]. Иммунная система может воспринимать многочисленные патогены из окружающей среды, включая опухолевые клетки в организме. Способ защиты иммунной системы состоит из двух категорий иммунитета: врожденного иммунитета и адаптивного иммунитета. Во врожденной иммунной системе существует несколько типов клеток, включая фагоцитирующие нейтрофилы, макрофаги, дендритные клетки, тучные клетки и естественные клетки-киллеры. Адаптивная иммунная система состоит из лимфоцитов, включая Т-клетки и В-клетки, которые могут различать и запоминать конкретные патогены и их продукты, включая антитела.
Макрофаги, важный компонент врожденной иммунной системы, представляют собой фагоцитирующие клетки, которые размножаются в ответ на инфекцию внутри организма. Макрофаги различают, подавляют и уничтожают патогены, раковые клетки и чужеродные вещества. Эти макрофаги также циркулируют цитокины и удаляют клеточный мусор и клетки, подвергшиеся апоптозу [ 3 ]. В общих чертах макрофаги делятся на два класса: тканерезидентные макрофаги и инфильтрирующие макрофаги. Большинство тканей организма имеют популяции резидентных макрофагов [ 4 ].
Примерами тканерезидентных макрофагов являются кишечные макрофаги желудочно-кишечного тракта, клетки Лангерганса, дермальные макрофаги, клетки Купфера, подвижные макрофаги печени, микроглия головного мозга, альвеолярные и интерстициальные макрофаги легких, макрофаги красной пульпы селезенки и макрофаги костного мозга.
По определению, все эти макрофаги существуют в тканях соответствующих органов и выполняют гомеостатические тканеспецифические функции [ 4-6 ] .
Источник инфильтрации макрофагов – воспалительные моноциты – избирательно перемещаются в области воспаления, производят воспалительные цитокины и способствуют как местному, так и системному воспалению [ 7 ].
Инфильтрирующие макрофаги встречаются в патологических средах, в том числе: раке, атеросклерозе и метаболических заболеваниях [ 6 ].
Макрофаги играют важную роль в заживлении ран и восстановлении кожи. Они способствуют стимуляции эпителиальных стволовых клеток и циклической стимуляции стволовых клеток волосяных фолликулов. Результаты могут иметь адаптивное значение для восстановления кожи, возобновления роста волос и воспалительных заболеваний кожи [ 8 ].
Известный как фактор активации макрофагов, связывающий витамин D (DBP-MAF), фактор активации макрофагов, полученный из белка Gc (GcMAF), является мощным эндогенным активатором макрофагов, который естественным образом существует в крови.
Недавно было обнаружено, что MAF полезен для здоровья. Целью этого обзора является повышение осведомленности о концепциях и клинической эффективности нового типа фактора активации макрофагов, который в настоящее время разрабатывается из молозива (колострум MAF).
Предыстория MAF
▪ GcMAF первого поколения (очищенный GcMAF)
Доктор Нобуто Ямамото открыл GcMAF в 1991 году. GcMAF является производным белка группоспецифического компонента (Gc) (белок, связывающий витамин D), который является компонентом суперсемейства альбуминов [ 9 ].
Очищенный GcMAF, GcMAF первого поколения, был получен с использованием искусственной ферментативной обработки неспецифического человеческого белка Gc, который был очищен с помощью аффинной хроматографии с витамином D.
GcMAF представляет собой замечательный сывороточный гликопротеин с многочисленными биологическими активностями. Во время воспалительной реакции в организме GcMAF вырабатывается, когда сиалидаза Т-клетки и цегалактозидаза активированной В-клетки гидролизуют концевые сахариды галактозы и сиаловой кислоты белка Gc [ 10 ].
GcMAF проявляет замечательную биологическую активность; GcMAF активирует макрофаги, используя генерацию супероксидных радикалов и фагоцитарную активацию [ 10 , 11 ], а in vivo проявляет антиангиогенные [ 12 , 13 ] и противоопухолевые свойства [ 14-16 ] .
Кроме того, GcMAF напрямую ингибирует размножение и миграцию клеток рака простаты человека или клеток рака молочной железы человека, независимо от его способности активации макрофагов [ 17 ].
У пациентов с метастатическим раком молочной железы [ 18 ], раком простаты [ 19 ] и метастатическим колоректальным раком [ 20 ] были проведены клинические испытания с использованием GcMAF.
Примечательно, что среди всех пациентов, которым еженедельно вводили дозы 100 нг GcMAF в течение периода от 7 до 19 недель, рак не появлялся повторно в течение периода от четырех до семи лет.
Однако с клиническими испытаниями существовали некоторые проблемы, поскольку не было сделано очевидной классификации гистопатологических типов, степеней и стадий пациентов. Кроме того, выводы о лечении были основаны исключительно на активности N-ацетилгалактозаминидазы (нагалазы) пациента. В клинических испытаниях не проводилось никаких измерений опухолевых маркеров или уровней цитокинов, а также не существовало контрольной группы.
Кроме того, был сделан примечательный клинический отчет о лечении ВИЧ с использованием GcMAF [ 21 ].
Результаты, основанные на еженедельном введении 100 нг GcMAF 15 ВИЧ-инфицированным пациентам без анемии, показали, что количество клеток CD4+ увеличилось до нормального уровня, количество клеток CD8+ снизилось до нормального уровня, и часто в течение 6 недель количество РНК ВИЧ-1 и антигена p24 были незаметны в анализах крови пациента.
В этом отчете считалось, что положительный эффект уничтожения ВИЧ потенциально был вызван GcMAF-активированными макрофагами, фагоцитирующими и разрушающими вирус. GcMAF был активен в моноцитах и макрофагах, выделенных от этих пациентов со СПИДом [ 22 ].
▪ GcMAF второго поколения (Serum GcMAF)
Серьезная проблема связана с очисткой GcMAF первого поколения для клинического использования. В предыдущих исследованиях для получения очищенного GcMAF использовалась аффинная колонка, модифицированная 25-гидроксивитамином D3 [ 23 ].
Однако загрязнения трудно избежать при многократном использовании колонки.
При комнатной температуре — в среде с кислородом и в отсутствие антиоксидантов, таких как альбумин и мочевая кислота, которых много в очищенной крови, GcMAF нестабилен [ 24 ]. Чтобы преодолеть проблему стабильности GcMAF первого поколения, GcMAF второго поколения производят с использованием искусственной ферментативной обработки человеческой сыворотки без очистки с использованием аффинной хроматографии с витамином D.
У мышей искусственное ферментативное лечение усиливало фагоцитарную активность перитонеальных макрофагов и продлевало период выживания мышей с асцитными опухолями Эрлиха [ 25 ]. Согласно сообщениям, иммунотерапия на основе GcMAF второго поколения сочеталась с многочисленными другими методами лечения, которые были полезны при лечении онкологических больных [ 26 , 27 ].
Расстройства аутистического спектра (РАС) — это заболевания нервной системы, характеризующиеся симптомами ограничения интересов, повторяющегося поведения и отсутствия языковых и социальных навыков [ 28 ].
Хотя специфических биологических маркеров аутизма и РАС не существует, люди с РАС и члены их семей часто описывают аномалии иммунной системы [ 29 ].
Текущая гипотеза заключается в том, что некоторая комбинация иммунных факторов, включая вырабатываемые у матери антитела к ткани мозга плода, имеет тенденцию создавать микроглию, чтобы предотвратить нормальные функции управления миграцией и обрезкой нейронов [ 30 , 31 ].
В клиническом исследовании аутистов GcMAF второго поколения смог нормализовать экспериментальные различия в нарушенной экспрессии генов эндоканнабиноидной системы в культивированных макрофагах, полученных из моноцитов крови пациентов (BMDM) [ 32 ].
На основании оценок интеллекта, когнитивных способностей и поведения пациентов с аутизмом, участвовавших в исследовании, необходимы дальнейшие исследования, включающие эти оценки.
Молозиво МАФ
▪ Коровье молозиво
В течение первых нескольких дней после отела коровы давали своим новорожденным телятам молоко, называемое бычьим молозивом.
Молозиво крупного рогатого скота представляет собой густую липкую жидкость желтого цвета и содержит сывороточные белки и антитела, в том числе альбумин, инсулиноподобный фактор роста, эпидермальный фактор роста, фактор роста нервов, лактоферрин, иммуноглобулин G, иммуноглобулин А и иммуноглобулин М, которые все служат для защиты новорожденных телят от различных инфекционных заболеваний; однако, в отличие от зрелого молока, бычье молозиво содержит меньшее количество углеводов и липидов [ 33 ].
Ученым были известны полезные свойства молозива на протяжении веков, но только недавно исследователи проанализировали биологические компоненты, которые отвечают за уникальное действие молозива [ 34 , 35 ].
Примечательно, что у всех новорожденных есть тонкая и незрелая желудочно-кишечная система, а молозиво используется для обеспечения естественным образом созданных питательных веществ в мощном, но малообъемном процессе. Кроме того, свойства молозива также защищают и способствуют созреванию желудочно-кишечного тракта [ 36 ].
Молозиво также используется для передачи материнского иммунитета новорожденному, основанного на иммуноглобулине [ 37 ], а также на факторах его врожденных систем [ 38 ].
▪ Приготовление молозива MAF
Известно, что иммуноглобулин А (IgA) обеспечивает защиту от различных инфекций и взаимодействует с рецептором Fc (функция от различных воспалительных эффектов [ 39 ]. Кроме того, IgA имеет O-связанную сахарную цепь и свойство связывания Рецептор Fc снижается, если существует много остатков сиаловой кислоты [ 40 ].Сообщается, что количество N-ацетилгалактозаминовых фрагментов, прикрепленных к IgA O-связанным гликанам, было значительно уменьшено у пациентов с болезнью Крона и сильно коррелировало с клинической активностью [ 41 ].
Кроме того, белок Gc имеет О-связанную сахарную цепь. Гидролиз галактозы и сиаловой кислоты белка Gc вызывает воспаление и опосредуется мембраносвязанной d-галактозидазой, которая существует на активированных B-клетках, и сиалидазой на T-клетках с образованием GcMAF с фрагментом GalNAc [ 10 ].
Используя гипотезу о том, что бычье молозиво можно использовать в качестве активатора макрофагов, если ферментативно модифицированные белки IgA и Gc проявляют активность, подобную активности GcMAF, одно исследование подготовило галактозилированное и десиалилированное бычье молозиво и показало, что оно обладает способностью активировать фагоцитоз макрофагов [43 ] .
Таким образом, было разработано молозиво MAF, новая форма фактора активации макрофагов.
▪ Особенности молозива MAF
Предыдущие исследования показали, что MAF молозива значительно усиливает фагоцитарную активность перитонеальных и кишечных макрофагов мышей in vitro и in vivo соответственно [ 42 ].
Общее мнение заключалось в том, что материалы с молекулярной массой более 500 Да не подвергаются кишечной абсорбции. Напротив, сообщалось, что в кишечном тракте мышей могут абсорбироваться пептиды с существенно высокой молекулярной массой (~ 15 000 Да) [ 43 ].
Таким образом, эти данные позволяют предположить, что гликопротеин бычьего молозива с высокой молекулярной массой может всасываться из кишечного тракта.
Для активации макрофагов в лимфоидной ткани, связанной с кишечником (GALT), в рот вводят молозиво MAF вместе с тонзиллярным кольцом Вальдейера ( рис. 1 ).
Кроме того, молозиво MAF можно вводить в другие участки тела, где присутствуют макрофаги. В частности, GALT считается крупнейшим пулом макрофагов в организме, играющим важную роль в поддержании и регуляции иммунитета слизистой оболочки [ 44 , 45 ].
Таким образом, было показано, что пероральное молозиво MAF в кислотоустойчивой капсуле с энтеросолюбильным покрытием имеет потенциальный эффект для прямой активации большого количества макрофагов в GALT для стимуляции иммунной системы.
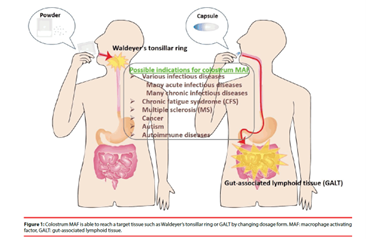
Рисунок 1: Молозиво MAF способно достигать целевой ткани, такой как кольцо миндалин Вальдейера или GALT, путем изменения лекарственной формы. MAF: фактор активации макрофагов, GALT: лимфоидная ткань, связанная с кишечником.
MAF из молозива имеет особые преимущества перед MAF, который производится из сыворотки, с точки зрения практического клинического использования, поскольку MAF из молозива получают из бычьего молозива, источника пищи, а не из источника человеческой сыворотки, и его вводят перорально и сублингвально, а не инвазивным путем. инъекция.
Кроме того, MAF молозива не опосредовал выработку воспалительных цитокинов, в том числе: фактора некроза опухоли, цитокина интерлейкина-1s (фактоβ) [ 42 ].
Если молозиво MAF можно использовать для подавления выработки воспалительных цитокинов, оно может стать эффективным средством лечения аутоиммунных заболеваний.
Эффекты молозива MAF
Влияние молозива MAF на синдром хронической усталости
Синдром хронической усталости (СХУ) — это сложное заболевание, характеризующееся необъяснимой усталостью, продолжающейся не менее шести месяцев, с такими симптомами, как головные боли, плохой сон, мышечные боли, а также когнитивные трудности с памятью и проблемы с концентрацией [ 46 ].
Кроме того, существует множество других симптомов, которые могут испытывать пациенты с СХУ. Они могут влиять на чувства, вызывать синдром раздраженного кишечника и вызывать психологические расстройства [ 47 ].
Точный патогенез СХУ неизвестен. Было представлено несколько этиологических моделей, включая роль инфекции, окислительных и нитрозативных (IO&NS) путей [ 48 ], эндокринной дисфункции, дисбаланса вегетативной нервной системы, депрессивного настроения и снижения иммунитета [ 49 ].
Низкое производство АТФ и митохондриальная дисфункция играют важную роль в аутоиммунитете, ингибируя апоптоз и стимулируя некротическую гибель клеток [ 50 ].
Они могут вызывать неврологические отклонения, включая поведенческие реакции, а также нейроэндокринные, вегетативные и мозговые дисфункции. У многих пациентов с СХУ могут наблюдаться аутоиммунные реакции, потеря функций естественных клеток-киллеров и повышенный уровень противовоспалительных цитокинов [ 51 ].
У пациентов с СХУ сообщалось о множественных цитокиновых аномалиях, включая: IL-1, TNFα и IL-6 [ 52 ], INFγ 54[ 53 ], ядерный фактор κB (NF-κB) [ 54 ] и протеинкиназу R (PKR). пути [ 55 ].
Никаких рецептурных лекарств специально для СХУ не разработано; поэтому это считается неизлечимой болезнью. В наших предыдущих отчетах о клинических случаях мы показали двух пациентов с СХУ, у которых были отличные результаты при использовании перорального молозива MAF [ 56 ].
В частности, ежедневное пероральное введение порошка молозива MAF и выдача одной кислотоустойчивой капсулы с энтеросолюбильным покрытием двум пациентам с СХУ показали различные симптомы, включая усталость, мышечную боль и боль в животе, которые улучшились в течение нескольких дней. Кроме того, у пациентов с СХУ в течение 4-месячного периода наблюдалось возобновление роста волос на голове.
Хотя причина СХУ еще не установлена, предыдущие исследования показали, что инфекции и иммунная дисфункция могут играть решающую роль в развитии СХУ.
Недавно мы сообщили, что активация макрофагов с помощью иммунотерапии на основе GcMAF, в отличие от липополисахарида (ЛПС), не вызывает оксида азота (NO) и фактора некроза опухоли (TNF)-α, а также продукцию цитокинов IL-1β [ 15 , 42 ]. По мнению Уто и др . Дозы молозива MAF в 10 нг приводили к значительно более высокой фагоцитарной активности макрофагов, чем обычное лечение LPS в дозе 1 мкг. Таким образом, микрофаги, по-видимому, проявляют большее сродство к активации с MAF молозива, чем с LPS.
Введение молозива MAF приведет к подавлению активации макрофагов, связанной с ЛПС. Следовательно, он будет вызывать хороший фагоцитоз без дисфункции IL-1β или TNF-α. Результаты этих первоначальных экспериментов с терапией MAF с молозивом, по-видимому, связаны со снижением утомляемости у двух пациентов с СХУ.
В некоторых случаях молозиво MAF вводилось с использованием двух методик: порошка, принимаемого перорально, и одной кислотоустойчивой капсулы с кишечнорастворимым покрытием, содержащей молозиво MAF. Капсульный метод облегчает попадание MAF молозива в кишечник, где оно может активировать макрофаги в пластырях Пайера, а затем попасть в кровь. Существует вероятность того, что молозиво MAF можно вводить путем сублингвальной абсорбции для введения в кровоток. В отчетах о случаях заболевания указано, что молекула MAF из молозива может всасываться любым путем, обеспечивая эффекты, аналогичные эффекту инъекционного GcMAF, и позволяет разработать новый протокол лечения СХУ, в котором используется MAF из пищевого молозива.
▪ Влияние молозива MAF на другие заболевания
Рассеянный склероз (РС) — идиопатическое воспалительное заболевание, характеризующееся демиелинизацией и дегенерацией центральной нервной системы (ЦНС) [ 57 ].
Первичная роль Т-клеток в патогенезе рассеянного склероза известна давно [ 58 ].
Кроме того, В-клетки играют важную роль в патогенезе рассеянного склероза [ 59 ].
Результаты показали, что аномальные взаимодействия между Т-клетками и В-клетками участвуют в иммунопатогенезе рассеянного склероза [ 60 ].
Учитывая ограниченность эффективных вариантов лечения рассеянного склероза, в одном исследовании 45-летнему пациенту с рассеянным склерозом применяли сывороточный GcMAF и молозивный MAF [ 61 ].
После лечения у пациента появилась прибавка энергии, и после четырех лет прикования к инвалидной коляске он смог ходить. Важно отметить, что все лекарства для обезболивания, контроля мочевого пузыря и антибиотики были прекращены, и пациентка могла ходить по лестнице [ 61 ].
Исследование случая рассеянного склероза показало, что лечение GcMAF второго поколения и MAF из молозива заметно улучшило двигательные способности. Исследование предполагает, что использование иммуномодуляции с помощью MAF может быть полезным при лечении рассеянного склероза. В другом случае иммунотерапия MAF пероральным молозивом и сывороточным GcMAF сочеталась с динамической терапией сына (SDT), полями лечения опухолей (TTF) и озонотерапией, и они оказались эффективными при лечении пациента с немелкоклеточной болезнью. рак легких (стадия 3В) [ 62 ].
Заключение
Несколько исследователей объяснили влияние MAF на множество заболеваний (таблица 1).
Молозиво MAF имеет множество положительных качеств, в том числе является безопасным продуктом питания, легкодоступным и не индуцирует воспалительные цитокины, а также было показано, что оно достигает тканей-мишеней, таких как кольцо миндалин Вальдейера или GALT, путем изменения форм введения.
Таким образом, молозиво MAF перспективно в качестве эффективного активатора макрофагов для различных иммунотерапий. Таким образом, необходим дополнительный сбор биологических и психологических данных в результате клинического применения для подтверждения влияния молозива MAF на патологию различных заболеваний.
| Формула | Модель | Сообщенный результат | Изучать | Рекомендации |
| Очищенный GcMAF | Gc-белок из сыворотки человека | Повышение активности макрофагов | В пробирке | Мохамад и др. 2002 [ 63 ] |
| Очищенный GcMAF | Gc-белок из сыворотки человека | Повышение фагоцитарной активности макрофагов | В пробирке | Нагасава и др. 2004 [ 64 ] |
| Очищенный GcMAF | Несколько эндотелиальных клеток | Антиангиогенные эффекты посредством рецептора CD36. | В пробирке | Канда и др. 2002 [ 12 ] |
| Очищенный GcMAF | Рак поджелудочной железы | Антиангиогенные эффекты и регрессия опухоли | In vitro и vivo | Кискер и др. 2003 [ 13 ] |
| Очищенный GcMAF | Карцинома опухоли Эрлиха | Эрадикация асцитной опухоли | В естественных условиях | Кога и др. 1999 [ 14 ] |
| Очищенный GcMAF | Ячейка L-929 | Противоопухолевое действие | В пробирке | Мохамад и др. 2003 [ 15 ] |
| Очищенный GcMAF | Гепатоцеллюлярная карцинома | Антиангиогенная активность и активность, убивающая опухоли. | В естественных условиях | Нонака и др. 2012 [ 16 ] |
| Очищенный GcMAF | Рак молочной железы | Ингибирование опухолевого ангиогенеза и ингибирование пролиферации, миграции и метастатического потенциала раковых клеток. | В пробирке | Пачини и др. 2012 [ 17 ] |
| Очищенный GcMAF | Метастатический рак молочной железы | Отсутствие рецидивов более 4 лет. | Клинический | Ямамото и др. 2008 [ 18 ] |
| Очищенный GcMAF | Рак простаты | Рецидивов не было в течение 7 лет. | Клинический | Ямамото и др. 2008 [ 19 ] |
| Очищенный GcMAF | Метастатический колоректальный рак | Рецидивов не было в течение 7 лет. | Клинический | Ямамото и др. 2008 [ 20 ] |
| Очищенный GcMAF | ВИЧ-инфекция | Увеличение количества CD4+ клеток и уменьшение количества антигена p24 и РНК ВИЧ-1. | Клинический | Ямамото и др. 2009 [ 21 ] |
| Сыворотка GcMAF | Карцинома опухоли Эрлиха | Повышение фагоцитарной активности макрофагов и увеличение времени выживания мышей с асцитными опухолями Эрлиха | In vitro и vivo | Кучиике и др. 2013 [ 25 ] |
| Сыворотка GcMAF | Метастатический рак | Отсутствие прогрессирования рака | Клинический | Инуи и др. 2013 [ 26 ] |
| Сыворотка GcMAF | Метастатический рак молочной железы | Полное исчезновение плеврального выпота и внутриплевральной узловой опухоли. | Клинический | Инуи и др. 2014 [ 27 ] |
| Сыворотка GcMAF | Аутизм | Нормализация нарушенной экспрессии генов эндоканнабиноидной системы в культивируемых макрофагах, полученных из моноцитов крови (BMDM) | Клинический | Синискалько и др. 2014 [ 32 ] |
| Молозиво МАФ | Мышиные макрофаги | Повышение фагоцитарной активности перитонеальных макрофагов мыши in vitro и кишечных макрофагов + in vivo. |
In vitro и vivo | Уто и др. 2015 [ 42 ] |
| Молозиво МАФ | Синдром хоронной усталости | Улучшение различных симптомов | Клинический | Инуи и др. 2015 [ 56 ] |
| Молозиво МАФ | Рассеянный склероз | Улучшение двигательной инвалидности и отказ от всех лекарств | Клинический | Инуи и др. 2016 [ 61 ] |
| Молозиво МАФ | Немелкоклеточный рак легкого (стадия 3В) |
Улучшение различных симптомов и торможение увеличения размера опухоли. | Клинический | Инуи и др. 2016 [ 62 ] |
Таблица 1: Эффективность фактора активации макрофагов (MAF).
Благодарности
Мы благодарим Сэмюэля С. Слоана, доктора философии (с), за его поддержку при редактировании.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов относительно публикации данной статьи.
Рекомендации
Меллман И., Кукос Г., Дранофф Г. Иммунотерапия рака достигает совершеннолетия. Природа 480(7378), 480-489 (2011).
Гривенников С.И., Гретен Ф.Р., Карин М. Иммунитет, воспаление и рак. Ячейка 140(6), 883-899 (2010).
Моссер Д.М., Эдвардс Дж.П. Изучение полного спектра активации макрофагов. Нат. Преподобный Иммунол 8(12), 958-969 (2008).
Дэвис Л.С., Дженкинс С.Дж., Аллен Дж.Э. и др. Тканевые резидентные макрофаги. Нат. Иммунол 14(10), 986-995 (2013).
Мюррей П.Дж., Винн Т.А. Защитные и патогенные функции субпопуляций макрофагов. Нат. Преподобный Иммунол 11(11), 723-737 (2011).
Хасимото Д., Чоу А., Ноизат С. и др. Тканевые макрофаги самоподдерживаются локально на протяжении всей взрослой жизни с минимальным вкладом циркулирующих моноцитов. Иммунитет 38(4), 792-804 (2013).
Ян Дж., Чжан Л., Юй С. и др. Дифференциация моноцитов и макрофагов: кровообращение воспалительных моноцитов как биомаркера воспалительных заболеваний. Биомарк. Рез. 2(1), 1 (2014 г.).
Кастеллана Д., Паус Р., Перес-Морено М. Макрофаги способствуют циклической активации стволовых клеток взрослых волосяных фолликулов. ПЛОС. Биол 12(12), e1002002 (2014).
Ямамото Н., Хомма С. Белок, связывающий витамин D3 (группоспецифический компонент), является предшественником сигнального фактора, активирующего макрофаги, из лимфоцитов, обработанных лизофосфатидилхолином. Учеб. Натл. акад. наук. США 88(19), 8539-8543 (1991).
Ямамото Н., Кумасиро Р. Преобразование белка, связывающего витамин D3 (группоспецифический компонент), в фактор активации макрофагов путем поэтапного действия бета-галактозидазы В-клеток и сиалидазы Т-клеток. J. Immunol 151(5), 2794-2802 (1993).
Нарапараджу В.Р., Ямамото Н. Роль бета-галактозидазы В-лимфоцитов и сиалидазы Т-лимфоцитов в активации макрофагов, вызванной воспалением. Иммунол. Письмо 43(3), 143–148 (1994).
Канда С., Мочизуки Ю., Мията Ю. и др. Влияние фактора активации макрофагов, связывающего витамин D (3), на ангиогенез. Дж. Натл. Рак. Инст 94(17), 1311-1319 (2002).
Кискер О., Онидзука С., Беккер С.М. и др. Витамин D-связывающий белок-фактор активации макрофагов (DBP-maf) ингибирует ангиогенез и рост опухолей у мышей. Неоплазия 5(1), 32-40 (2003).
Кога Ю., Нарапараджу В.Р., Ямамото Н. Противоопухолевый эффект фактора активации макрофагов, полученного из витамина D-связывающего белка, на мышей с асцитной опухолью Эрлиха. Учеб. Соц. Эксп. Биол. Мед 220(1), 20-26 (1999).
Мохамад С.Б., Нагасава Х., Сасаки Х. и др. Фактор активации макрофагов, полученный из белка Gc (GcMAF): характер изоэлектрической фокусировки и противоопухолевая активность. Противорак. Res 23(6a), 4451-4457 (2003).
Нонака К., Онидзука С., Исибаши Х. и др. Фактор активации макрофагов, связывающий витамин D, ингибирует ГЦК у мышей SCID. Дж. Сург. Рез. 172(1), 116–122 (2012).
Пачини С., Пунци Т., Моруччи Г. и др. Влияние фактора активации макрофагов, связывающего витамин D, на клетки рака молочной железы человека. Противорак. Рез. 32(1), 45–52 (2012 г.).
Ямамото Н., Суяма Х., Ямамото Н. и др. Иммунотерапия больных метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF). Межд. Дж. Рак 122(2), 461-467 (2008).
Ямамото Н., Суяма Х., Ямамото Н. Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc, GcMAF. Перевод Онкол 1(2), 65-72 (2008).
Ямамото Н., Суяма Х., Накадзато Х. и др. Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF. Рак. Иммунол. Иммунотер 57(7), 1007-1016 (2008).
Ямамото Н., Ушиджима Н., Кога Ю. Иммунотерапия ВИЧ-инфицированных пациентов с помощью фактора активации макрофагов, полученного из белка Gc (GcMAF). Дж. Мед. Вирол 81(1), 16-26 (2009).
Ямамото Н., Нарапараджу В.Р., Сринивасула С.М. Структурная модификация сывороточного витамина D3-связывающего белка и иммуносупрессия у больных СПИДом. СПИД. Рез. Хм. Retroviruses 11(11), 1373-1378 (1995).
Свами Н., Рой А., Чанг Р. и др. Аффинная очистка витамина D-связывающего белка плазмы человека. Белок. Экспр. Пуриф 6(2), 185-188 (1995).
Эймс Б.Н., Кэткарт Р., Швирс Э. и др. Мочевая кислота обеспечивает антиоксидантную защиту человека от старения и рака, вызванного оксидантами и радикалами: гипотеза. Учеб. Натл. акад. наук. США 78(11), 6858-6862 (1981).
Кучиике Д., Уто Ю., Мукаи Х. и др. Дегалактозилированная/десиалилированная человеческая сыворотка, содержащая GcMAF, индуцирует фагоцитарную активность макрофагов и противоопухолевую активность in vivo. Противорак. Рез. 33(7), 2881-2885 (2013).
Инуи Т., Кучиике Д., Кубо К. и др. Клинический опыт интегративной иммунотерапии рака с использованием GcMAF. Противорак. Рез. 33(7), 2917–2919 (2013).
Инуи Т., Макита К., Миура Х. и др. Отчет о случае: Пациентка с раком молочной железы, получавшая лечение GcMAF, сонодинамической терапией и гормональной терапией. Противорак. Рез. 34(8), 4589-4593 (2014).
Ассоциация AP, Диагностическое и статистическое руководство по психическим расстройствам. 4-е издание (1994 г.).
Энстром А.М., Ван де Уотер Дж.А., Эшвуд П. Аутоиммунитет при аутизме. Курс. Мнение. Расследование. Лекарства 10(5), 463-473 (2009).
Gesundheit B, Rosenzweig JP, Naor D и др. Иммунологические и аутоиммунные аспекты расстройств аутистического спектра. Дж. Аутоиммун 44(), 1-7 (2013).
Бауман, М.Д., Иосиф А.М., Эшвуд П. и др. Материнские антитела от матерей детей с аутизмом изменяют рост мозга и развитие социального поведения у макак-резус. Перевод Психиатрия 3(), e278 (2013).
Синискалько Д., Брэдстрит Дж.Дж., Чирилло А. и др. Влияние GcMAF in vitro на транскрипцию эндоканнабиноидной системы, образование рецепторов и клеточную активность макрофагов, происходящих от аутизма. Ж. Нейровоспаление 11(), 78 (2014).
Корхонен Х., Марнила П., Гилл Х.С. Молочные иммуноглобулины и факторы комплемента. Бр. Дж. Нутр 84 (Приложение 1), S75-80 (2000).
Буррин Д.Г., Дэвис Т.А., Эбнер С. и др. Молозиво усиливает пищевую стимуляцию синтеза белка жизненно важных органов у новорожденных поросят. Дж. Нутр 127(7), 1284-1289 (1997).
Колецко Б., Аггетт П.Дж., Биндельс Дж.Г. и др. Рост, развитие и дифференциация: функциональный подход к науке о пищевых продуктах. Бр. Дж. Нутр 80 (Приложение 1), С5-45 (1998).
Уокер А. Грудное молоко как золотой стандарт защитных питательных веществ. Ж. Педиатр 156(2 Приложения), С3-7 (2010).
Тайлер Дж.В., Стивенс Б.Дж., Хостетлер Д.Э. и др. Концентрация колострального иммуноглобулина у коров голштинской и гернсийской породы. Являюсь. Дж. Вет. Рез. 60(9), 1136-1139 (1999).
Соломоновы острова, северо-запад. Модуляция иммунной системы и реакция против патогенов с помощью концентратов бычьего молозива. Евро. Дж. Клин. Нутр 56(Приложение 3), С24-28 (2002).
Сноек В., Питерс И.Р., Кокс Э. Система IgA: сравнение структуры и функции у разных видов. Ветеринар. Рез. 37(3), 455-467 (2006).
Бассет С., Девошель В., Дюран В. и др. Гликозилирование иммуноглобулина А влияет на его связывание с рецепторами. Скан. J. Immunol 50(6), 572-579 (1999).
Иноуэ Т., Иидзима Х., Тадзири М. и др. Дефицит N-ацетилгалактозамина в О-связанных олигосахаридах IgA является новым биологическим маркером болезни Крона. Воспаление. Кишечник. Дис 18(9), 1723-1734 (2012).
Уто Ю., Каваи Т., Сасаки Т. и др. Дегалактозилированное/десиалилированное бычье молозиво индуцирует фагоцитарную активность макрофагов независимо от продукции воспалительных цитокинов. Противорак. Рез. 35(8), 4487-4492 (2015).
Оссер С., Адам М., Бабель В. и др. Пероральное введение гидролизата желатина, меченного (14)C, приводит к накоплению радиоактивности в хряще мышей (C57/BL). Дж. Нутр 129(10), 1891-1895 (1999).
Цеста МФ. Нормальная структура, функция и гистология лимфоидной ткани, связанной со слизистой оболочкой. Токсикол. Патол 34(5), 599-608 (2006).
Брандцаег П., Кийоно Х., Пабст Р. и др. Терминология: номенклатура лимфоидной ткани, ассоциированной со слизистой оболочкой. Слизистая. Иммунол 1(1), 31-37 (2008).
Фукуда Ф., Штраус С.Е., Хики И. и др. Синдром хронической усталости: комплексный подход к его определению и изучению. Международная группа по изучению синдрома хронической усталости. Анна. Стажер. Med 121(12), 953-959 (1994).
Климас Н.Г., Конеру А.О. Синдром хронической усталости: воспаление, иммунная функция и нейроэндокринные взаимодействия. Курс. Ревматол. Отчет 9(6), 482-487 (2007).
Маес М., Михайлова И., Кубера М. и др. Увеличение уровня 8-гидроксидезоксигуанозина, маркера окислительного повреждения ДНК, при большой депрессии и миалгическом энцефаломиелите/синдроме хронической усталости. Нейро. Эндокринол. Письмо 30(6), 715–722 (2009).
Мэйс М., Твиск Ф.Н. Почему миалгический энцефаломиелит/синдром хронической усталости (МЭ/СХУ) может вас убить: нарушения в путях воспалительного, окислительного и нитрозативного стресса (IO&NS) могут объяснить сердечно-сосудистые нарушения при МЭ/СХУ. Нейро. Эндокринол. Письмо 30 (6), 677–693 (2009).
Смитс Б., ван ден Хеувел Л., Кнооп Х. и др. Митохондриальные ферменты различают митохондриальные нарушения и синдром хронической усталости. Митохондрия 11(5), 735-738 (2011).
Моррис Г., Берк М., Галецки П. и др. Растущая роль аутоиммунитета при миалгическом энцефаломиелите/синдроме хронической усталости (ME/cfs). Мол. Нейробиол 49(2), 741-756 (2014).
Маес М., Твиск Ф.Н., Кубера М. и др. Доказательства воспаления и активации клеточного иммунитета при миалгическом энцефаломиелите/синдроме хронической усталости (ME/CFS): повышение уровня интерлейкина-1, фактора некроза опухоли-альфа, PMN-эластазы, лизоцима и неоптерина. Дж. Аффект. Раздор 136(3), 933–939 (2012).
Карло-Стелла Н., Бадулли С., Де Сильвестри А. и др. Первое исследование геномного полиморфизма цитокинов при СХУ: положительная ассоциация редких аллелей TNF-857 и IFNgamma 874. Клин. Эксп. Ревматол 24(2), 179-182 (2006).
Моррис Г., Мэйс М. Повышение ядерного фактора каппаВ и потеря р53 являются ключевыми механизмами миалгического энцефаломиелита/синдрома хронической усталости (МЭ/СХУ). Мед. Гипотезы 79(5), 607–613 (2012).
Миус М., Нейс Дж., МакГрегор Н. и др. Раскрытие внутриклеточных иммунных дисфункций при синдроме хронической усталости: взаимодействие между активностью протеинкиназы R, расщеплением РНКазы L и активностью эластазы, а также их клиническая значимость. В. Vivo 22(1), 115-121 (2008).
Инуи Т., Кубо К., Кучиике Д. и др. Фактор активации макрофагов молозива для перорального применения при серьезных инфекциях и синдроме хронической усталости: три сообщения о случаях заболевания. Противорак. Рез. 35(8), 4545-4549 (2015).
Фризе М.А., Шаттлинг Б., Фуггер Л. Механизмы нейродегенерации и аксональной дисфункции при рассеянном склерозе. Нат. Преподобный Нейрол 10(4), 225–238 (2014).
Фризе М.А., Фуггер Л. Т-клетки и микроглия как движущие силы патологии рассеянного склероза. Мозг 130(11), 2755-2757 (2007).
Майло Р. Терапевтические стратегии, нацеленные на В-клетки при рассеянном склерозе. Аутоиммун. Ред. 15(7), 714–718 (2016).
Ромме Кристенсен Дж., Борнсен Л., Ратцер Р. и др. Системное воспаление при прогрессирующем рассеянном склерозе затрагивает фолликулярные Т-хелперы, Th17- и активированные В-клетки и коррелирует с прогрессированием. ПЛОС. Один 8(3), e57820 (2013).
Инуи Т., Кацуура Г., Кубо К. и др. Отчет о клиническом случае: Лечение GcMAF у пациента с рассеянным склерозом. Противорак. Рез. 36(7), 3771-3774 (2016).
Инуи Т., Амитани Х., Кубо К. и др. Отчет о случае: пациент с немелкоклеточным раком легких, получавший лечение с помощью GcMAF, сонодинамической терапии и полей для лечения опухолей. Противорак. Рез. 36(7), 3767-3770 (2016)
