Scientific Reports volume 10, Article number: 19122 (2020) Cite this article
Yoko Nabeshima, Chiaki Abe, Takeshi Kawauchi, Tomoko Hiroi, Yoshihiro Uto & Yo-ichi Nabeshima
Simple method for large-scale production of macrophage activating factor GcMAF
Простой метод крупномасштабного производства фактора активации макрофагов GcMAF
Содержание
Белок, специфичный для группы человека (белок Gc), представляет собой многофункциональный сывороточный белок, который у людей имеет три общих аллельных варианта: Gc1F, Gc1S и Gc2. Gc1 содержит O-связанный трисахарид [сиаловая кислота-галактоза- N -ацетилгалактозамин (GalNAc)] на остатке треонина 420 (Thr 420 ) и может быть преобразован в мощный фактор активации макрофагов (GcMAF) путем селективного удаления сиаловой кислоты и галактозы. , оставляя GalNAc в Thr 420 .
Напротив, Gc2 не гликозилирован. GcMAF считается многообещающим кандидатом для иммунотерапии и антиангиогенной терапии рака и вызывает большой интерес, но сравнивать результаты исследовательских групп по-прежнему сложно, поскольку для получения GcMAF использовались разные процедуры.
Здесь мы представляем простой и практичный метод получения высококачественного GcMAF путем сверхэкспрессии белка Gc в бессывороточной суспензионной культуре клеток ExpiCHO-S без необходимости проведения стадии дегликозилирования. Мы считаем, что этот протокол подходит для крупномасштабного производства GcMAF для функционального анализа и клинических испытаний.
Введение
Специфический для группы человека белок-компонент (Gc), также известный как Gc-глобулин (GcG) или белок, связывающий витамин D (DBP), представляет собой белок из 458 аминокислот с неизмененной массой 51,2 кДа. Белок Gc в основном синтезируется в печени и присутствует на высоком уровне в крови/плазме (300–600 мг/л), а также в более низких концентрациях в молозиве и молоке 1 , 2 .
Впервые он был описан в 1959 году 3 , и впоследствии в человеческой популяции были идентифицированы три общих аллельных варианта: Gc1F, Gc1S и Gc2. По сравнению с белком Gc1F, Gc1S содержит остаток глутамата вместо аспартата в положении 416 (мутация D416E), тогда как Gc2 содержит остаток лизина вместо треонина в положении 420 (мутация T420K) 4 , 5 , 6 .
Белок Gc выполняет как минимум четыре различные молекулярные функции. А именно, (1) белок Gc содержит единственный сайт связывания витамина D в N-концевом домене 1, что позволяет ему работать в качестве белка-переносчика метаболитов витамина D в крови 2 , 7 , 8 , 9 , (2) он имеет роль в циркулирующей системе поглотителя актина, предотвращая сужение мелких кровеносных сосудов путем связывания с мономерным актином (G-актином), высвобождаемым из поврежденных клеток в случаях повреждения клеток и лизиса 10 , 11 , (3) он является предшественником мощного активатор макрофагов (GcMAF, Gc-производный фактор активации макрофагов) и остеокластов 12 , 13 , 14 , 15 и (4) он служит хемотаксическим кофактором для C5a путем взаимодействия с белками клеточной поверхности нейтрофилов 16 , 17 .
С-концевой конец Gc1 (домен III) содержит единственный сайт гликозилирования. Углеводная структура была впервые выяснена путем анализа продуктов, образующихся при обработке несколькими гликолитическими ферментами 12 , 18 , 19 , и сообщалось, что Gc1 содержит O-связанный трисахарид с GalNAc, присоединенным к Thr 420 , за которым следует галактозный фрагмент, и сиаловая кислота (в Gc1F) или маннозный фрагмент (в Gc1S).
Считалось, что Gc2, в котором отсутствует этот остаток треонина, имеет только дисахаридный фрагмент, состоящий из GalNAc и галактозы, хотя более 90% Gc2 присутствует в виде негликозилированной формы у людей 12 , 18 , 19 .
Однако текущие детальные структурные анализы гликанов с использованием обработки гликозидазой и масс-спектрометрии 6 , 20 , 21 , 22 показали, что (1) белки Gc1F и Gc1S имеют один и тот же линейный трисахарид, сиаловую кислоту-галактозу-GalNAc, на остатке Thr 420 (рис. 1 Модель B) 23 и (2) замена остатка лизина в положении, соответствующем Thr 420 , в Gc2 предотвращает гликозилирование этой изоформы в этом положении, и, таким образом, Gc2 не гликозилируется (фиг. 1 ).
Эти выводы подтверждаются данными о том, что Gc1 больных раком содержит тот же трисахарид, что и Gc1 здоровых добровольцев, а именно, сиаловая кислота-галактоза-GalNAc-Thr 420 24 .
Рисунок 1
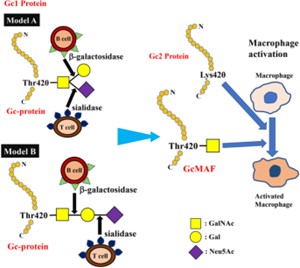
Структура белка Gc и его превращение в GcMAF. Ямамото и др. предложил ( Модель А ) структуру белка DBP/Gc1F и его превращение в GcMAF 25 . В этой модели GalNAc ковалентно связан с Thr 420 белка Gc1F, а галактоза и сиаловая кислота связаны с GalNAc в Y-разветвленной структуре. Следовательно, удаление галактозы и сиаловой кислоты обнажает фрагмент GalNAc и приводит к образованию активированного GcMAF.
Однако Равнсборг и др. недавно предложил линейную модель ( Модель B ) , основанную на результатах масс — спектрометрии 23 . В этой модели три сахарных фрагмента, присоединенные к треонину 420, расположены линейно, причем GalNAc ковалентно связан с треонином, а галактоза и сиаловая кислота присоединены к GalNAc в этом порядке. Негликозилированный Gc2 также проиллюстрирован на основе текущих результатов масс-спектрометрии.
Белки Gc превращаются в GcMAF посредством дегликозилирования; в частности, было высказано предположение, что воспаление приводит к селективному гидролизу галактозы и сиаловой кислоты белков Gc1 β-галактозидазой стимулированных В-лимфоцитов и сиалидазой Т-лимфоцитов 13 , 25 , 26 , в результате чего GalNAc ковалентно присоединяется к остатку треонина (рис. 1 ).
Сообщаемая активность GcMAF включает активацию макрофагов 27 , антиангиогенезную активность 28 , 29 , 30 и противоопухолевую активность 31 , 32 , 33 . Действительно, полученный из крови человека GcMAF, как сообщается, эффективен против метастатического колоректального рака, метастатического рака молочной железы и простаты 34 , 35 , 36 .
Таким образом, лечение GcMAF является потенциальным вариантом иммунотерапии и антиангиогенной терапии рака. Однако биологические исследования и клинические испытания GcMAF дали противоречивые результаты, вероятно, потому, что большинство лабораторий и онкологических клиник производят свои собственные GcMAF, используя разные процедуры, хотя все они основаны на последовательном дегликозилировании белков Gc, полученных из крови человека. Таким образом, существует потребность в методологии, позволяющей получить последовательный продукт в больших масштабах для дальнейших исследований.
Здесь мы представляем практический метод получения высококачественного GcMAF путем сверхэкспрессии белка Gc в бессывороточной суспензионной культуре клеток ExpiCHO-S без необходимости проведения стадии дегликозилирования. Синтезированный GcMAF можно очистить с помощью одностадийной колоночной аффинной хроматографии с витамином D. Эта простая методология позволяет производить большие количества высококачественного GcMAF и должна значительно улучшить функциональный анализ и дальнейшую клиническую оценку GcMAF.
Полученные результаты
Экспрессия Gc1F в клетках CHO
Вектор экспрессии Gc1F-His (pcDNA3.4-TOPO Gc1F-His ) (дополнительные рисунки 1 и 2 ) трансфицировали в клетки CHO с использованием липофектамина 2000, и клетки культивировали в течение 3–4 дней.
Супернатант наносили на колонку His Trap HP, которую промывали связывающим буфером и элюировали буферным раствором для элюирования. Элюат обессоливали путем диализа против 50 мМ забуференного фосфатом натрия физиологического раствора, pH 7,4, и аликвоту обессоленной фракции дегликозилировали с помощью β- D -галактозидазы и сиалидазы. Эти препараты подвергали электрофорезу в геле SDS, переносили на мембрану и окрашивали антителом против Gc человека, антителом против His и конъюгированным с биотином лектином Helix promatia (HPA), который грубо реагирует с GalNAc.
Как и ожидалось, экспрессированный белок в обессоленной фракции был обнаружен с помощью антител против Gc и His (рис. 2 А), но не с помощью конъюгированного с биотином лектина HPA (рис. 2 Б (-)). Однако белок в дегликозилированной фракции (рис. 2 B (+)) был обнаружен с лектином HPA, что указывает на то, что белок Gc1F-His несет O-связанный трисахарид (т.е. сиаловая кислота-галактоза-GalNAc-Thr 420 ) 20 , 21 , 22 , 23 был синтезирован в клетках CHO, и эта сиаловая кислота и галактоза были удалены обработкой дегликозилированием (Фиг. 2 B (+)). Этот результат согласуется с сообщениями о том, что белок Gc, полученный из крови человека, может быть преобразован в HPA-лектин-реактивный GcMAF путем обработки β- D -галактозидазой и сиалидазой 34 , 35 , 36 .
Чтобы проверить, является ли белок, синтезированный в клетках CHO, N -гликозилированным, обессоленный His-меченный Gc1F обрабатывали PNGазой и подвергали гель-электрофореза с SDS (рис. 2 C). Полосы, отмеченные стрелками, демонстрируют сходную подвижность, что указывает на то, что белок Gc, синтезируемый в клетках CHO, не является N -гликозилированным.
фигура 2
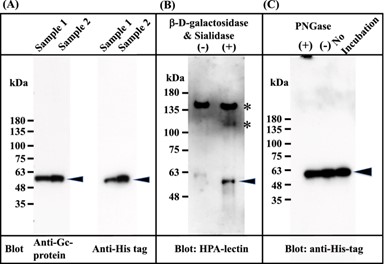
Характеристика Gc1F, синтезируемого в клетках CHO. Культуральные супернатанты доводили до состава и pH связывающего буфера колоночной хроматографии His Trap HP (предварительно заряженный Ni 2+ ). Образцы наносили на колонку, которую промывали, а затем элюировали элюирующим буфером. Элюат обессоливали диализом против 50 мМ фосфата натрия, pH 7,0 (обессоленная фракция). Обессоленную фракцию помещали в полиакриламидный гель с 5–20% ДСН и полосы наносили на мембрану из ПВДФ. Антитело против Gc ( А , левая панель) и антитело против His ( А ; правая панель) использовались для обнаружения меченого His Gc1F и визуализировались с помощью усовершенствованной системы хемилюминесцентного обнаружения. Аликвоты обессоленного His-меченного Gc1F ( B (-)) и образца, обработанного β- D -галактозидазой и сиалидазой ( B (+)) были охарактеризованы с помощью HPA-лектин-блоттинга. HPA-лектин-реактивный Gc1F обозначен стрелкой ( B (+)). Дополнительные полосы, обозначенные знаком *, представляют собой неизвестные HPA-лектин-реактивные белки, которые были удалены во время аффинной колоночной хроматографии с витамином D (см. фиг. 4А ). Анализировали N- гликозилирование Gc-1F, синтезированного в клетках CHO ( С ). Обессоленный His-меченный Gc1F (( C ) без инкубации) обрабатывали PNGазой ( C (+)) или инкубировали без PNGазы ( C (-)) и подвергали гель-электрофорезу в ДСН. Полноразмерные блоты включены в дополнительную фигуру 4 .
Производство лектин-реактивных белков Gc HPA без стадии дегликозилирования
Основываясь на приведенном выше наблюдении, мы попытались установить стандартную процедуру для крупномасштабного получения Gc-белка с использованием клеток ExpiCHO-S, культивированных в бессывороточной суспензии, поскольку этот подход широко использовался для крупномасштабного получения белков. Вкратце, клетки ExpiCHO-S предварительно культивировали в бессывороточной суспензионной культуральной среде в течение 2 дней.
ДНК вектора экспрессии (pcDNA3.4-TOPO Gc1F-His ) (дополнительные рисунки 1 и 2 ) трансфицировали в предварительно культивированные клетки с использованием Lipofectamine 2000 и культивирование продолжали в течение 7–8 дней; выживаемость клеток постепенно снижалась и опускалась ниже 90% (рекомендуемый критерий прекращения культивирования) на 7 или 8 день культивирования. Супернатант культуры собирали центрифугированием при 10 000 × g в течение 15 минут и наносили на Ni-NTA-агарозу. столбец. Элюат обессоливали диализом против фосфатного буфера, а затем дегликозилировали β- D -галактозидазой и сиалидазой. Обе обессоленную и дегликозилированную фракции охарактеризовали с помощью вестерн-блот-анализа (фиг. 3 ).
Рисунок 3
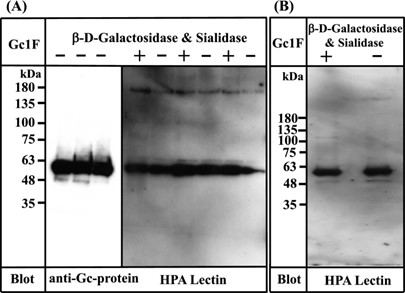
Характеристика Gc1F, синтезируемого в клетках ExpiCHO-S и клетках Expi293-F. ( А ) Три образца Gc1F-His, независимо синтезированные в клетках ExpiCHO-S, были охарактеризованы с использованием антитела против Gc (левая панель). Сахарные модификации Gc1F, меченного His, отдельно (-) и после обработки β- D -галактозидазой и сиалидазой (+) анализировали с помощью блоттинга HPA-лектина, конъюгированного с биотином (правая панель). ( B ) Gc1F-His синтезировали в клетках Expi293-F в условиях бессывороточной суспензионной культуры. Модификации сахара Gc1F-His отдельно (-) и после обработки β- D -галактозидазой и сиалидазой (+) были охарактеризованы с помощью блоттинга конъюгированного с биотином HPA-лектина. Полноразмерные блоты включены в дополнительную фигуру 4 .
К нашему удивлению, Gc1F-His, экспрессируемый в клетках ExpiCHO-S, был обнаружен не только с помощью антитела против Gc (рис. 3А , левая панель), но также и с лектином HPA, независимо от обработки ферментами дегликозилирования или без нее (рис. 3 А, правая панель) . Кроме того, реактивность по отношению к лектину HPA не увеличивалась в дальнейшем при обработке дегликозилированием (рис. 3A , правая панель), что позволяет предположить, что сахарид, реагирующий с лектином HPA (GalNAc-Thr 420 ), был присоединен почти ко всем синтезированным Gc1F-His. в клетках ExpiCHO-S в условиях бессывороточной суспензионной культуры.
Затем мы проверили, специфичны ли приведенные выше данные для клеток ExpiCHO-S. Чтобы проверить это, мы синтезировали GcIF-His в клетках Expi293-F, другом типе клеток, доступных для бессывороточной суспензионной культуры. Как показано на фиг. 3B , Gc1F-His, экспрессируемый в клетках Expi293-F, был обнаружен как с антителом против Gc (данные не показаны), так и с конъюгированным с биотином лектином HPA, независимо от обработки ферментами дегликозилирования или без нее, что позволяет предположить, что HPA лектин-реактивный сахарид (GalNAc-Thr 420 ) присутствовал в экспрессируемом белке.
Поскольку три аллельных варианта, Gc1F, Gc1S и Gc2, обнаружены у людей 4 , 5 , 6 , мы затем исследовали, синтезируются ли HPA-лектин-реактивные формы Gc1S и Gc2 также в условиях бессывороточной суспензионной культуры путем трансфекции pcDNA3.4. -TOPO Gc1S-His и pcDNA3.4-TOPO Gc2-His (дополнительный рисунок 1 ) в клетки ExpiCHO-S. Как показано на фиг. 4А , Gc1S-His был обнаружен с помощью конъюгированного с биотином лектина HPA, независимо от обработки ферментами дегликозилирования или без нее. Однако Gc2-His не обнаруживался лектином HPA даже после обработки ферментами дегликозилирования.
Рисунок 4
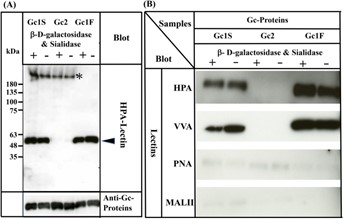
Характеристика Gc1S, Gc2 и Gc1F, синтезированных клетками ExpiCHO-S в бессывороточной суспензионной культуре.
Gc1S и Gc2 были синтезированы клетками ExpiCHO-S, трансфицированными pcDNA3.4-TOPO Gc1S-His или pcDNA3.4-TOPO Gc2-His (дополнительная фигура 1 ) в бессывороточной суспензионной культуре. Gc1S и Gc2 очищали с помощью колоночной хроматографии с His Trap HP (предварительно заряженный Ni 2+ ) и обессоливали путем диализа против 50 мМ фосфата натрия, pH 7,0 (обессоленная фракция). Сахарные фрагменты обессоленной фракции отдельно (-) и после обработки β- D -галактозидазой и сиалидазой (+) анализировали путем блоттинга с биотин-конъюгированным HPA-лектином (стрелка).
Очищенный Gc1F анализировали в качестве контроля. Gc1S, Gc2 и Gc1F прореагировали с антителом против Gc (нижний столбец). Дополнительные полосы, отмеченные *, представляли собой неизвестные белки, реагирующие на HPA-лектин, которые стали необнаруживаемыми после аффинной колоночной хроматографии с витамином D (см. дорожки 1F+, 1F-). ( B ) Gc1F, Gc1S и Gc2, синтезированные клетками ExpiCHO-S в бессывороточной суспензионной культуре, очищали с помощью колоночной хроматографии His Trap HP (предварительно заряженный Ni 2+ ) и аффинной колоночной хроматографии с витамином D, а затем обессоливали путем диализа против 50 мМ фосфат натрия, pH 7,0 (обессоленная фракция).
Фрагменты сахара обессоленной фракции без обработки (-) и после обработки β- D -галактозидазой и сиалидазой (+) анализировали путем блоттинга с лектинами HPA, VVA, PNA или MALII, как указано. Полноразмерные блоты включены в дополнительную фигуру 4 .
Поскольку многие лектины обладают лишь умеренной специфичностью, мы подтвердили вышеуказанные результаты, используя другие лектины: биотинилированный лектин Vicia villosa (VVA), биотинилированный лектин Maackia amurensis (MAL-II) II и биотинилированный лектин арахиса (PNA).
Как и ожидалось, Gc1F и Gc1S сильно реагировали с лектинами HPA и VVA, которые реагируют на GalNAc/Tn, но почти не реагировали с лектинами PNA и MALII, которые отдают предпочтение дисахариду Gal-GalNAc/T и сиаловой кислоте/STn/ST соответственно. (рис. 4 Б). Реакции Gc2 с лектинами HPA, VVA, PNA и MALII были незначительными (рис. 4 Б). В совокупности эти результаты могут указывать на то, что Gc1F и Gc1S, продуцируемые в клетках ExpiCHO-S, гликозилированы GalNAc по Thr 420 , тогда как Gc2 не гликозилирован.
Очистка белков Gc методом аффинной колоночной хроматографии с витамином D
Белки Gc1 и Gc2, синтезированные в клетках ExpiCHO-S, очищали с помощью колоночной хроматографии с His-tag и аффинной колоночной хроматографии с витамином D (рис. 5 A–D).
Белки Gc1 и Gc2 каждый очищали как одну полосу массой 53 000 Да. Затем мы проверили, можно ли пропустить этап колоночной хроматографии с His-меткой; если да, то должно быть возможным получить нативный белок Gc без дополнительной последовательности метки.
Чтобы проверить это, мы синтезировали мышиный белок Gc без метки (дополнительный рисунок 1 C, pcDNA3.4-TOPO mouse-Gc ) в клетках ExpiCHO-S и очистили продукт с помощью одностадийной аффинной колоночной хроматографии с витамином D. Продукт был обнаружен как одна полоса 52 000 Да (рис. 5E ) и подтверждено, что он реагирует с лектином HPA.
Рисунок 5
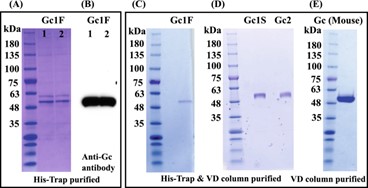
Очистка белков Gc методом аффинной колоночной хроматографии с витамином D. Схемы окрашивания CBB двух независимо приготовленных образцов Gc1F, очищенных с помощью колоночной хроматографии с His-Trap ( A , Gc1F 1 и 2), и схемы блоттинга с антителом против Gc ( B , Gc1F 1 и 2). Элюат из колонки His-Trap ( A , Gc1F 1) подвергали аффинной колоночной хроматографии с витамином D. Аффинно-очищенный Gc1F обнаруживали с помощью окрашивания CBB ( С ). Gc1S и Gc2 очищали аналогичным образом и окрашивали CBB ( D ). Картина окрашивания CBB мышиного GcMAF, очищенного с помощью одностадийной колоночной аффинной хроматографии с витамином D ( E ). Полноразмерные гели и блоты включены в дополнительную рис. 4 .
Анализ фагоцитоза белков Gc, синтезируемых в клетках ExpiCHO-S
Затем мы проанализировали активность активации фагоцитоза белков Gc, синтезируемых в клетках ExpiCHO-S. Клетки U937 выращивали в среде RPMI-1640 и дифференцировали в макрофагоподобные клетки посредством обработки ТРА.
Затем макрофаги, полученные из клеток U937, активировали воздействием очищенных белков Gc и ЛПС (типичного химического вещества, активирующего макрофаги).
Поскольку фагоцитарная активность макрофагов, индуцированная производным Gc1F GcMAF, значительно увеличивается при концентрации 10 нг/мл 37 , мы оценили средний индекс фагоцитоза (API) белков Gc при этой концентрации.
Как показано на фиг. 6А , API увеличивался за счет добавления белков Gc, а уровни активации Gc1F и Gc1S были эквивалентны уровням LPS, используемого в качестве положительного контроля, хотя уровень активации Gc2 был немного ниже.
Затем мы исследовали эффект дегликозилирования, сравнивая активность Gc-1F по активации макрофагов из ExpiCHO-S с усеченной структурой (GalNAc-Thr 420 , положительный контроль), Gc-1F из CHO с удлиненной гликоформой (трисахарид- Thr 420 ) и Gc-1F из CHO с укороченной гликоформой (после реакции дегликозилирования GalNAc-Thr 420 ). Как показано на рис. 6В , API Gc-1F из ExpiCHO-S с укороченной структурой и Gc-1F из CHO с укороченной гликоформой были аналогичным образом увеличены, тогда как активация Gc-1F из CHO с удлиненной гликоформой была повышена. незначительно, что позволяет предположить, что Gc-1F из CHO активируется путем дегликозилирования. Мы также подтвердили, что API дозозависимо увеличивался до 100 нг/мл для Gc1F, Gc1S и Gc2 (рис. 6 C-1, -2, -3). Фактические значения, полученные в анализе активации макрофагов, приведены в дополнительной таблице 1 .
Рисунок 6
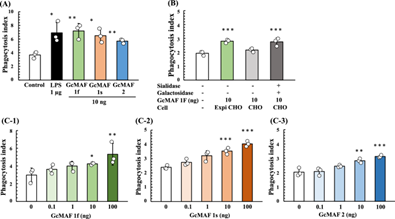
Анализ фагоцитоза белков Gc, синтезируемых в клетках ExpiCHO-S. Анализировали активность активации фагоцитоза GcMAF, очищенного на аффинной колонке с витамином D. Клетки U937 выращивали в среде RPMI-1640 и дифференцировали в макрофагоподобные клетки посредством обработки ТРА. ( A )
Дифференцированные клетки U937 подвергали воздействию белков Gc1F, Gc1S и Gc2 в течение 3 часов, а затем добавляли Dynabeads для оценки фагоцитарной активности (средний индекс фагоцитоза: API). ЛПС (1 мкг) использовали в качестве положительного контроля. ( B )
API Gc-1F из ExpiCHO-S с усеченной структурой (тип GalNAc-Thr 420 , положительный контроль), Gc-1F из CHO с удлиненной гликоформой [ тип трисахарида-Thr 420 , β- D -галактозидаза (- ) и сиалидаза (-)] и Gc-1F из CHO с укороченной гликоформой [тип GalNAc-Thr 420 , β- D -галактозидаза (+) и сиалидаза (+)]. ( C ) Зависимость «доза-реакция» для API Gc1F ( C-1 ), Gc1S ( C-2 ) и Gc2 ( C-3 ) из ExpiCHO-S. Значения представляют собой среднее значение ± стандартное отклонение. Статистическую значимость различий между контрольной и экспериментальной группами определяли с помощью критерия Даннетта (*p < 0,05, **p < 0,01).
Обсуждение
В этой работе мы представляем простую процедуру крупномасштабного получения активной формы Gc, активирующей фагоцитоз, а именно GcMAF.
У человека аллельные варианты Gc1F и Gc1S синтезируются в печени в виде неактивных по активации фагоцитоза и нереактивных форм лектина HPA и преобразуются в активные для активации фагоцитоза и реактивные формы лектина HPA путем расщепления О-связанной сиаловой кислоты-галактозы. -GalNAc-Thr 420 с получением моносахарида (GalNAc-Thr 420 ).
В соответствии с этим мы обнаружили, что неактивная по активации фагоцитоза и нереактивная к ГПА-лектину форма Gc1F синтезируется в клетках СНО и под действием ферментов дегликозилирования (β- D -галактозидаза и сиалидаза) (рис. 2Б , 6В ).
Однако, к нашему удивлению, активный, активирующий фагоцитоз, и реагирующий на лектин HPA Gc1F был непосредственно синтезирован в клетках ExpiCHO-S и в клетках Expi293-F в условиях бессывороточной суспензионной культуры.
Кроме того, Gc1S и Gc2 также были синтезированы как активные формы, активирующие фагоцитоз, в клетках ExpiCHO-S (рис. 6 ). Как и ожидалось, Gc1F и Gc1S были реактивны с HPA и VVA-лектинами. Однако Gc2 (мутация T420K) не было.
Это предполагает, что (1) HPA-лектин-реактивный сахарид может не иметь существенного значения для активности активации фагоцитоза белка Gc2, по крайней мере, in vitro, и (2) если это так, Gc2, синтезируемый в клетках ExpiCHO-S, может действовать как фагоцитоз. -фактор активации по механизму, не связанному с GalNAc.
Это может поддерживать гипотезу о том, что присутствие или отсутствие GalNAc в Thr 420 белка Gc не имеет значения для определения иммунной компетентности и/или риска рака 38 , а также может согласовываться с тем фактом, что риск рака у гомозигот Gc2-2 скорее снижается, чем увеличивается, даже несмотря на то, что они не способны продуцировать GcMAF, содержащий GalNAc-Thr 420 39 .
Стереоизображение общей складчатой структуры человеческого белка Gc 40 . указывает на то, что аминокислоты 418–420, включая сайт гликозилирования, расположены вблизи структуры петля-спираль (H3), а сахарный фрагмент, по-видимому, расположен снаружи глобулярной конформации H3 (дополнительный рисунок 3) . ) 41.
Таким образом, укороченный фрагмент сахара (GalNAc-Thr 420 ) может распознаваться предполагаемым белком-рецептором на клеточной поверхности макрофагов и может инициировать образование комплекса между белком Gc1 и предполагаемым рецептором (дополнительная фигура 3 B).
Однако узнавание/взаимодействие между сахарным фрагментом и предполагаемым рецептором само по себе может быть недостаточным для образования функционального/стабильного комплекса, а белок-белковое взаимодействие между белком Gc1 и предполагаемым рецептором может потребоваться для образования функционального/стабильного комплекса для преобразования сигнал активации макрофагов (дополнительный рисунок 3 B).
Таким образом, в этой системе GalNAc-Thr 420 может функционировать как маркер молекулярного узнавания предполагаемым рецептором, запуская белок-белковое взаимодействие. Напротив, трисахарид, присоединенный к Thr 420 , не распознается предполагаемым рецептором и, следовательно, не может инициировать белок-белковое взаимодействие. Кроме того, трисахарид, прикрепленный к Thr 420 , может мешать взаимодействию между белком Gc1 и предполагаемым рецептором (дополнительная фигура 3A ).
Это может быть причиной того, что для превращения неактивного белка Gc в активный GcMAF требуется усечение сиаловой кислоты и галактозы. Поскольку у Gc2 нет сахарной цепи, такого вмешательства в белок-белковое взаимодействие между Gc2 и предполагаемым белком-рецептором не произойдет (дополнительная фигура 3 C). Хотя до сих пор неясно, как предполагаемый рецептор может распознавать Gc2 без GalNAc на Thr 420 , аминокислотная замена (мутация T420K) в Gc2 может способствовать взаимодействию с предполагаемым рецептором, и если это так, то сам Gc2 может быть всегда функциональным, без активации.
Такое нерегулируемое взаимодействие между Gc2 и предполагаемым рецептором может объяснить, почему риск рака у гомозигот Gc2-2 скорее снижается, чем увеличивается 39 . Таким образом, наши результаты дают интригующий ключ к разгадке возможной роли гликанового фрагмента в передаче сигналов активации макрофагов.
Наши текущие данные показывают, что белок Gc1, синтезируемый в клетках ExpiCHO-S, почти полностью реагирует с HPA-лектином, что позволяет предположить, что вновь синтезированный Gc1 несет только моносахарид (GalNAc-Thr 420 ), и следующие реакции удлинения O — гликана не происходит.
Хотя основной механизм продукции этого укороченного O -гликана неизвестен, кажется вероятным, что поэтапный процесс гликозилирования в аппарате Гольджи изменяется в клетках ExpiCHO-S. Некоторые линии опухолевых клеток обнаруживают измененное распределение или частичную потерю ферментов O -гликозилирования в аппарате Гольджи 42 , а изменение пути биосинтеза O -гликанов может происходить сходным образом в клетках ExpiCHO.
Альтернативно, белок Gc1 может подвергаться преждевременному выходу из раннего отсека аппарата Гольджи. Таким образом, наши результаты открывают интересное будущее направление для дальнейших исследований механизма гликозилирования и секреции белков.
В заключение мы разработали методологию производства биологически активного GcMAF в больших количествах путем сверхэкспрессии белков Gc в клетках ExpiCHO-S в условиях бессывороточной суспензионной культуры.
Примечательно, что синтезированный GcMAF может быть очищен в одну стадию с помощью аффинной колоночной хроматографии с витамином D. Ожидается, что этот простой протокол подойдет для крупномасштабного производства высококачественного GcMAF для функционального анализа и клинических испытаний.
Материалы и методы
Конструирование векторов экспрессии Gc-белка
Мы получили двухцепочечную ДНК, кодирующую слитый белок, состоящий из белка Gc1F человека и гистидиновой метки (His) в C-концевом сайте (ДНК Gc1F-His), используя службу производства олиго-ДНК компании Invitrogen (дополнительная рис. 1) . А).
Некоторые триплетные кодоны были модифицированы в соответствии со скоростью использования кодонов в клетках животных, чтобы максимизировать эффективность трансляции. ДНК Gc1F-His встраивали в сайт клонирования TOPO вектора pcDNA3.4-TOPO (Invitrogen) (названного pcDNA3.4-TOPO Gc1F-His ), в котором вставленная ДНК Gc1F-His транскрибируется под контролем промотора CMV ( Дополнительный рисунок 2 ). Для создания ДНК Gc1S-His кодон GAT для аспарагиновой кислоты 416 (D 416 ) был заменен кодоном GAG для глутаминовой кислоты (E 416 ) (названный pcDNA3.4-TOPO Gc1S-His , дополнительный рисунок 1 B-1).
Для создания ДНК Gc2-His кодон ACC для треонина 420 (T 420 ) был заменен кодоном AAG для лизина (K 420 ) (названный pcDNA 3.4-TOPO Gc2-His ) (дополнительная фигура 1 B-2) 4 , 5 , 6 . Мы также синтезировали плазмиду экспрессии Gc мыши (pcDNA3.4-TOPO mouse-Gc ) (дополнительная фигура 1 C). Большие количества этих ДНК векторов экспрессии получали с использованием набора EndoFree Plasmid Kit (QIAGEN 12362) в соответствии с протоколом поставщика.
Культура клеток CHO и трансфекция экспрессирующей плазмиды Gc1F-His
Клетки яичников китайского хомячка (CHO) культивировали в среде F12 (GIBCO 11765), дополненной 10% термоинактивированной фетальной бычьей сывороткой (FBS, Biowest S1820), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Sigma-Aldrich P4333). ) при 37 °С во влажной атмосфере с содержанием 5% CO 2 . Клетки культивировали примерно до 80% слияния в 6-луночных культуральных планшетах. Плазмиду экспрессии pcDNA3.4-TOPO Gc1F-His (2,5 мкг) и Lipofectamine 2000 (15 мкл) (ThermoFisher Scientific Co.) добавляли по 2 мл среды на лунку. Планшеты инкубировали в течение 3 дней, затем собирали культуральную среду и клетки. Оценивали уровень экспрессии и модификацию сахара Gc1F-His.
Культура клеток ExpiCHO-S и Expi293-F
Клетки ExpiCHO-S (клетки ThermoFisher Scientific Co. ExpiCHO-S, номер по каталогу: A29127) культивировали в суспензии в 25 мл бессывороточной среды для экспрессии ExpiCHO в инкубаторе при 37 °C с увлажненной атмосферой, содержащей 8% CO 2 . воздухом на платформе орбитального шейкера, вращающейся со скоростью 125 об/мин, до конечной плотности 6 × 10 6 жизнеспособных клеток/мл.
Плазмиду экспрессии Gc (15 мкг) (pcDNA3.4-TOPO Gc1F-His , pcDNA3.4-TOPO Gc1S-His , pcDNA3.4-TOPO Gc2-His или pcDNA3.4-TOPO мышиный Gc ) разводили 1,0 мл Opti PRO SFM (ThermoFisher Scientific Co.) и смешивали с 80 мкл реагента ExpiFectamine CHO (ThermoFisher Scientific Co.), предварительно разбавленного 920 мкл Opti PRO SFM.
Эту смесь инкубировали в течение 5 минут при комнатной температуре и добавляли в колбу для культуры клеток ExpiCHO-S. Клетки инкубировали в течение ночи, затем добавляли 150 мкл ExpiCHO Enhancer и 6 мл ExpiCHO Feed (ThermoFisher Scientific Co.) и продолжали суспензионную культуру в течение 6–8 дней (согласно протоколу поставщика, культивирование клеток можно продолжать в течение до 14-15 дней).
Затем мы собрали клетки и среду и проанализировали уровни экспрессии и модификации сахара белков Gc.
Клетки Expi293F (клетки ThermoFisher Scientific Co. Expi293F, каталожный номер: A14528) культивировали в суспензии в 30 мл среды экспрессии Expi293 в инкубаторе при 37 °C с увлажненной атмосферой, содержащей 8% CO 2 на воздухе, на вращающейся платформе орбитального шейкера. при 125 об/мин до уровня 2,5 × 10 6 клеток/мл с жизнеспособностью > 95%.
Плазмиды экспрессии Gc (30 мкг) разводили 1,5 мл Opti-MEM (ThermoFisher Scientific Co.) и смешивали с 80 мкл реагента Expifectamine 293 (ThermoFisher Scientific Co.), предварительно разведенного Opti-MEM до 1,5 мл.
Эту смесь инкубировали в течение 20 минут при комнатной температуре, а затем добавляли в колбу для культуры клеток Expi293-F. Клетки инкубировали в условиях, указанных выше, и через 18 часов в колбу добавляли 150 мкл Expifectamine 293 Transfection Enhancer 1 и 1,5 мл Expifectamine 293 Transfection Enhancer 2 (ThermoFisher Scientific Co.). Клетки и среду собирали через 3 дня после трансфекции. Охарактеризованы уровни экспрессии и модификации сахаров продуцируемых Gc-белков.
Очистка белков Gc-His с помощью колонки His-Tag
Для очистки меченных гистидином Gc-белков мы проводили колоночную хроматографию His Trap HP (предварительно заряженный Ni 2+ ) (GE Healthcare Life Sciences) в соответствии с протоколом производителя. Вкратце: (1) колонку His Trap HP (5 мл) промывали связывающим буфером (20 мМ фосфата натрия, 150 мМ NaCl и 20 мМ имидазола, pH 7,4), (2) супернатант клеточной культуры доводили до состава и pH. буфера для связывания и фильтровали через фильтр 0,45 мкм, и (3) фильтрат наносили на колонку, которую промывали буфером для связывания и элюировали буфером для элюирования (20 мМ фосфата натрия, 150 мМ NaCl и 500 мМ имидазола, pH 7,4). ). Обессоливание проводили диализом против 50 мМ фосфата натрия, pH 7,0.
Оценка пролиферации клеток и количества клеток
Определяли количество жизнеспособных и общее количество клеток методом исключения трипанового синего. Суспензию клеток разводили 0,5% раствором трипанового синего и подсчитывали клетки на гематоцитометре Neubauer.
Количественное определение общего белка
Концентрации белка определяли с помощью набора для анализа белка BCA (Thermo Fisher 23227) или путем измерения оптической плотности при 280 нм.
Вестерн-блоттинг белков Gc и лектиновый блоттинг гликановых фрагментов
Синтезированные человеческие белки Gc-His смешивали с равными количествами буфера для проб SDS (125 мМ Tris-HCl, pH 6,8, 4% SDS, 60% глицерина, 10 мМ ЭДТА, 0,1 М DTT, 0,01% BPB, 10% 2-меркаптоэтанола). ) и нагревали при 90°С в течение 2 мин. Образцы подвергали электрофорезу на 5–20% полиакриламидном геле с ДСН (Nacalai tesque, Киото, Япония) и полосы переносили на мембраны из ПВДФ (Merck Millipore Ltd., ME) с использованием устройства для полусухого блоттинга.
Блот инкубировали при 4 °C в течение ночи с антителом против Gc (Abcam, ab153922) или с антителом против His-tag (Abcam ab18184), предварительно разведенным в блокирующем буфере, содержащем 5% обезжиренного молока в TBST (25 мМ Tris– HCl, pH 7,4, 150 мМ NaCl и 0,1% Твин 20).
Первичные антитела, антитела против DBP/Gc и антитела против His-tag, подвергались реакции с конъюгированными с пероксидазой хрена (HRP) антикроличьими IgG (NA934, GE Healthcare) и антимышиными IgG (GE Healthcare, NA9310v) соответственно. и визуализировали с помощью усовершенствованной системы хемилюминесцентного обнаружения (ECL prime, Amersham Bioscience). Конъюгированный с биотином лектин Helix pomatia (HPA) для Tn (Sigma-Aldrich, L6512) использовали для обнаружения фрагмента GalNAc/Tn, как сообщалось ранее 37 .
Кроме того, конъюгированный с биотином лектин Vicia villosa (VVA) для GalNAc/Tn (Vector Laboratories, B-1235), конъюгированный с биотином лектин Maackia amurensis II (MAL-II) для сиаловой кислоты/STn/ST (Vector Laboratories, B- 1265) и конъюгированный с биотином лектин арахиса (PNA) для дисахарида Gal-GalNAc/T (GeneTex, BTX01507) использовали для подтверждения гликозилирования белков Gc1 и Gc2.
Очистка белков Gc методом колоночной хроматографии на витамине D -СЕФАРОЗЕ
Супернатант суспензионной культуры или элюат колонки с ловушкой His наносили на колонку с 25(OH)D3 — сефарозой, приготовленную в соответствии с Link et al. 43 . Колонку промывали связывающим буфером (50 мМ Трис-HCl, 1,5 мМ ЭДТА, 150 мМ NaCl и 0,1% Тритон Х-100, рН 7,4) и элюировали 6 М гуанидином. Для обессоливания элюат диализовали против 10 мМ фосфата натрия, pH 7,4.
Анализ фагоцитоза
Фагоцитозную активность GcMAF оценивали в соответствии с описанным методом 44 с небольшими модификациями. Клетки U937 (линия клеток миелоидного лейкоза человека; KAC Co., Ltd., Ритто, Япония) выращивали в среде RPMI-1640 (Gibco от Life Technologies, Гранд-Айленд, США) с добавлением 10% (по объему) термоинактивированных FBS (Gibco Life Technologies, Гранд-Айленд, США) и пенициллин-стрептомицин (Sigma-Aldrich, США) в полностью увлажненной воздушной атмосфере с содержанием 5% CO 2 /95% при температуре 37 °C.
Чтобы вызвать дифференцировку в макрофагоподобные клетки, 2,5 × 10 6 клеток U937, высеянные на чашки для культивирования диаметром 10 см, обрабатывали 10 нг/мл 12- O -тетра-деканоилфорбол-13-ацетата (ТРА) (Nacalai tesque Co., Ltd. , Киото, Япония) в течение 3 дней, дважды промывали по 3 мл PBS Дульбекко (Gibco Life Technologies Grand Island, США), а затем трипсинизировали (1 мл трипсин-ЭДТА на чашку диаметром 10 см) в течение 2–3 мин при 37°. С. Затем 2,5 × 10 5 трипсинизированных клеток диспергировали в 10% среде FBS/RPMI-1640, наслаивали на покровные стекла в 24-луночном планшете и обрабатывали 10 нг/мл ТРА в течение 3 дней.
Эти клетки инкубировали с бессывороточной средой RPMI-1640 в течение 15 часов и предварительно обрабатывали GcMAF в течение 3 часов путем замены среды на бессывороточную среду RPMI-1640, содержащую 10 нг/мл GcMAF 1f , GcMAF 1s или GcMAF 2 . ЛПС (1 мкг/мл) использовали в качестве положительного контроля.
После предварительной обработки в течение 3 часов среду заменяли бессывороточной средой RPMI-1640, содержащей магнитные шарики с 90 мкг/мл белка G (Dynabeads Protein G; Invitrogen, Карлсбад, США) и инкубировали в течение 1,5 часов.
Покровные стекла промывали фосфатно-солевым буфером и клетки фиксировали метанолом в течение 1 мин. Фиксированные клетки сушили на воздухе, окрашивали раствором азур-эозина и метиленового синего Гимзы (Merck KGaA, Дармштадт, Германия) в течение 1 часа и промывали дистиллированной водой. Клетки сушили на воздухе, а затем погружали в малинол (Muto Pure Chemicals Co., Ltd., Токио). Клетки визуализировали с помощью прямого микроскопа (DM6B, Leica Microsystems, Германия); Были исследованы девять случайных участков в каждом образце покровного стекла. Активность GcMAF выражали как средний индекс фагоцитоза (API), рассчитанный по следующей формуле: API = (количество интернализованных шариков внутри макрофагов)/(количество макрофагов на фотографии).
Для каждого анализа мы подготовили три независимых образца, и, таким образом, для каждого образца было проанализировано 27 областей (9 случайных областей × 3 независимых образца). Вышеописанное обследование повторялось дважды.
Статистический анализ
Все значения выражены как среднее ± стандартное отклонение. Статистический анализ проводился с помощью EZR (Медицинский центр Сайтама, Медицинский университет Дзичи, Сайтама, Япония) 45 , который представляет собой графический интерфейс пользователя для R (Фонд R для статистических вычислений, Вена, Австрия); в частности, это модифицированная версия R Commander, предназначенная для добавления статистических функций, часто используемых в биостатистике. Статистическую значимость различий между контрольной и экспериментальной группами определяли с помощью критерия Даннетта.
Рекомендации
Дайгер, С.П. Белки, специфичные для группы компонентов (Gc), связывают витамин D и 25-гидроксивитамин D. Proc. Натл. акад. наук. США 72 , 2076–2080 (1975).
Статья ОБЪЯВЛЕНИЯ КАС ПабМед ПабМед Централ Google Scholar
Чун, РФ. Новые взгляды на белок, связывающий витамин D. Клеточная биохимия. Функц. 30 , 445–456 (2012).
Статья КАС ПабМед Google Scholar
Томас, WC и др. Изучение противорахитной активности в сыворотках больных с нарушениями кальциевого обмена и предварительные наблюдения за режимом в сыворотке крови человека. Дж. Клин. Вкладывать деньги. 38 , 1078–1085 (1959).
Статья КАС ПабМед ПабМед Централ Google Scholar
Клив Х. и Констанс Дж. Мутанты витамина D-связывающего белка: более 120 вариантов системы GC/DBP. Вокс. Санг. 54 , 215–225 (1988).
Статья КАС ПабМед Google Scholar
Спикеерт М., Хуанг Г., Деланж Дж. Р. и Таес Ю. Е. Биологические и клинические аспекты белка, связывающего витамин D (Gc-глобулин), и его полиморфизма. Клин. Хим. Acta 372 (1–2), 33–42 (2006).
Статья КАС ПабМед Google Scholar
Борхес, CR и др. Полная характеристика белков в популяциях человека. Клин. хим. 56 , 202–211 (2010).
Статья КАС ПабМед Google Scholar
Хаддад, JG и др. Идентификация стерол- и актин-связывающих доменов белка, связывающего витамин D плазмы (Gc-глобулина). Биохимия 31 , 7174–7181 (1992).
Статья КАС ПабМед Google Scholar
Аддо Дж.К., Свами Н. и Рэй Р. Положение C(19) 25-гидроксивитамина D(3) обращено наружу в стеролсвязывающем кармане витамина D витамина D-связывающего белка. Биоорг. Мед. хим. Летт. 12 , 279–281 (2002).
Статья КАС ПабМед Google Scholar
Вербовен С. и др. Структурная основа уникальных свойств связывания человеческого белка, связывающего витамин D. Нат. Структура. Биол. 2 , 131–136 (2002).
Линд, С.Э., Смит, Д.Б., Джанми, П.А. и Стоссель, Т.П. Роль гельзолина плазмы и белка, связывающего витамин D, в выведении актина из кровообращения. Дж. Клин. Вкладывать деньги. 78 , 736–742 (1986).
Статья КАС ПабМед ПабМед Централ Google Scholar
Ли, В.М. и Гэлбрейт, Р.М. Внеклеточная система поглотителя актина и токсичность актина. Н. англ. Дж. Мед. 326 , 1335–1341 (1992).
Статья КАС ПабМед Google Scholar
Ямамото Н. и Хомма С. Белок, связывающий витамин D3 (группоспецифический компонент), является предшественником сигнального фактора активации макрофагов из лимфоцитов, обработанных лизофосфатидилхолином. Учеб. Натл. акад. наук. USA 88 , 8539–8543 (1991).
Статья ОБЪЯВЛЕНИЯ КАС ПабМед ПабМед Централ Google Scholar
Ямамото Н., Линдсей Д.Д., Нарапараджу В.Р., Ирландия Р.А. и Попофф С.Н. Дефект в каскаде активации макрофагов, вызванном воспалением, у крыс с остеопетрозом. Дж. Иммунол. 152 , 5100–5107 (1994).
Шнайдер, ГБ, Бенис, К.А., Флай, Н.В., Ирландия, Р.А. и Попофф, С.Н. Влияние инфузии фактора активации белка-макрофага, связывающего витамин D (DBP-MAF), на резорбцию кости при двух остеопетрозных мутациях. Кость 16 , 657–662 (1995).
Статья КАС ПабМед Google Scholar
Свами Н., Гош С., Шнайдер Г.Б. и Рэй Р. Экспрессируемый бакуловирусом белок, связывающий витамин D, фактор активации макрофагов (DBP-maf) активирует остеокласты, а связывание 25-гидроксивитамина D 3 не влияет на эту активность. . Дж. Селл. Биохим. 81 , 535–546 (2001).
Статья КАС ПабМед Google Scholar
ДиМартино, С.Дж. и Кью, Р.Р. Первоначальная характеристика сайта связывания белка, связывающего витамин D (Gc-глобулин), на плазматической мембране нейтрофилов: данные о наличии протеогликана хондроитинсульфата. Дж. Иммунол. 163 , 2135–2142 (1999).
McVoy, LA & Kew, RR CD44 и аннексин A2 опосредуют функцию хемотаксического кофактора C5a белка, связывающего витамин D. Дж. Иммунол. 175 , 4754–4760 (2005).
Статья КАС ПабМед Google Scholar
Свасти Дж., Куроски А., Бкнетт А. и Боуман Б.Х. Молекулярная основа трех основных форм человеческого сывороточного белка, связывающего витамин D (групповой компонент). Биохимия 18 , 1611–1617 (1979).
Статья КАС ПабМед Google Scholar
Ямамото, Н. Структурное определение мощного фактора активации макрофагов, полученного из белка, связывающего витамин D3, с адъювантной активностью для производства антител. Мол. Иммунол. 33 , 1157–1164 (1996).
Борхес, К.Р., Джарвис, Дж.В., Оран, П.Е. и Нельсон, Р.В. Популяционные исследования микрогетерогенности витамина D-связывающего белка с помощью масс-спектрометрии позволяют охарактеризовать его генотип-зависимые паттерны O-гликозилирования. J. Протеом Рез. 7 , 4143–4153 (2008).
Статья КАС ПабМед Google Scholar
Борхес, К.Р. и Редер, Д.С. Гликановая структура фактора активации макрофагов, полученного из белка Gc, по данным масс-спектрометрии. Арх. Биохим. Биофиз. 606 , 167–179 (2016).
Статья КАС ПабМед Google Scholar
Килпатрик, Л.Е. и Килпатрик, Э.Л. Оптимизация масс-спектрометрии высокого разрешения для идентификации малочисленных посттрансляционных модификаций интактных белков. J. Протеом Рез. 16 , 3255–3265 (2017).
Статья КАС ПабМед ПабМед Централ Google Scholar
Равнсборг Т. и др. Гликозилирование и характеристика кандидатного фактора активации макрофагов Gc. Биохим. Биофиз. Acta 1804 , 909–917 (2010).
Статья КАС ПабМед Google Scholar
Редер, Д.С., Нельсон, Р.В. и Борхес, К.Р. Статус гликозилирования белка, связывающего витамин D, у онкологических больных. Белковая наука. 18 , 2036–2042 (2009).
Статья КАС ПабМед ПабМед Централ Google Scholar
Ямамото Н. и Кумасиро Р. Преобразование белка, связывающего витамин D3 (группоспецифический компонент), в фактор активации макрофагов путем поэтапного действия бета-галактозидазы В-клеток и сиалидазы Т-клеток. Дж. Иммунол. 151 , 2794–2802 (1993).
Мохамад С.Б., Нагасава Х., Уто Ю. и Хори Х. Получение фактора активации макрофагов, полученного из белка Gc (GcMAF), его структурная характеристика и биологическая активность. Противораковый Рез. 22 , 4297–4300 (2002).
Нагасава Х., Сасаки Х., Уто Ю., Кубо С. и Хори Х. Ассоциация активности предшественника фактора активации макрофагов (MAF) с полиморфизмом белка, связывающего витамин D. Противораковый Рез. 24 , 3361–3366 (2004).
Канда С., Мотидзуки Ю., Мията Ю., Канетаке Х. и Ямамото Н. Влияние фактора активации макрофагов, связывающего витамин D3 (GcMAF), на ангиогенез. Дж. Натл. Онкологический институт. 94 , 1311–1319 (2002).
Статья КАС ПабМед Google Scholar
Кискер О. и др. Фактор активации белка-макрофагов, связывающий витамин D (DBP-maf), ингибирует ангиогенез и рост опухолей у мышей. Неоплазия 5 , 32–40 (2003).
Статья КАС ПабМед ПабМед Централ Google Scholar
Пачини С., Моруччи Г., Пунци Т., Гулисано М. и Руджеро М. Фактор активации макрофагов, полученный из белка Gc (GcMAF), стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в хорионаллантоисной мембране куриного эмбриона. анализ. Рак Иммунол. Иммунотер. 60 , 479–485 (2010).
Статья КАС ПабМед Google Scholar
Кога Ю., Нарапараджу В.Р. и Ямамото Н. Противоопухолевый эффект фактора активации макрофагов, полученного из витамина D-связывающего белка, на мышей с асцитной опухолью Эрлиха. Учеб. Соц. Эксп. Биол. Мед. 220 , 20–26 (1999).
Мохамад, С.Б. и др. Фактор активации макрофагов, полученный из белка Gc (GcMAF): характер изоэлектрической фокусировки и противоопухолевая активность. Противораковый Рез. 23 , 4451–4457 (2003).
Нонака, К. Фактор активации макрофагов, связывающий белок витамина D, ингибирует ГЦК у мышей SCID. Дж. Сург. Рез. 172 , 116–122 (2012).
Статья КАС ПабМед Google Scholar
Ямамото Н., Суяма Х. и Ямамото Н. Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc. ГкМАФ. Перевод Онкол. 1 , 65–72 (2008).
Мохамад С.Б., Хори Х., Нагасава Х., Усуи К. и Уто Ю. Характеристика фактора активации макрофагов, полученного из белка Gc человека (GcMAF), и его функциональная роль в противоопухолевой активности макрофагов. Адв. Эксп. Мед. Биол. 510 , 77–82 (2003).
Статья КАС ПабМед Google Scholar
Грегори, К.Дж. и др. Фактор активации макрофагов, связывающий витамин D, напрямую ингибирует пролиферацию, миграцию и экспрессию uPAR клеток рака предстательной железы. PLoS ONE 5 , e13428 (2010).
Статья ОБЪЯВЛЕНИЯ КАС ПабМед ПабМед Централ Google Scholar
Уто, Ю. и др. Влияние предшественника фактора активации макрофагов, происходящего из Gc (PreGcMAF), на фагоцитарную активацию перитонеальных макрофагов мыши. Противораковый Рез. 31 , 2489–2492 (2011).
Руджеро М., Рейнвальд Х. и Пачини С. Является ли хондроитинсульфат ответственным за биологические эффекты, приписываемые фактору активации макрофагов, полученному из белка GC (GcMaf)? Мед. Гипотезы 94 , 126–131 (2016).
Статья КАС ПабМед Google Scholar
Аббас, С. и др. Аллель Gc2 белка, связывающего витамин D, связан со снижением риска рака молочной железы в постменопаузе, независимо от статуса витамина D. Эпидемиол рака. Биомаркеры Пред. 17 , 1339–1343 (2008).
Статья КАС ПабМед Google Scholar
Берман, Х.М. и др. Банк данных по белкам. Акта Кристаллогр. Д Биол. Кристаллогр. 58 , 899–907 (2002).
Статья КАС ПабМед Google Scholar
Вербов С. и др. Структурная основа уникальных свойств связывания человеческого белка, связывающего витамин D. Нат. Структура. Био. 19 , 131–136 (2002).
Брокгаузен, И. О-гликаны муцинового типа при раке толстой кишки и молочной железы человека: гликодинамика и функции. EMBO Rep. 7 , 599–604 (2006).
Статья КАС ПабМед ПабМед Централ Google Scholar
Линк, Р.П., Перлман, К.Л., Пирс, Е.А., Шнос, Х.К. и ДеЛука, Х.Ф. Очистка человеческого сывороточного витамина D-связывающего белка с помощью хроматографии на 25-гидроксивитамине D3-сефарозе. Анальный. Биохим. 157 , 262–269 (1986).
Статья КАС ПабМед Google Scholar
Исикава М. и др. Новая система анализа активности фактора активации макрофагов с использованием линии клеток человека U937. Противораковый Рез. 34 , 4577–4582 (2014).
Канда, Ю. Исследование бесплатного и простого в использовании программного обеспечения «EZR» для медицинской статистики. Транспл. костного мозга. 48 , 452–458 (2013).
Благодарности
Эта работа была поддержана грантами Научного фонда Такеда (И. Н.) и Фонда биомедицинских исследований и инноваций в Кобе (И. Н.). Эксперименты по производству Gc1F в клетках CHO и его характеристике были частично поддержаны фондом доктора Инуи из Сайсей-Мираи.
Информация об авторе
Авторы и филиалы
- Лаборатория молекулярных наук о жизни, Центр биомедицинских исследований и инноваций, Фонд биомедицинских исследований и инноваций в Кобе, 2-2 Minatojima-Minamimachi Chuo-ku, Кобе, 650-0047, Япония
Ёко Набешима, Чиаки Абэ, Такеши Каваучи, Томоко Хирои и Ёичи Набешима
- Высшая школа технологий, промышленных и социальных наук, Университет Токусима, Токусима, 770-8506, Япония
Ёсихиро Уто
Взносы
YN, CA и TH провели эксперименты по производству и характеристике белков Gc. Ю. выполнил функциональную характеристику синтезированных белков Gc и принял участие в критических дискуссиях. Йи. Н. разработал эксперименты, руководил проектом, обеспечил финансирование и написал рукопись вместе с Ю.Н.С.А. и Т.К.
Автор-корреспондент
Переписка с Ёити Набэсимой .
Этические декларации
Конкурирующие интересы
YN, CA и Йи. Н. указаны в качестве исследователей в заявке на патент на «новый способ получения биоактивных белков GcMAF». ТН, ТК и Ю заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ. Эта статья распространяется по международной лицензии Creative Commons Attribution 4.0, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе и в любом формате при условии, что вы укажете соответствующую ссылку на оригинального автора(ов) и источник. предоставить ссылку на лицензию Creative Commons и указать, были ли внесены изменения.
Изображения или другие материалы третьих сторон в этой статье включены в лицензию Creative Commons, если иное не указано в кредитной линии материала. Если материал не включен в лицензию Creative Commons статьи и предполагаемое использование не разрешено законодательством или превышает разрешенное использование, вам необходимо будет получить разрешение непосредственно от правообладателя.
