Gale Document Number: GALE|A329731916
James Jeffrey Bradstreet, Emar Vogelaar and Lynda Thyer
Initial observations of elevated alpha-N-acetylgalactosaminidase activity associated with autism and observed reductions from Gc protein—macrophage activating factor injections
Первоначальные наблюдения повышенной активности альфа-N-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдение снижения активности после инъекций белка Gc — фактора активации макрофагов.
Содержание
Введение:
Расстройства аутистического заболевания (РАС) — это нарушения развития, поражающие детей в масштабе 1:88 и, по-видимому, связанные с иммунными различными сложными нарушениями иммунной регуляции, включая аутотуритет.
Фермент альфа-N-ацетилгалактозаминидаза (нагалаза) дегликозилирует сывороточный белок Gc (белок, связывающий витамин D3), делая его неспособным активировать защиту макрофагов. Повышенная активность нагалазы связана с различными злокачественными новообразованиями, иммунными нарушениями и вирусными инфекциями.
Фактор активации макрофагов (GcMAF) неоднократно публиковался в качестве показателя для снижения активности нагалазы в сыворотке крови у различных пациентов с раком и ВИЧ. GcMAF — это природный белок с хорошо доказанной безопасностью и терапевтическими преимуществами, одобренными исследованиями на людях.
Методы:
Определенные родители из 40 человек с РАС обратилось за тестированием активности сыворотки нагалазы в рамках наблюдения иммунной дисрегуляции. Измерение активности фермента нагалазы было осуществлено в специальной лаборатории питательных веществ (ELN), Бунник, Нидерланды, с использованием конечноферментативного анализа хромогенного субстрата.
Некоторые родители пациентов с повышенной активностью нагалазы предпочитают еженедельные инъекции GcMAF, предоставляемые Immuno Biotech Ltd., Гернси, Великобритания (www.gcmaf.eu).
GcMAF очищают от сыворотки человека, полученной из Американского Красного Креста, с использованием высокоаффинной хроматографии на 25-гидроксивитамине D3-сефарозе. Затем белок дополнительно разбавляют для получения результатов терапии для пациентов, исходя из их причин.
Результаты:
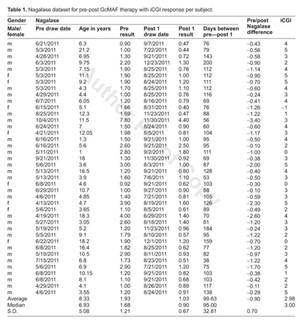
Лица с РАС (32 мужчины и 8, n = 40 женщин, возраст: 1 год 4 месяца — 21 год 2 месяца) прошла начальную и после лечения активность нагалазы.
Дозировка GcMAF была предпочтительна на основе ранее опубликованных кривых ответов, скорректированных лечащим врачом с учетом возраста, веса и уровня нагалазы.
Средняя активность нагалазы до лечения в группе аутистов составляла 1,93 нмоль/мин/мг субстрата. Это значительно превышало нормальный диапазон, заявленный лабораторией, равный <0,95 нмоль/мин/мг.
Для группы РАС средний уровень на момент второго измерения составил 1,03 нмоль/мин/мг, что отражает среднее снижение на 0,90 нмоль/мин/мг (Р<0,0001).
Помимо вероятных иммунологических преимуществ, снижающих активность нагалазы у этих людей, неконтролируемое наблюдение за терапией GcMAF требует дальнейшего улучшения речи, социализации и познания. Во время курсовых инъекций не было зарегистрировано никаких факторов, вызывающих воздействие.
Выводы:
В этом первом отчете об активности нагалазы у пациентов с аутизмом показано, что у большинства людей ее уровень значительно выше ожидаемого для здоровых людей. Хотя нагалаза является неспецифическим маркером иммунной дисрегуляции, ее соблюдение мер при аутизме может иметь как этиологическое, так и терапевтическое значение. Важно отметить, что это также первый отчет о снижении активности нагалазы в тенденции аутистов при инъекциях GcMAF.
Ключевые слова: аутизм, иммунная дисфункция, нагалаза, фактор активации макрофагов, биомаркер.
Введение
Аутизм – это сложное расстройство нервного развития, проявляющееся в первые три года жизни. Когда-то это было редкое заболевание, сейчас оно проявляется в масштабах эпидемии, если не пандемия.
Недавний отчет центра США по врожденным дефектам и нарушениям развития выявил различный диапазон распространенности от 4,8 до 21,2 на 1000 детей в возрасте 8 лет (данные за 2008 год). (1)
Эти данные отражают средний рост на 23% по сравнению с оценкой, полученной два года назад. Хотя более серьезных тенденций не существует, эта тенденция при аутизме, по крайней мере, наводит на мысль об инфекционном патогенезе. В этом последнем случае, что в процессе обрабатываются различные организмы, в том числе: желудочно-кишечные инфекции, (2) полиомавирусы, (3) хламидофилы, (4) борнавирусы, (5) парамиксовирусы, (6) и Borrelia burgdorferi. (7)
Хотя любой из них может вызвать небольшой процент случаев аутизма, маловероятно, что какой-либо из них по отдельности представляет собой источник этой эпидемии.
Несмотря на эту неопределенность, все больше данных подтверждают значительную иммунную дисфункцию, включая аутоиммунитет, при аутизме. (8)
Одновременно в этой популяции часто наблюдаются окислительный стресс (9) и митохондриальная дисфункция (10).
Одним из возможных объяснений характера иммунной дисрегуляции и окислительного стресса, наблюдаемого при расстройствах аутистического спектра (РАС), может быть персистенция активных патогенов, возможно, в перинатальном или последующем периоде развития ребенка. (11)
Известно также, что вирусы нарушают внутриклеточную регуляцию кальция в соответствии с собственными функциональными потребностями и при этом нарушают активность митохондрий. (12)
Измерение биомаркеров, связанных с иммунной дисрегуляцией и предполагаемыми инфекционными агентами, является обычной частью оценки автора (JB) РАС в клинических условиях. Недавно оценка активности альфа-N-ацетилгалактозаминидазы (нагалазы) стала коммерчески доступной в качестве диагностического лабораторного измерения.
Нагалаза была опубликована как биомаркер, связанный с различными типами рака, (22-24,29,30) системной красной волчанкой (СКВ), (13) гриппом, (14) и инфекцией вируса иммунодефицита человека (ВИЧ). (31)
Он ферментативно отличается от печеночной галактозаминидазы и, по-видимому, гораздо более биологически активен. Таким образом, это неспецифический биомаркер, который, по-видимому, является важным индикатором вторичной иммунной дисрегуляции.
Нагалаза является компонентом вирусного гемагглютинина и высвобождается под действием трипсина на гемагглютинин. (14)
Поскольку гемагглютинин является обычным гликансвязывающим лектином многих вирусов (включая грипп, парамиксовирусы и полиомавирусы), несколько вирусов могут индивидуально или совместно способствовать активности нагалазы, производной гемагглютинина, в крови. (15)
При отсутствии недавней вирусной инфекции или злокачественных новообразований повышенная активность нагалазы, вероятно, представляет собой маркер вирусной продукции белка гемагглютинина, на который действует активность трипсина, опосредованная воспалительными клетками; как таковой он может отражать персистенцию вируса, активную транскрипцию и воспаление.
Транскрипция вирусного белка является одним из потенциальных механизмов аутоиммунитета. (16,17)
Помимо этого, нагалаза представляет собой фермент, который дегликозилирует белок Gc, также известный как белок, связывающий витамин D (VDBP), делая его неспособным превращаться в активный GcMAF (фактор активации макрофагов, полученный из белка Gc) и тем самым предотвращая его регуляцию. активации макрофагов. (18) Примечательно, что дефицит витамина D, как во время беременности, так и во время постнатального развития, является очевидным фактором риска развития аутизма. (19) Влияние нагалазы на транспортировку витамина D VDBP не известно. Однако дефицит витамина D является известным фактором риска аутоиммунитета. (20)
В свете возможного участия иммунных нарушений, аутоиммунитета, дефицита витамина D и потенциальной персистенции вируса JB и другие врачи добавили скрининг нагалазы в профиль биомаркеров (21) детей, поступающих на биомедицинскую оценку расстройств, связанных с аутизмом, и сопутствующих заболеваний. -заболевания.
Методы
Ретроспективный обзор карт для анализа рутинных тестов на нагалазу был выполнен для первоначальной группы пациентов, обследованных клиницистом (JB). Все записи были проверены JB на предмет подтверждения результатов теста, подтвержденного диагноза аутизма, временных интервалов между тестированием, дозировки последующего используемого GcMAF и наблюдаемых реакций врача/родителей/терапевта/учителя.
Все пациенты соответствовали критериям аутизма (299,00 пересмотренного DSM-IV) и были диагностированы либо детским неврологом, либо психологом развития, а также получили оценку клинициста. Никаких существенных изменений в лечении участников не было внесено, за исключением введения GcMAF, в течение периода времени, указанного в этом исследовании.
Дополнительные предварительные оценки
Помимо соответствия пересмотренным критериям аутизма DSM-IV и независимого определения степени тяжести аутизма, выполненного независимыми практикующими врачами, клиницист в этом исследовании использовал собственную систему оценки степени тяжести. Он состоял из 20 вопросов (Таблица 4), предназначенных для оценки относительной тяжести в стандартных областях, необходимых для диагностики аутизма (т.е. языка, социализации и стереотипий), а также других значимых детерминант.
В рамках каждой категории врач и родители договорились о следующей оценке: 1 = нормально или близко к норме; 2 = легкая степень; 3 = умеренный; 4 = тяжелая.
Все участники, прошедшие эту первоначальную оценку, находились в диапазоне 3–4 баллов по вопросу 1 (Общее впечатление о тяжести аутизма или задержке развития).
Это также справедливо и для основных областей аутизма (вопросы 2, 4 и 10).
Кроме того, все участники получили 4 балла (серьезно) за вопрос 9, что указывает на отсутствие творческой игры или игры, соответствующей возрасту.
Значительная вариабельность наблюдалась для большинства других областей анкеты, особенно в областях, связанных с моторикой (как мелкой, так и грубой), где наблюдалась наибольшая первоначальная вариабельность.
Конкретные оценки в каждой области выходили за рамки первоначального ретроспективного анализа и вместо этого были бы пригодны для будущего перспективного расследования.
Родители предоставили письменное информированное согласие на флеботомию и оценку потенциальных сопутствующих заболеваний, возникающих у их детей с аутизмом.
В частности, с родителями обсуждалась нагалаза как потенциальный маркер иммунной дисрегуляции.
По согласованию родителей брали венозную кровь в количестве, достаточном для заполнения пробирки с ЭДТА объемом 9 мл, которую затем немедленно переворачивали не менее 5 раз.
Затем пробирку центрифугировали в течение 10 минут при 3000 об/мин для отделения плазмы. После отделения примерно 3 мл прозрачной плазмы переносили в пробирку для сбора плазмы, которую затем немедленно замораживали до -20°C в течение по меньшей мере 24 часов.
Затем образец был отправлен замороженным на ночь в промежуточную лабораторию в Нью-Джерси, США. Собранные образцы хранились замороженными во время дальнейшей отправки в АНО.
Когорта в этом первоначальном исследовании состояла из 40 пациентов, чьи записи включали результаты анализов крови на нагалазу как до, так и после лечения. Поскольку это была предварительная и ретроспективная оценка как активности нагалазы, так и ответа на GcMAF, эти первоначальные данные и наблюдения отражают только период между первым и вторым тестированием нагалазы у пациентов.
Из 40 испытуемых было 32 мужчины (возраст на момент первого тестирования варьировался от 1 года и 4 месяцев до 21 года) и 8 женщин (возраст варьировался от 4 лет 7 месяцев до 18 лет, медиана = 6,93 [+ или -). ] СД 5,08 лет).
Анализ нагалазы
Следуя процедуре, опубликованной Ямамото и др. (22,23), активность нагалазы определяли с помощью конечного ферментативного анализа с использованием хромогенного субстрата. ELN установила референтный диапазон 0,32-0,95 нМ/мин/мг субстрата на основе сыворотки, собранной у здоровых добровольцев, диапазон, практически сопоставимый с ранее сообщенным, который составлял от 0,35 до 0,65 нМ/мин/мг. (24)
Подготовка GcMAF
Пациенты получили коммерчески доступный GcMAF от Immuno Biotech Ltd., Гернси, Великобритания (http://www.gcmaf.eu). Immuno Biotech приготовила GcMAF в соответствии с процедурой, описанной в их опубликованных материалах. (24)
Вкратце, белок Gc выделяли из очищенной человеческой сыворотки, полученной от Американского Красного Креста, с использованием либо высокоаффинной хроматографии на 25-гидроксивитамине D3-сефарозе, либо аффинной хроматографии на актин-агарозе.
Связанный материал элюировали, а затем подвергали дальнейшей обработке путем инкубации с тремя иммобилизованными ферментами. Полученный GcMAF стерилизовали фильтрованием. Содержание и концентрацию белка анализировали с использованием стандартных методов анализа белка по Брэдфорду. (25) В конце производственного процесса GcMAF был проверен на стерильность внутри и снаружи Агентством по охране здоровья Великобритании и независимыми лабораториями. (26)
Анализ активности GcMAF
Анализ активности GcMAF был основан на методе пролиферации живых макрофагов с использованием водорастворимого МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетранатрий бромид, Calbiochem[R]). Клетки культивировали в присутствии диапазона концентраций GcMAF и инкубировали в течение 72 часов. Добавляли растворимый МТТ и клетки инкубировали в течение дополнительного периода времени.
Результирующее изменение цвета, обусловленное преобразованием МТТ, измеряли с помощью планшет-ридера при 460 нм. Затем активность GcMAF можно было определить путем сравнения отрицательного и положительного контроля с использованием линии мышиных макрофагов RAW 264.7 [Sigma-Aldrich[R]].
Положительная активация макрофагов была продемонстрирована путем апоптоза клеток рака молочной железы MCF7 (Национальная лаборатория Лоуренса в Беркли). Известный внутри компании положительный стандарт также был включен в анализ в качестве контроля. Дальнейшее тестирование активности этого продукта GcMAF было проведено путем измерения его биологического воздействия как на мононуклеарные клетки периферической крови человека (27), так и на клетки рака молочной железы человека. (28)
После соответствующего письменного информированного согласия родителей GcMAF вводили подкожно еженедельно с использованием инсулинового шприца 31 калибра. У взрослых с ВИЧ или несколькими различными типами рака типичная доза, описанная для ответа на внутримышечное или внутривенное введение, составляла минимум 100 нг/неделю.
Несмотря на то, что уровни активности нагалазы находятся в диапазоне многих больных раком или ВИЧ, клиницисты решили не превышать 100 нг/неделю, чтобы предотвратить предполагаемую чрезмерную стимуляцию макрофагов. Все пациенты начинали с низких доз, которые постепенно увеличивали в ходе лечения. Дозы варьировались от 4 до 100 нг в неделю и корректировались в зависимости от клинического ответа, возраста, массы тела и исходного уровня активности нагалазы.
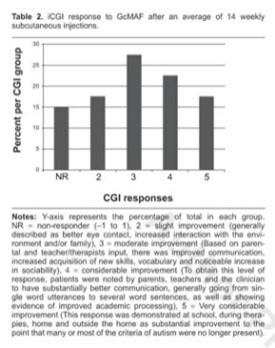
Для дальнейшей оценки клинических ответов всех родителей опрашивали с интервалом не более месяца с использованием улучшенной шкалы клинического глобального впечатления (iCGI), определенной Кадури и др. и описанной ниже. (29)
Улучшенный формат ответа для шкалы общего клинического впечатления об улучшении.
Усовершенствованный формат ответа по шкале клинического общего впечатления от улучшения выглядит следующим образом: 5 = очень значительное улучшение; 4 = Значительное улучшение; 3 = умеренное улучшение; 2 = незначительное улучшение; 1 = Очень незначительное улучшение; 0 = состояние не изменилось; -1 = очень незначительное ухудшение; -2 = незначительное ухудшение; -3 = Умеренное ухудшение; -4 = Значительное ухудшение; -5 = Очень значительное ухудшение; -6 = Максимальное ухудшение.
Статистические методы
Из-за относительно небольшой численности населения в целом и всего 8 женщин в этой выборке группа оценивалась как единое целое, а не разделялась по полу или возрасту. Статистическое сравнение уровней нагалазы до и после лечения проводилось с помощью двустороннего парного различия Mtest и с использованием стандартных формул в Microsoft Excel[R] 2010. Поскольку у одного субъекта результат нагалазы был значительно выше среднего, следует учитывать искажение артефакта. был сделан.
С поправкой на эффект асимметрии медиана группы изменилась с 1,71 до 1,68, что не было статистически значимым.
Полученные результаты
Средняя активность нагалазы до лечения GcMAF составляла 1,93 нМ/мин на мг со средним значением 1,68 нМ/мин на мг (стандартное отклонение [+ или -] 1,21 нМ/мин на мг) и диапазоном 0,90 нМ/мин. на мг до 7,80 нМ/мин на мг (табл. 1). На момент последующего тестирования (средний интервал 100 дней, [+ или -] SD 32 дня) средняя активность нагалазы во время лечения GcMAF составляла 1,03 нМ/мин на мг при медиане 0,90 нМ/мин на мг ( [+ или -] 0,67 нМ/мин на мг) и в диапазоне от 0,44 до 4,40 нМ/мин на мг. Это отражает среднее снижение на 0,90 нМ/мин на мг (P <0,0001). Из этой исходной группы только 2 из 40 (5%) первоначально находились в пределах лабораторного референтного диапазона (0,90 и 0,92 нМ/мин на мг).
Из-за стандартного времени выполнения лабораторных анализов и необходимого времени для обсуждения вариантов лечения с родителями фактическое количество еженедельных инъекций было существенно меньше, чем количество недель в интервале повторного тестирования. Среднее количество еженедельных инъекций составляло 14 ([+ или -]4 недели стандартного отклонения).
На момент повторного тестирования уровни нагалазы у 24 из 40 пациентов (60%) снизились до уровня лабораторного референтного диапазона <0,95 нМ/мин на мг. С учетом этих результатов минимум 16 пациентов (40%) будут считаться не получившими адекватного терапевтического эффекта и, следовательно, будут кандидатами на продолжение вмешательства. Только у 1 из 40 (2,5%) не удалось отреагировать на значительное снижение активности нагалазы (разница до/после нагалазы составляла всего 0,10 нМ/мин на мг). Семьи двух пациентов, у которых начальные уровни нагалазы находились в верхней части лабораторного референсного диапазона, решили начать терапию GcMAF. У обоих пациентов наблюдалось значительное снижение активности нагалазы: у одного наблюдался значительный ответ (iCGI = 4), а у другого был отнесен к категории не ответивших на лечение.
Начальные уровни активности нагалазы в группе пациентов, которые мы изучали, варьировались от верхнего предела нормы до уровней, превышающих уровни, обычно наблюдаемые у больных метастатическим раком (30,31) и ВИЧ-инфицированных пациентов. (32) Несмотря на опасения по поводу аутоиммунитета при аутизме, ни у одного из пациентов, наблюдавшихся в этом исследовании, не наблюдалось значительных побочных эффектов, и никому не пришлось приостанавливать или прекращать лечение. В течение первых нескольких недель лечения у 3 из 40 пациентов (7,5%) отмечалось повышение температуры тела от слабого до умеренного, которое обычно происходило через 24–48 часов после инъекции GcMAF и продолжалось менее 24 часов.
Родителям было дано указание использовать ибупрофен только в том случае, если температура превышала 102°F (приблизительно 39°C), а двоих лечили в течение первых нескольких недель. Ко второму месяцу ни у одного пациента не наблюдалось значительных лихорадочных явлений. Интересно, что в течение первых 3 недель у 6 из 40 пациентов (15%) наблюдались высыпания, совместимые с вирусными экзантемами (чаще на туловище и в виде мелких папул, чем пятен). Петехии не наблюдались. Эти высыпания могут быть проявлением латентной или персистирующей вирусной инфекции, взаимодействующей с активированными макрофагами.
Обсуждение
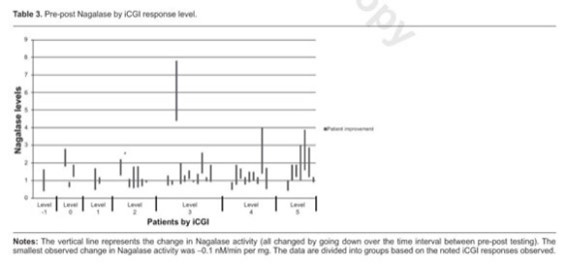
Поскольку это открытый, неконтролируемый ретроспективный анализ, необходимо соблюдать осторожность при объяснении причины и следствия любого результата лечения. Однако ответ на GcMAF был устойчивым в отношении снижения уровня нагалазы, а также улучшения симптоматики, как показало iCGI. Несмотря на короткий период наблюдения, результат, согласно которому 67,5% группы ответили в диапазоне от 3 до 5 CGI-I, оказался неожиданно существенным (таблицы 2 и 3).
В этой небольшой популяции не наблюдается очевидной связи между реакцией iCGI и изменением активности нагалазы (таблица 3). Поэтому дальнейший статистический анализ был сочтен нецелесообразным.
Заключение
Изменения активности нагалазы в ответ на лечение GcMAF в этой популяции с РАС отражают аналогичные устойчивые ответы, наблюдаемые при использовании GcMAF при лечении ВИЧ-инфекции и рака. Однако аутизм представляет собой расстройство развития со значительными задержками в основных областях когнитивной деятельности (язык, социализация и поведение) и обычно считается пожизненным заболеванием. Таким образом, эти первоначальные наблюдения подтверждают мнение о том, что аутизм сам по себе может быть следствием поддающейся лечению патофизиологии. Учитывая, что в настоящее время РАС поражает более 1% детей в США, наблюдаемая реакция на GcMAF требует срочной и дальнейшей проспективной оценки.
Хотя нагалаза является неспецифическим маркером, который, как полагают, происходит из вирусного гемагглютинина, она может быть полезна в качестве биомаркера терапевтического значения при РАС и, как таковая, также требует дальнейшего изучения. Независимо от какого-либо немедленного клинического улучшения, снижение уровня нагалазы до более желательного уровня может принести этим пациентам потенциальную пользу, поскольку известно, что нагалаза ослабляет иммунную защиту.
Вклад автора
Основной автор, ведение базы данных, статистический анализ и врач: Дж. Б. Нагаласе. Лабораторные методики и помощь со статистическими методами: EV. Способы получения GcMAF: LT.
Благодарности
Мы благодарим родителей за их участие в сборе этих данных. Кроме того, мы благодарим Кори Свенсона за помощь с графиками в Таблице 3.
Финансирование
Это исследование частично финансировалось Международным ресурсным центром развития детей, Сувани, Джорджия.
Конкурирующие интересы
Джей Би назначает тестирование и рекомендует методы лечения для детей с аутизмом. Его сын и пасынок страдают аутизмом. Ранее у EV была финансовая заинтересованность в ELN, лаборатории, которая тестирует нагалазу.
LT используется компанией Immuno Biotech, Ltd. (лаборатория по выделению и очистке белка GcMAF). Однако в случае с ELN EV не знала ни используемых методов лечения, ни имен пациентов, чьи данные анализировались. Кроме того, в случае с ЛТ ни она, ни какой-либо сотрудник Immuno Biotech не знали ни результатов теста нагалазы, ни имен пациентов/родителей, использованных в этом исследовании.
Раскрытие информации и этика
По требованию публикации автор(ы) предоставили издателю подписанное подтверждение соблюдения юридических и этических обязательств, включая, помимо прочего, следующее: авторство и участие, конфликт интересов, неприкосновенность частной жизни и конфиденциальность и (где применимо) защиту прав человека. и предметы исследований на животных. Авторы прочитали и подтвердили свое согласие с критериями авторства ICMJE и конфликта интересов. Авторы также подтвердили, что данная статья уникальна и не рассматривается и не публикуется в каком-либо другом издании, а также что у них есть разрешение правообладателей на воспроизведение любого материала, защищенного авторским правом. Любая информация публикуется в этом разделе. Внешние слепые рецензенты не сообщают об отсутствии конфликта интересов.
дои: 10.4137/AUI.S10485
Рекомендации
(1.) Байо Дж. Распространенность расстройств аутистического спектра — Сеть мониторинга аутизма и нарушений развития, 14 сайтов, США, 2008. MMWR Surveill Summ. 30 марта 2012 г.;61(3):1–19.
(2.) Файнголд С.М., Даунс Дж., Сумманен П.Х. Микробиология регрессивного аутизма. Анаэроб. Апрель 2012 г.;18(2):260-2.
(3.) Линтас К., Альтиери Л., Ломбарди Ф., Сакко Р., Персико А.М. Ассоциация аутизма с полиомавирусной инфекцией в посмертном мозге. JНейровирол. март 2010 г.; 16(2):141-9.
(4.) Контини С., Серачени С., Культрера Р., Кастеллацци М., Граньери Е., Файнарди Е. Инфекция Chlamydophila pneumoniae и ее роль в неврологических расстройствах. Междисциплинарная перспектива InfectDis. 2010;2010:273573. Электронная публикация, 21 февраля 2010 г.
(5.) Плетников М.В., Рубин С.А., Васудеван К., Моран Т.Х., Карбоне К.М. Повреждение головного мозга, связанное с аномальным игровым поведением у неонатальных крыс Льюиса, инфицированных болезнью Борна: модель аутизма. Поведение мозга Res. Апрель 1999 г.; 100(1-2): 43-50.
(6.) Чесс С. Аутизм у детей с врожденной краснухой. J Детский аутизм, шизофрения. Январь-март 1971 г.; 1(1):33-47.
(7.) Брансфилд Р.К., Вульфман Дж.С., Харви В.Т., Усман А.И. Связь между клещевыми инфекциями, Лайм-боррелиозом и расстройствами аутистического спектра. Мед. гипотезы. 2008;70(5):967-74.
(8.) Оноре С., Кареага М., Эшвуд П. Роль иммунной дисфункции в патофизиологии аутизма. МозгПоведениеИммун. Март 2012 г.; 26(3): 383–92.
(9.) Чаухан А., Аудхья Т., Чаухан В. Окислительно-восстановительный дисбаланс глутатиона, специфичный для области мозга, при аутизме. Нейрохим Рез. Август 2012 г.;37(8):1681-9.
(10.) Джуливи С., Чжан Ю.Ф., Оманска-Клусек А. и др. Митохондриальная дисфункция при аутизме. ДЖАМА. 1 декабря 2010 г.;304(21):2389-96.
(11.) Фатеми С.Х., Куадра А.Е., Эль-Факахани Э.Э., Сидвелл Р.В., Турас П. Пренатальная вирусная инфекция вызывает изменения в экспрессии nNOS в развивающемся мозге мышей. Нейроотчет. 15 мая 2000 г.; 11(7):1493-6.
(12.) Чжоу Ю, Фрей Т.К., Ян Дж.Дж. Вирусная кальциомика: взаимодействие между Ca2+ и вирусом. Клеточный кальций. Июль 2009 г.;46(1):1–17. Epub, 16 июня 2009 г. Обзор ^
(13.) Ямамото Н., Нарапараджу В.Р., Мур М., Брент Л.Х. Дегликозилирование сывороточного витамина D3-связывающего белка альфа-N-ацетилгалактозаминидазой обнаружено в плазме больных системной красной волчанкой. Клин Иммунол Иммунопатол. Март 1997 г.;82(3):290-8.
(14.) Ямамото Н., Ураде М. Патогенное значение активности альфа-N-ацетилгалактозаминидазы, обнаруженной в гемагглютинине вируса гриппа. Микробы заражают. Апрель 2005 г.;7(4):674-81.
(15.) Варки А., Каммингс Р.Д., Эско Дж.Д. и др. Основы гликобиологии. 2-е изд. Глава 34. Микробные лектины: гемагглютинины, адгезины и токсины. Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор; 2009.
(16.) Кера Т.К., Дик А.Д., Николсон Л.Б. Механизмы регуляции TNFα при увеите: внимание к РНК-связывающим белкам. Прог Retin Eye Res. Ноябрь 2010 г.;29(6):610-21. Epub, 8 сентября 2010 г. Обзор. Ошибка в: Prog Retin Eye Res. Март 2011 г.; 30(2): 147.
(17.) Жиродон П., Бернар А. Хронические вирусные инфекции центральной нервной системы: аспекты, специфичные для рассеянного склероза. Преподобный Нейроль (Париж). октябрь 2009 г.; 165(10):789-95.
(18.) Ямамото Н., Нарапараджу ВР. Иммунотерапия мышей BALB/c с асцитической опухолью Эрлиха с помощью фактора активации макрофагов, связывающего витамин D. Рак Рез. 1 июня 1997 г.; 57(11): 2187-92.

(19.) Коцовска Е., Фернелл Е., Биллстедт Е., Миннис Х., Гиллберг С. Витамин D и аутизм: клинический обзор. Res Dev Disabil. Сентябрь 2012 г.;33(5):1541-450.
(20.) Гриффин, М.Д., Син Н., Кумар Р. Витамин D и его аналоги как регуляторы иммунной активации и презентации антигена. Анну преподобный Нутр. 2003;23: 117-45.
(21.) Брэдстрит Дж. Дж., Смит С., Барал М., Россиньол Д.А. Вмешательства, основанные на биомаркерах, при лечении клинически значимых состояний, связанных с расстройствами аутистического спектра и синдромом дефицита внимания и гиперактивности. Altern Med Ред., апрель 2010 г.;15(1):15-32.
(22.) Ямамото Н., Нарапараджу В.Р., Асбелл С.О. Дегликозилирование сывороточного витамина D-связывающего белка и иммуносупрессия у онкологических больных. Рак Рез. 1996;56:2827-31.
(23.) Ямамото Н., Нарапараджу В.Р., Ураде М. Прогностическая ценность сывороточной aN-ацетилгалактозаминидазы и иммуносупрессия в результате дегликозилирования сывороточного белка Gc у пациентов с раком полости рта. Рак Рез. 1997;57:295-9.
(24.) Ямамото Н., Суяма Х., Ямамото Н. Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc, GcMAF. Перевод Онкол. Июль 2008 г.;1(2):65–72.
(25.) Брэдфорд, ММ. Быстрый и чувствительный метод количественного определения микрограммовых количеств белка, использующий принцип связывания белка с красителем. Анальная биохимия. 1976;7:248-54.
(26.) Анализы GcMAF. ПЕРВЫЙ ИММУННЫЙ GCMAF. http://www.gcmaf.eu/info/index.php?option=com_content&view=article&id=114&Itemid=53.
(27.) Пачини С., Моруччи Г., Пунци Т., Гулисано М., Руджеро М. Фактор активации макрофагов, полученный из белка Gc (GcMAF), стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоисной мембраны куриного эмбриона. Рак Иммунол Иммунотер. апрель 2011 г.; 60(4):479-85.
(28.) Пачини С., Пунци Т., Моруччи Г., Гулисано М., Руджеро М. Влияние фактора активации макрофагов, связывающего витамин D, на клетки рака молочной железы человека. Противораковый Рез. Январь 2012 г.; 32(1): 45–52.
(29.) Кадури А., Коррубл Э., Фалиссар Б. Улучшенная глобальная клиническая шкала впечатлений (iCGI): разработка и проверка при депрессии. БМК Психиатрия. 6 февраля 2007 г.; 7:7.
(30.) Ямамото Н., Суяма Х., Накадзато Х., Ямамото Н., КогаЙ. Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF. Рак Иммунол Иммунотер. Июль 2008 г.;57(7):1007-16.
(31.) Ямамото Н., Суяма Х., Ямамото Н., Ушиджима Н. Иммунотерапия пациентов с метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF). Инт Джей Рак. 15 января 2008 г.; 122(2):461-7.
(32.) Ямамото Н., Ушидзима Н., Кога Ю. Иммунотерапия ВИЧ-инфицированных пациентов с помощью фактора активации макрофагов, полученного из белка Gc (GcMAF). Джей Мед Вирол. Январь 2009 г.;81(1):16–26.
