Immunotherapy with GcMAF revisited — A critical overview of the research of Nobuto Yamamoto
Пересмотр иммунотерапии с помощью GcMAF — критический обзор исследований Нобуто Ямамото
Содержание
Основные моменты
- Новый взгляд на иммунотерапию с помощью GcMAF
- Почти стехиометрическое связывание GcMAF с макрофагами и их активация
- Одна инъекция в неделю со 100 нг GcMAF
- Продолжительность терапии от 20 до 60 недель; отсутствие побочных эффектов
- Терапию контролировали сывороточной активностью α-N-ацетилгалактозаминидазы при рН 6,0
В данном обзоре описаны исследования Нобуту Ямамото (Филадельфия) по иммунотерапии GcMAF у пациентов с онкологическими заболеваниями и у пациентов, инфицированных патогенными оболочечными вирусами.
GcMAF (Group-специфичный c-omponent Macrophage-A, активирующий F-актер) — это белок млекопитающих, обладающий невероятной способностью напрямую активировать макрофаги. С конца 1980-х годов исследования Ямамото публиковались во многих журналах, но для того, чтобы понять детали его исследований, требовался детальный обзор многих его патентов.
Но и тогда, к сожалению, не хватало точного описания его экспериментов.
В этом обзоре предпринята попытка обобщить все исследования Ямамото по GcMAF, а также некоторые избранные более поздние работы других исследователей, которые пытались проверить и/или воспроизвести сообщения Ямамото. На мой взгляд, наиболее важный результат исследования GcMAF заслуживает широкого внимания: инъекции
GcMAF для человека (100 нг в неделю, внутримышечно или внутривенно) могут помочь вылечить пациентов с самыми разными видами рака, а также пациентов, инфицированных патогенными оболочечными вирусами, такими как вирус иммунодефицита человека 1 (ВИЧ-1), грипп, корь и краснуха (и, возможно, также SARS-CoV-2). Из данных Ямамото можно вычислить, что GcMAF является почти стехиометрическим активатором макрофагов.
Ямамото контролировал прогресс своей иммунотерапии с помощью сывороточного уровня фермента под названием нагалаза (активностьактозаминидной азы α-N-цетилгал при рН 6). Я подробно обсуждал свойства и потенциальный каталитический центр активности этого фермента в приложении, озаглавленном: «Поиск потенциального активного центра латентной активности α-N-ацетилгалактозаминидазы в гликопротеинах некоторых оболочечных вирусов».
Ключевые слова
Нобуто Ямамото (Филадельфия),Иммунотерапия вирусами GcMAF,Nagalase, Cancer Envelope
Сокращения
ГП120- гидрофильная N-концевая часть gp160, высвобождаемая при расщеплении фурином клетки-хозяина
ГП41- гидрофобная С-концевая часть gp160, образующаяся после расщепления фурином клетки-хозяина
ВИЧ-1- Вирус иммунодефицита человека 1
Нага- α-N-ацетилгалактозаминидаза
Нага4 -(человек/курица) лизосомальная активность Naga при рН 4,3
Нагаласе- активность Naga при рН 6,0 (здесь также называется Naga6)
ПНП- пара-нитрофенол;
ЮАР- сиаловая кислота
SARS-CoV-2- тяжелый острый респираторный синдром коронавирус
ТАМ- опухоль-ассоциированные макрофаги.
Знакомство
В 2008/2009 гг. в Филадельфии появились четыре статьи группы Нобуто Ямамото [1], [2], [3], [4], описывающие успешную иммунотерапию рака и ВИЧ-1 белком млекопитающих GcMAF (Group-специфический component M acrophage-A ctivating Fактера).
На первый взгляд, результаты этих четырех статей Ямамото выглядели слишком хорошо, чтобы быть правдой. У ограниченного числа пациентов, не страдающих анемией (8 с раком толстой кишки, 16 с раком молочной железы или предстательной железы и 15 инфицированных ВИЧ-1) уровень нагалазы в сыворотке крови (активность α-N-ацетилгал-актозаминидной азы при рН 6) использовали в качестве маркера остаточной массы опухоли во время лечения GcMAF.
Было отмечено, что после прекращения иммунотерапии GcMAF (который был единственным лечением), когда уровень нагалазы достигал базового уровня, все пациенты оставались свободными от симптомов в течение многих лет. Для больных раком молочной железы этот срок составлял не менее 4 лет и даже до 10 лет [5].
Для пациентов с колоректальным раком или раком предстательной железы, а также с ВИЧ-1/СПИДом этот срок составлял не менее 7 лет. Кроме того, уровень нагалазы в них не увеличивался в течение этих лет. Упоминание об этих бессимптомных периодах выживаемости указывает на то, что многие из описанных исследований были проведены на рубеже веков или ранее. Эта серия статей вызвала у меня интерес, и я решил ознакомиться с экспериментальными базами исследований Ямамото, описанными в его статьях и патентах.
Ямамото и его коллеги начали в конце 1980-х годов исследовать механизмы, которые человеческий организм использует для борьбы с раком. В настоящем обзоре я обсуждаю предложение Ямамото по раннему выявлению рака и мониторингу изменений в злокачественной опухоли с помощью сывороточных уровней нагалазы. Эта активность здесь также называется Naga6, чтобы отличить ее от сывороточной активности классического лизосомального фермента α-N-ацетилгалактозаминидазы (EC 3.2.1.49, Naga; дефектная у пациентов с болезнью Шиндлера) с оптимальным рН при рН 4,3 [6], [7], [8], здесь также называется Naga4.
Далее я обсуждаю доклады Ямамото, описывающие лечение пациентов с раком, а также с инфекциями, вызванными некоторыми патогенными оболочечными вирусами, путем применения иммунотерапии GcMAF. Будучи биохимиком на пенсии, я интересуюсь чисто научными вопросами.
Для получения более подробной информации по ряду вопросов, указанных в данном основном тексте, читателю рекомендуется ознакомиться с дополнительной информацией (разделы S1-S11, рисунки S1-S12, таблицы S1-S2, 87 ссылок).
В Приложении, озаглавленном «Поиск потенциального активного центра латентной активности α-N-ацетилгалактозаминидазы в гликопротеинах некоторых оболочечных вирусов» (разделы А1-А4, рисунки А1-А10, таблица А1, 37 ссылок) я рассмотрел доступные 3D-структуры гликопротеинов (спайковых белков) патогенных оболочечных вирусов ВИЧ-1, гриппа, Эболы и SARS-CoV-2. Ни одна из структур не содержала квартет активных центров аминокислотных остатков Trp-Trp-Asp-Glu, указывающий на эндогликогидролазу. Тем не менее, они показали характерные трио аминокислотных остатков Trp, Asp и Glu в конформации, аналогичной трио активного центра Trp-Asp-Asp в лизосомальной α-N-ацетилгалактозаминидазе.
Трио W-D-E в гликопротеинах ВИЧ-1 и гриппа может объяснить (латентную) активность нагалазы, о которой сообщил Ямамото. Трио в спайковых белках лихорадки Эбола (W-E-E) и SARS-CoV-2 (W-D-E) указывают на возможную (латентную) активность нагалазы, но это еще предстоит установить.
Раковые клетки имеют ряд общих свойств
Генетические мутации почти во всех типах раковых клеток влияют на набор из 12 основных клеточных сигнальных путей и процессов.
Это, в свою очередь, приводит к тем же биоэнергетическим и иммунологическим фенотипическим изменениям. Поскольку это помогает лучше понять выводы Ямамото, я обсудил это в разделе S1 Дополнительной информации.
Открытие Ямамото: белок млекопитающих под названием GcMAF является самым мощным активатором макрофагов
Как было рассмотрено в 1970 году [9], стимуляция иммунной системы для лечения рака, т.е. иммунотерапия, привлекла внимание еще в начале 1900-х годов. После этого интерес к нему снижался вплоть до открытия опухолеспецифических антигенов в середине 1950-х годов.
В конце 1980-х годов группа Нобуто Ямамото в Филадельфии начала исследования компонентов крови, участвующих в активации макрофагов.
Основная идея этих исследований заключалась в том, что «воспаление, вызванное микробной инфекцией или введением бактериальных компонентов, приводит к хемотаксису и активации макрофагов. На этом основании мы предполагаем, что макрофаги внутри хозяина распознают стимулирующий сигнал, исходящий из воспалительной области».
Первоначально был изучен механизм мощной активации in vivo и in vitro макрофагов мышей алкил-лизофосфолипидами и их метаболитами алкилглицерофосфатами и алкилглицеролами [10, 11]. Алкил-лизофосфолипиды входят в число продуктов распада стенок многих раковых клеток.
Макрофаги получали из клеток брюшины обработанных и контрольных мышей или, для эксперимента in vitro, из резидентных клеток брюшины необработанных мышей. В обоих случаях почти все клетки (около 96%), адгезивные к стеклянным покровным стеклам, были идентифицированы как макрофаги по фагоцитарным и морфологическим критериям.
Активацию определяли с помощью анализов при приеме внутрь, продукции супероксида и цитицидной активности в отношении клеток ретинобластомы.
Используя додецилглицерин (DDG, алкилглицерин) для инициирования активации макрофагов мышей (in vivo и in vitro), было обнаружено, что для максимальной активации необходимы различные компоненты крови: (а) В-лимфоциты, активированные DDG [12]; б) необработанные Т-лимфоциты [12] и; (c) растворимый сывороточный белок [13], идентифицированный как белок Gc [14, 15]. Сама по себе DDG не оказывала активирующего действия на макрофаги.
Белок Gc
Белок Gc (Group-специфический component) в крови был идентифицирован Хиршфельдом в 1959 г. (о чем упоминается в [16]) и получил свое название годом позже [17]. Несмотря на то, что в организме человека насчитывается около 120 изоформ Gc, большинство людей (от 92 до 100% [16, [18], [19], [20]]) являются носителями одной из трех основных полиморфных форм, называемых Gc1f, Gc1s и Gc2 (возможны шесть аллельных комбинаций).
Показания «f» и «s» для белков Gc1 обусловлены их различной относительной электрофоретической подвижностью. Один (Gc1f) движется каноду (более негативный белок), чем другой (Gc1s; s — медленный). Различие между этими тремя полиморфными формами Gc заключается в точечных мутациях в аминокислотной последовательности в положениях 416 и 420 (см. раздел S2, таблицу S1). Обратите внимание, что все последовательности содержат T418.
Молекулярная масса Gc составляет 51,2 кДа (запись в базе данных UniProtKB для Gc2: P02774), а зрелый белок состоит из 458 аминокислотных остатков. В плазме/сыворотке крови он присутствует в концентрациях от 250 до 350 мг/л (около 6 мкМ), но и более крупные вариации (от 75 до 450 мг/л) были обнаружены у практически здоровых лиц [21].
Одной из функций Gc является перенос (аполярных) стеринов витамина D [ 22 , 23 ]. Поэтому его часто называют витамин-D-связывающим белком (VDBP или DBP). Gc также может прочно связывать мономера актина, и важнейшей функцией Gc является очистка внеклеточного G-актина (глобулярного актина), высвобождаемого из цитоскелета некротизированных и/или поврежденных клеток [ 24 , 25 ]. Это предотвращает полимеризацию этих гидрофобных мономеров в F-актин (волокнистый актин), что в противном случае может привести к закупорке кровеносных капилляров.
Период полувыведения некомплексированного Gc в крови человека составляет от 2 до 2,5 дней, а период полувыведения Gc-актина в плазме составляет всего от 30 до 60 мин. Gc-актин выводится печенью.
Суточный синтез Gc в печени составляет около 10 мг/кг. Таким образом, тяжелая травма может привести к опасно низкому уровню Gc и органной недостаточности [ 26 , 27 ]. Gc в крови здоровых лиц составляет от 20 до 44% (мол.мол.моль−1) Gc-актина [28].
О-гликозилирование Gc
В 1983 году было сообщено, что белок Gc1s может содержать один линейный трисахарид, NeuAc-α- (2→3)-Gal-β-(1→3)-GalNAc-α-(1→0)-, связанный с остатком серина (S) или треонина (T) (здесь также пишется как SA-Gal-GalNAc-S/T). Степень О-гликозилирования составила около 1% (по массе), в то время как Gc не содержал N-гликозидов [18] (аббревиатуры: NeuAc, N-ацетилнейраминовая кислота, сиаловая кислота (SA); Гал, галактоза; GalNAc, N-ацетил-α-D-галактозаминид). В этом раннем исследовании гликозилирование не было обнаружено в Gc2 (предположительно из-за предела обнаружения используемых методов). Как будет показано ниже, гликозилирование может происходить на Т418, присутствующем во всех трех основных формах Gc, и/или на Т420 (отсутствует в Gc2).
GcMAF
Ямамото и его коллеги обнаружили, что активация В-клеток с помощью DDG индуцирует 3-кратное увеличение β-галактозидазы, связанной с внешней поверхностью. Они предположили, что эта повышенная активность может играть роль в превращении Gc в активатор макрофагов.
Кроме того, они предположили, что активность необработанных Т-клеток, связанная с внешней поверхностью нейраминидазы (сиалидазы), также была вовлечена.
Это привело к мысли о том, что в их исследованиях на животных известное О-гликозилирование белка Gc [18] было частично дегликозилировано β-галактозидазой (В-клеток, активированных DDG) и сиалидазой (Т-клеток) до продукта Gc, названного GcMAF [15, 29, 30].
Это было подтверждено экспериментами, в которых очищенный человеческий Gc1 (смесь Gc1f и Gc1s) обрабатывали покупными β-галактозидазой и сиалидазой, иммобилизованными на отдельных агарозных колонках.
Полученный в результате продукт GcMAF оказался столь же эффективным, как и препарат, полученный из В- и Т-клеток [15]. При использовании клеток GcMAF образовывался только тогда, когда белок Gc сначала обрабатывали активированными В-клетками, а затем Т-клетками;
Обратный порядок не сработал. Однако в случае с иммобилизованными ферментами порядок лечения не имел значения. На этом основании было высказано предположение, но не показано, что белок Gc1 может содержать разветвленную Gal-(SA)-GalNAc-трисахаридную группу, связанную с остатком треонина.
С помощью Gc2 человека активный продукт GcMAF может быть получен непосредственно с помощью активированных В-клеток или со связанными со столбцами β-галактозидазы.
Поэтому было высказано предположение, что Gc2 может содержать Gal-GalNAc- di-saccharid, связанный с Thr [15]. Я обобщил выводы Ямамото на рисунке 1 и адаптировал их в свете результатов и предложений Борхеса и др. [20, 31, 32]. как описано в Разделе S2. Кроме того, я указал на возможные активные формы GcMAF Gc1, не упомянутые ни Ямамото, ни Борхесом.
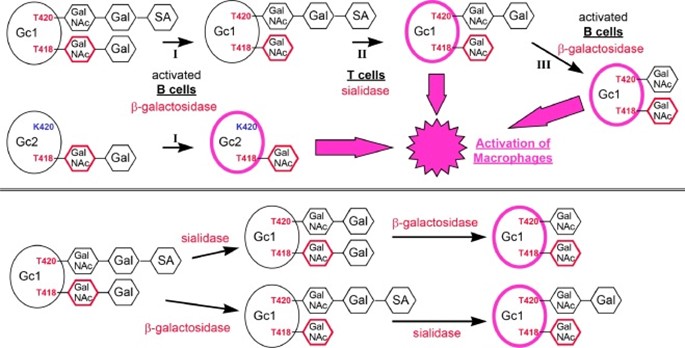
Скачать : Загрузить изображение в высоком разрешении (498KB)
Скачать : Скачать полноразмерное изображение
Рис 1. Схематическое изображение образования GcMAF из Gc1 или Gc2 по Ямамото в адаптированном мною виде. Верхняя панель: Превращение Gc1 (Gc1f, Gc1s) или Gc2 с активированными В-клетками (реакция I) и Т-клетками (реакция II). Имейте в виду, что только небольшой процент молекул Gc содержит ди- и/или трисахариды. Для Gc1 аналитические данные показывают, что трисахарид является линейным [18, 31, 32, 47], а не разветвленным, предложенным Ямамото [30].
По-видимому, сиалидаза на Т-клетках не реагирует с Gc1, если остаток Т418 все еще содержит дисахарид. Следовательно, Gal-GalNAc-T418 сначала должен быть преобразован в GalNAc-T418 с помощью β-галактозидазы из активированных В-клеток, прежде чем сиалидаза из Т-клеток сможет вступить в реакцию. Как поясняется ниже, вполне вероятно, что Gc1 с GalNAc-T418 и Gal-GalNAc-T420 также активен (фиолетовый овал). В естественных условиях дальнейшее удаление оставшегося сахара Gal (галактозы) активированными В-клетками (реакция III) приведет к получению продукта с GalNAc-T418 плюс GalNAc-T420. GcMAF, приготовленный из Gc2, требует только действия β-галактозидазы на активированные В-клетки.
Реакции I и II могут возникать in vitro и in vivo; III реакция протекает только in vivo. Нижняя панель: Получение GcMAF из Gc1 с (приобретенной) β-галактозидазой и сиалидазой. При этом порядок лечения не важен. Обратите внимание, что в зависимости от последовательности обработки связанными со столбцами ферментами, активный GcMAF (фиолетовый овал) образуется либо с GalNAc-T418 плюс GalNAc-T420, либо с GalNAc-T418 плюс Gal-GalNAc-T420.
Я поддерживаю предположение Борхеса и др. [32]. что только сахар GalNAc на Т418 (фиолетовый шестиугольник) необходим для активации макрофагов, при условии, что Т420 (когда он присутствует) не несет трисахаридов.
По данным Yamamoto et al., GcMAF был наиболее мощным активатором макрофагов, описанным до этого времени [33].
Они предположили, что GcMAF является естественным активатором макрофагов у млекопитающих, и что инъекция GcMAF в обход вовлечения В- и Т-клеток может быть использована в качестве мощного адъюванта для (неспецифического) усиления иммунного ответа на раковые антигены у человека [ 30 , 33 ].
Карбокси-концевая часть Gc отвечает за макрофагоактивирующее действие GcMAF
Ямамото обнаружил, что карбокси-концевая часть белка ответственна за активацию макрофагов [30, 34]. Полипептид, содержащий С-концевой домен (80 аминокислотных остатков) Gc1s, был получен путем клонирования фрагмента кодирующего гена и экспрессии его в клетках насекомых.
Очищенный белок обрабатывали иммобилизованной β-галактозидазой и сиалидазой, и полученный белок называли CdMAF (Cd от C-концевой domain). Он был так же активен, как и Gc1s-MAF (даже при лечении пациентов с раком предстательной железы) [35]. Ни один из двух белков MAF не вызывал никаких побочных эффектов у человека.
Упоминалось, что даже белок MAF, приготовленный из полипептида с С-концевыми 40 аминокислотными остатками Gc1, проявляет активацию макрофагов [34].
Пептиды с менее чем 40 аминокислотами не могут экспрессироваться в клетках насекомых. Кроме того, такие мелкие пептиды быстро деградируют в крови. Молекулярные структуры Gc2 и С-концевых полипептидов, рассмотренные здесь, показаны на рисунке 2.
Результаты Ямамото показывают, что присутствие связанного витамина D в GcMAF не имеет значения для его активности MAF, поскольку CdMAF пропускает N-концевой домен, который связывает стерины витамина D [ 36 , 37 ].
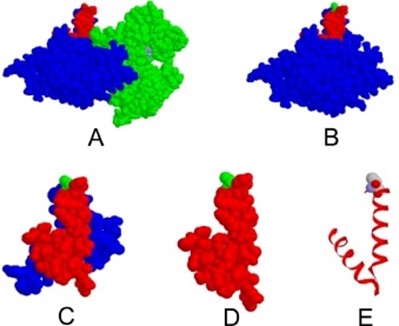
Скачать : Загрузить изображение в высоком разрешении (209KB)
Скачать : Скачать полноразмерное изображение
Рис 2. Молекулярная структура Gc2 человека со связанным актином из скелетной мышцы кролика. (A) Полная рентгеновская структура Gc2-актина (запись PDB 1KXP [91]). В этом представлении заполнения пространства (радиусы Ван-дер-Ваальса) молекула Gc2 выделена синим цветом, за исключением С-конца, а актин — зеленым. С-концевые 80 аминокислотные остатки Gc2 выделены красным цветом (Lys377-Ile457 в зрелом белке, но от Lys393 до Ile473 согласно файлу 1KXP, где включена N-концевая лидерная последовательность из 16 аминокислотных остатков). Актин содержит молекулу Mg-АТФ (Mg в фиолетовом цвете, АТФ в цветах CPK). (B) Та же структура, но теперь молекула актина удалена, а T418 в Gc2 выделен зеленым цветом. Обратите внимание, что Т418 явно торчит из конструкции. (C) Структура С-концевых 80 аминокислотных остатков. Остатки от K377 до D416 выделены синим цветом, остатки от A417 до I457 (аминокислотные остатки C-концевой 40) — красным, а T418 — зеленым. (D) Структура С-концевых 40 аминокислотных остатков красного цвета; T418 в зеленом цвете. (E) То же самое (D), но теперь в виде ленты с T418 в цветах CPK и заполнении пробелов. Используемые цвета CPK (цвета элементов): C, серый; Н, синий и О, красный.
Синтетические аналоги GcMAF
Имеются сообщения о синтетических аналогах GcMAF, оказывающих активирующее действие на макрофаги. Показано, что именно 3D-структура GalNAc-содержащей α-спирали в Gc лежит в основе MAF-эффекта. Это описано в Разделе S3.
Иммунотерапия GcMAF
Ямамото запатентовал большинство своих открытий, начиная с 1993 года с патента на «Ферментативное превращение in vitro гликозилированного белка, связывающего витамин D человека, в мощный фактор активации макрофагов» [38]. Очищенный от крови Gc [39] обрабатывали колоночной иммобилизованной β-галактозидазой (EC 3.2.1.23) из Escherichia coli и сиалидазой из Vibrio cholerae или Arthrobacter ureafaciens (все от Boehringer), после чего препарат GcMAF стерилизовали фильтром. Физиологический раствор вводили (внутримышечно или внутривенно; от 30 до 35 нг GcMAF каждые три-пять дней) одному человеку (Ямамото или одному из его коллег?), что приводило к значительному и длительному уровню активации макрофагов.
Исследования пациентов Ямамото
Первые результаты лечения пациентов были описаны в 2002 г. в патентной заявке [40] под названием «Получение мощных факторов активации макрофагов, полученных из клонированного связывающего витамина D белка и его домена, и их терапевтическое применение при раке, ВИЧ-инфекции и остеопетрозе».
Патент был подан 19 марта 1996 года, но опубликован только 6 лет спустя (25 июня 2002 года). Для контроля терапевтического эффекта во время лечения измеряли активность сыворотки крови пациента по превращению pNP-α-GalNAc (пара-нитрофенил-α-GalNAc; бесцветный) при рН 6,0 в α-GalNAc плюс pNP (пара-нитрофенол; бесцветный при рН 6,0, но желтый при рН 10). Эта активность экзогликогидролазы была значительно повышена у пациентов. Начиная с 1997 года, Ямамото называл эту деятельность «нагаласе» [35].
Еще один наиболее информативный патент [41], озаглавленный «Определение активности альфа-N-ацетилгалактозаминидазы», был подан 5 июня 1996 года, но опубликован только 3 сентября 2003 года.
Описано, что для автоматизации определения уровня нагалазы в сыворотке крови использовали моноклональные антитела против очищенной раковой ткани нагалазы или нагалазы из сыворотки крови больных ВИЧ-1/СПИДом. Антитела вырабатывали методом гибридомы. Это позволило проводить регулярный мониторинг уровня белка нагалазы в образцах методом сэндвич-ИФА.
Два моноклональных антитела не вступали в перекрестную реакцию, поэтому фермент нагалаза у больных раком, по-видимому, отличался от фермента нагалазы у больных ВИЧ-1/СПИДом. Методика ИФА с использованием еще одного специфического моноклонального антитела также применялась для мониторинга уровня нагалазы у пациентов с гриппом [42], [43], [44].
У онкологических больных методом сэндвич-ИФА определяли уровень белка нагалазы с помощью цветного анализа в мкг антигена (NagAg, очищенная нагалаза из ткани рака легкого) на мл сыворотки/плазмы. Любопытно, что Ямамото утверждал [42], что «активность сыворотки/плазмы α-N-ацетилглактозаминидазы также выражалась как произведение концентрации NagAg (мкг) и 0,25 нмоль/мг/мин, потому что я обнаружил, что 1 мкг фермента (NagAg) в сыворотке крови имеет 0,25 нмоль/мг/мин активности фермента».
Выдержка из Таблицы 1 этого патента приведена в Разделе S4, Таблице S2. Таким образом, количество нагалазы (как число без единиц), определенное в 1 мл образца методом ИФА, просто умножали на 0,25 нмоль/мг/мин. Эти единицы (нмоль/мг/мин) использовались во всех публикациях Ямамото, хотя ни в одной из этих работ слово «ИФА» никогда не упоминалось в тексте, лишь иногда в ссылках. Как обсуждалось ранее [8], уровни нагалазы, упомянутые Ямамото для здоровых людей (в нмоль/мин на мг сывороточного белка), примерно на два порядка выше, чем те, которые определяются при прямых измерениях активности (в нмоль/мин на мл сыворотки).
Если предположить, как обсуждалось в разделе S11, что Naga6 — это просто Naga4 с измененным N-гликозилированием и оптимумом pH, но с аналогичной кинетикой фермента, то оценка его сывороточной концентрации (в μ g.mL−1) можно сделать следующим образом. Нормальная сывороточная активность Naga6 (с 2,4-динитрофенол-GalNAc, рН 5,8) составляет около 0,035 U.mL−1 [8], а удельная активность чистого рекомбинантного Naga4 (с pNP-GalNac, рН 4,5) составляет 20,3 U.mg−1 [45]. Это дает сывороточную концентрацию белка Naga6 около 1,7 мкм g.mL−1. Это значение того же порядка, что и уровень нагалазы, упомянутый Ямамото в сыворотке крови здоровых людей (3,9 мкм g.mL−1 [42]). Какими бы ни были (нечетные) единицы, значение имеет изменение численного значения уровня нагалазы во время иммунотерапии GcMAF.
Недостатком ИФА-теста является то, что его нельзя применять непосредственно к плазме/сыворотке.
Сродство связывания антител к Naga6, по-видимому, ингибируется высокозаряженным низкомолекулярным веществом в сыворотке. Таким образом, перед проведением ИФА-теста этот ингибитор должен был быть удален из плазмы/сыворотки путем обработки сульфатом аммония. Осадок, полученный от 30% до 70% насыщения сульфатом аммония, повторно растворяли и подвергали интенсивному диализу перед тестированием методом ИФА [41]. На мой взгляд, эпитоп используемого моноклонального антитела вполне может состоять из комбинации белка и углеводов.
В этом случае ингибитором может быть богатый углеводами основной компонент сыворотки, например, протеогликаны, такие как хондроитин-6-сульфат, кератансульфат, гепарин, дерматан сульфат или гиалуронат. Обработка сульфатом аммония не оказывала влияния на непосредственно детерминированную активность Naga6 в сыворотке крови [8].
Ямамото использовал метод ИФА как для пациентов с большим разнообразием видов рака, так и для здоровых людей. Это означает, что моноклональное антитело, выращенное против очищенной нагалазы из ткани рака легкого [42], специфически реагировало с нагалазой из всех этих источников. Таким образом, я прихожу к выводу, что нагалаза в плазме/сыворотке крови всех больных раком должна быть одним и тем же белком, и что он также присутствует в сыворотке крови здоровых людей. Тем не менее, Ямамото всегда сообщал, но не показывал, что уровень активности в сыворотке крови здоровых людей обусловлен α-галактозидазой, а не нагалазой. Он заявил [1]: «Это ферментативная активность α-галактозидазы, которая может катаболизировать хромогенный субстрат (т.е.-нитрофенил-N-ацетил-α-D-галактозаминид) для Нагалазы». Это неверно, поскольку позже было показано, что рекомбинантная α-галактозидаза человека (α-Gal, EC 3.2.1.22) не проявляет никакой активности с pNP-α-GaNAc [45].
Лечебные эффекты GcMAF у пациентов с раком предстательной железы, молочной железы или толстой кишки, лейкемией или ВИЧ-1, для которых традиционные методы лечения (хирургическое вмешательство, γ-облучение и/или химиотерапия) больше не были эффективными, были впервые опубликованы в виде серии рисунков [42] с использованием уровней нагалазы в сыворотке крови в качестве мониторинга. В 2002 г. появился более сложный набор цифр из исследования с участием более 500 пациентов [40], хотя патент был подан 19 марта 1996 г. В патенте говорилось, что «после 25 еженедельных приемов 100 нг GcMAF у большинства (>90%) пациентов с раком предстательной железы и молочной железы наблюдался незначительно низкий уровень сывороточного фермента.
Аналогичный результат также наблюдался после 35 введений GcMAF пациентам с раком толстой кишки. Наблюдалось аналогичное лечебное действие GcMAF на рак легких, печени, желудка, головного мозга, мочевого пузыря, почек, матки, яичников, гортани, пищевода, полости рта и кожи».
Отклики в научном мире и в средствах массовой информации
Для большей части академического сообщества эффекты GcMAF у онкологических больных, описанные в патенте 2002 г. [40], останутся незамеченными. Кроме того, не было явного интереса фармацевтических компаний к этому или другим патентам Ямамото.
Это привело к тому, что главный исследователь, возможно, в отчаянной попытке привлечь к себе внимание, опубликовал эти результаты начала 1990-х годов в четырех регулярных статьях в 2008/2009 годах [1], [2], [3], [4]. Пример рисунка из патента 2002 г. (подана 19 марта 1996 г., опубликована 25 июня 2002 г.) показан на рисунке 3, где он сравнивается с рисунком из статьи 2008 г. [1].
Аналогичные сравнения можно провести и для пациентов с колоректальным раком или раком молочной железы, а также с ВИЧ-1/СПИДом. Действительно, четыре газеты 2008-2009 годов привлекли немало внимания мировых СМИ. Однако через несколько лет работы подверглись резкой критике со стороны Ugarte et al [46]. с комментариями вроде «Ни один ключевой лидер общественного мнения не подтвердил его использование в онкологии» и «Эти результаты не могут быть научно подтверждены, поскольку они противоречат устоявшимся принципам в онкологии».
Мой комментарий на это заключается в том, что есть множество примеров крупных открытий в науке, которые были отвергнуты с использованием такого рода аргументов, потому что они не вписывались в нынешние представления ведущего научного сообщества.
Кроме того, авторы указали на некоторые предполагаемые административные и технические причины.
Это привело к тому, что издатели отозвали три из этих статей Ямамото. Ugarte et al [46]. не предпринимал никаких попыток упомянуть какие-либо из ранних работ Ямамото.
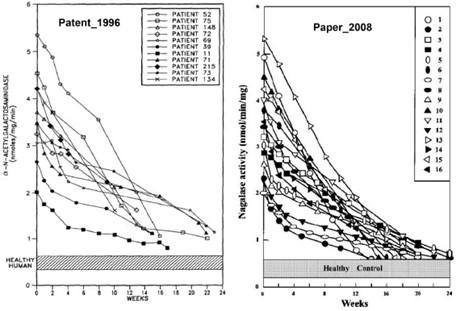
Скачать : Скачать изображение в высоком разрешении (657KB)
Скачать : Скачать полноразмерное изображение
Рис 3. Сравнение временных курсов нагалазы у пациентов с раком предстательной железы во время иммунотерапии с GcMAF, описанное Ямамото в 2002 г. (зарегистрировано в 1996 г.) [40] (слева; 11 пациентов) и 2008 г. [1] (справа; 16 пациентов). Оси x-y масштабированы для прямого сравнения. «Активность» нагалазы измерялась в единицах нмоль/мг/мин (слева) или нмоль/мин/мг (справа). Отметим, что измерялась не активность нагалазы, а количество белка нагалазы в сыворотке крови пациента (ИФА).
GcMAF является почти стехиометрическим активатором макрофагов
Пересчитав количество белка GcMAF в реальное количество молекул этого активатора, я пришел к выводу, что GcMAF действительно является фантастическим и высокоспецифичным активатором макрофагов. Количество 100 нг GcMAF с кажущейся молекулярной массой (Mr) 51,2 кДа в 5,5 л крови (объем крови у взрослых), дает концентрацию 0,355 пМ. Предполагая, что степень гликозилирования GalNAc при Т418 составляет до 2% (мол.моль−1) [18, 20, 31, 47], концентрация активных молекул GcMAF составляет 7,1 фМ (0,0071 пМ).
С числом Авогадро (1 моль содержит 6.0221.1023 молекул), что составляет 4.276.109 молекул активного GcMAF в одном л крови. Кровь содержит 0,15,109 до 0.6.109 моноцитов на литр, так что это даст от 7 до 29 активных молекул GcMAF на моноцит.
Даже если гликозилирование GalNAc Т418 составит всего 1% (мол.моль−1) [18, 47], на один моноцит по-прежнему приходится от 4 до 14 молекул активного GcMAF. Этот пример также демонстрирует невероятную специфичность GcMAF: от 3,5 до 7 фМ может связывать и активировать макрофаги на фоне 6 мкМ Гк, т.е. разница в девять порядков. Даже введение 30–35 нг GcMAF индуцировало заметную активацию системных макрофагов [38].
Эффект от введения GcMAF у онкологических больных быстрый; Он взаимодействует с системными макрофагами в течение примерно 30 мин [35]. Кроме того, внутримышечное введение приводило к увеличению количества системно активированных макрофагов в 40 раз за 4 дня [1], в то время как при внутривенном введении это количество увеличивалось более чем в 100 раз за 2 суток [5].
Ямамото сообщал, что эффект инъекций 500 нг у пациентов не сильно отличался от эффекта инъекций 100 нг [48]. В эксперименте in vitro было отмечено, что макрофагальное активирующее действие GcMAF заметно уменьшалось при более высоких концентрациях и даже становилось сильно ингибирующим (табл. III [14]). Этот эффект был подтвержден другими исследователями [49], [50], [51]. Результаты Ямамото я визуализировал на рисунке 4.
График зависимости активирующего эффекта от логарифма концентрации GcMAF имеет колоколообразную кривую. Мне, как биохимику, это напомнило типичную картину ингибирования субстрата в ферментативном анализе [52].
Таким образом, при высоких концентрациях GcMAF, по-видимому, может связываться во втором месте на макрофагах (слабое связывание), где он полностью ингибирует активирующий эффект связанного GcMAF в первичном сайте (сильное связывание).
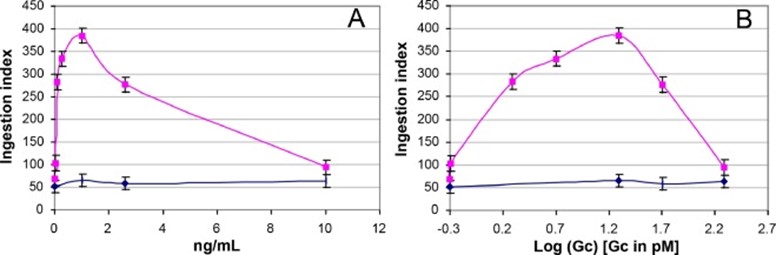
Скачать : Скачать изображение в высоком разрешении (205KB)
Скачать : Скачать полноразмерное изображение
Рис 4. Корреляция между концентрацией GcMAF и его активирующим действием на макрофаги (in vitro). Рисунок представляет собой графическое представление таблицы III из [14]. В данной работе термин «GcMAF» еще не использовался. Краткое описание эксперимента:
В-клетки селезенки мышей инкубировали с лизо-ПК (лизофосфатидилхолином) в течение 30 мин (активация В-клеток, стимулированная экспрессия внеповерхностно-связанной β-галактозидазы). Затем клетки промывали, ресуспендировали и инкубировали с различными количествами очищенного человеческого Gc в течение 2 ч (удаление Gal из Gc). В дальнейшем эту смесь использовали для культивирования необработанных (мышиных) Т-клеток в течение 2 ч (удаление СА, образование GcMAF (см. рис. 2). Полученную среду разбавляли (от 30 до 100 раз) и проверяли на фагоцитарную активность. (А) График зависимости активации макрофагов (активности приема внутрь) от количества Gc человека (нг/мл). (B) График зависимости активности проглатывания от логарифма концентрации Gc (пМ). Фиолетовые линии, Gc, обработанные В- и Т-клетками; черная линия, необработанный Gc.
Злонамеренные опухоли ускользают от иммунной системы, локально отключая воспалительную реакцию
Старые наблюдения на животных
На мой взгляд, в классическом эксперименте на животной модели 1962 г. было показано, что воспалительная реакция на инородное тело, а именно на черную хлопчатобумажную швейную нить, имплантированную в пересадочные опухоли грызунов у мышей или крыс, была незначительной по сравнению с реакцией такой нити, имплантированной в другие ткани того же животного [53] (см. раздел S5.1).
Таким образом, иммунный ответ был отключен исключительно внутри опухоли и в ее ближайшем окружении.
Объяснение Ямамото: опухоли ускользают от иммунной системы, потому что они выделяют нагалазу, которая разрушает предшественник GcMAF (но не инъекционный GcMAF)
Yamamoto et al. [29, [54], [55], [56], [57] предположили, что повышенные уровни нагалазы в сыворотке крови инактивируют все молекулы-предшественники GcMAF в крови за счет активности эндогликогидролазы. За подробностями обратитесь к Подразделу S5.2.
Однако Borges et al. [20, 31]., анализируя сыворотку крови онкологических больных с помощью масс-спектрометрии, показали, что это неверно (см. раздел S9).
Моя интерпретация деградации «предшественника» заключается скорее в том, что локально продуцируемый GcMAF В- и Т-клетками вокруг опухоли сильно инактивируется высокими уровнями экскретируемой нагалазы (экзогликогидролазной активности) внутри и вокруг опухоли. Нагалаза, содержащаяся в крови, не оказывает влияния на GcMAF, вводимый в другие части организма, по причинам, описанным в разделе S.5.2.
Требуется серия четких ферментативных экспериментов с очищенным Naga6 с использованием Gc2 и очищенного GcMAF (из рекомбинантного Gc2 с известной степенью гликозилирования на T418) в качестве субстратов. Это может дать ответы на вопросы об активности эндо- и экзогликогидролазы и об истинном Km и VМакс значения Naga6 для Gc2 и GcMAF.
Хирургическое удаление опухолей и метастазов быстро снижает уровень нагалазы и повышает уровень «предшественника» GcMAF в сыворотке крови
Ямамото продемонстрировал [56], что хирургическое удаление первичной опухоли приводило к значительному снижению уровня нагалазы в сыворотке крови в течение одного дня. В то же время «активность прекурсоров» значительно возросла. Это описано в Раздел S5.3, Рис. S9.
Таким образом, концентрация нагалазы в сыворотке крови представляет собой равновесие между скоростью выработки опухоли и метастазами и ее удалением из крови организмом. Исходя из этого, можно оценить, что концентрация нагалазы (или любого другого фактора, приводящего к инактивации локально продуцируемого GcMAF) внутри и вокруг опухоли диаметром 1 см примерно на четыре порядка выше, чем концентрация в сыворотке крови (у взрослого человека с 5,5 л крови).
Это, по-видимому, позволяет опухоли (и метастазам) разрушать локально продуцируемый GcMAF. Тем не менее, макрофаги, активированные в других частях тела инъекцией GcMAF, не будут инактивированы таким образом.
Сравнение сывороточных уровней нагалазы и традиционных онкомаркеров при иммунотерапии GcMAF
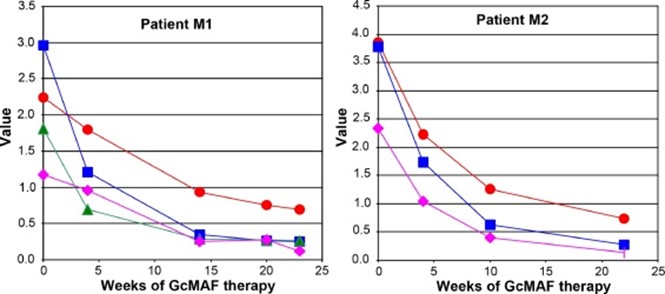
Ямамото сообщил о серии исследований, в которых уровни нагалазы и одного или нескольких традиционных маркеров рака контролировались в сыворотке крови пациентов с раком молочной железы. Пациенты получали еженедельную инъекцию 100 нг GcMAF в качестве единственного лечения [3]. Я визуализировал одну из таблиц из этой статьи на рисунке 5. Видно, что лечение привело к одновременному снижению уровня нагалазы и онкомаркеров. Это согласуется с выводом Ямамото о том, что нагалаза является мерой опухолевой нагрузки.
Скачать : Скачать изображение в высоком разрешении (239KB)
Скачать : Скачать полноразмерное изображение
Рис 5. Сывороточные уровни нагалазы (красный) и онкомаркеров рака CA 27.29 (синий), CA 15-3 (зеленый) и CEA (фиолетовый) у двух пациенток с раком молочной железы во время иммунотерапии GcMAF. На рисунке представлены данные двух из четырех пациентов, описанных в таблице III из [3]. Единицами измерения для CA 27.29 и CA 15-3 являются U/мл, а CEA — нг/мл. Для того, чтобы получить все числовые значения на одной шкале по оси Y, значения для CA 27.29 и CA 15-3 были разделены на 100, а для CEA — на 10. Единицами измерения для нагалазы были нмоль/мин/мг. Значения для здоровых лиц составляли: от 0,35 до 0,69 для нагалазы (n=6), <30 для СЕА или СА 15-3 и 37,5 для СА 27,29.
Иначе обстоит дело с раком предстательной железы. В этом случае используемым в настоящее время маркером является ПСА (простатический специфический антиген; сер-эндопептидаза калликреин-3; EC 3.4.21.77). ПСА синтезируется в эпителии предстательной железы [58, 59], но также обнаруживается в слюнных железах, головном мозге, молочной железе и других тканях, хотя и с гораздо меньшей (на два порядка) концентрацией [60].
Его концентрация в сперме человека (эякуляте) составляет 0,5-2 мг/мл [58, 61], что более чем на пять порядков выше уровня ПСА (0-4 нг/мл) в сыворотке крови здоровых мужчин. Крошечные утечки из простаты, вызванные, например, механическим давлением, инфекцией (простатитом) или доброкачественной гиперплазией простаты, могут привести к повышению уровня ПСА в сыворотке крови. В связи с этим был поставлен вопрос о том, является ли ПСА надежным маркером рака предстательной железы. Уровень ПСА 8-12 нг/мл был обнаружен у многих мужчин без каких-либо признаков рака [62, 63] (см. рис. S5 в разделе S6).
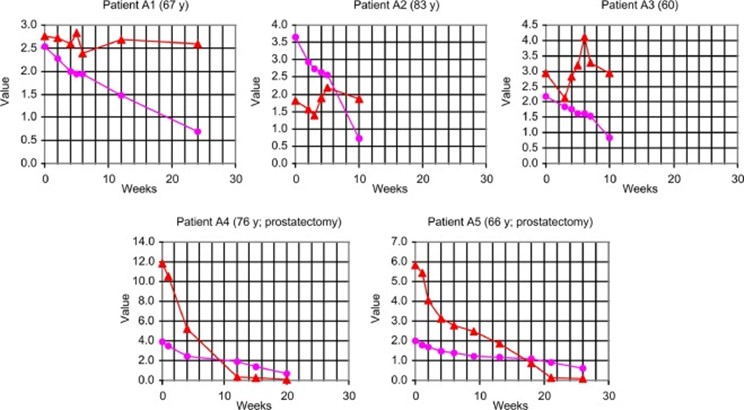
Ямамото наблюдал за уровнями нагалазы и ПСА в сыворотке крови пациентов с раком предстательной железы во время монотерапии 100 нг GcMAF в неделю (рис. 6). При удалении предстательной железы (простатэктомии) до начала терапии (рис. 6, нижние графики) уровни нагалазы и ПСА снижались, как на рис. 5.
Снижение уровня нагалазы, по-видимому, было связано с метастазами, поскольку удаление опухоли приводит к нормальному уровню в течение 24 ч [56] (см. рис. S4 в разделе S5.3).
Однако, когда предстательная железа не была удалена, уровень нагалазы, как обычно, снизился, а уровень ПСА не снизился (рис. 6, верхние графики).
По-видимому, опухолевые клетки, продуцирующие Naga6, были атакованы и удалены активированными макрофагами, но другие изменения и/или повреждения, вызванные опухолями, все еще присутствовали, и ПСА продолжал просачиваться из простаты.
Обратите внимание на высокие абсолютные усредненные уровни ПСА на рисунке 6 для пациентов без простатэктомии: для А1 26,5 нг/мл, для А2 17,8 нг/мл и для А3 61,0 нг/мл. По словам Ямамото, у последних пациентов не было никаких симптомов рака в течение как минимум 7 лет после прекращения лечения GcMAF. Это напомнило мне о том, что заметил Варбург в 1955 году [64], где он заявил: «Ebenso gehören hierher die ruhenden Krebszellen der menschlichen Prostata, die nach HAMPERL im hohen Alter in fast 100% der untersuchten Fälle gefunden werden, ohne daß sie klinisch in Erscheinung treten».
Скачать : Скачать изображение в высоком разрешении (443KB)
Скачать : Скачать полноразмерное изображение
Рис 6. Корреляция между уровнями нагалазы и ПСА в сыворотке крови пациентов с раком предстательной железы во время исследования с иммунотерапией GcMAF (100 нг 1 раз в неделю, внутримышечно) в течение 10–26 недель. На рисунке представлено графическое представление таблицы 3 из [1]. Верхние панели: уровни нагалазы (фиолетовый) и ПСА (красный) у трех пациентов без простатэктомии.
Чтобы получить все числовые значения на одной шкале по оси Y, значения PSA делили на 10 (A1 и A2) или 20 (A3). Указан возраст трех пациентов (лет). Нижние панели: уровни нагалазы и ПСА у двух пациентов с простатэктомией до начала лечения. Уровень нагалазы был в нмоль/мин/мг, а уровень ПСА в нг/мл.
Снижение уровня нагалазы у голландских онкологических больных на фоне иммунотерапии GcMAF
Я получил ряд данных от голландского врача, который пытался вылечить рак у 33 своих пациентов с помощью иммунотерапии GcMAF. Временные графики нагалазы у 8 из этих пациентов сравниваются с графиками исследований Ямамото (см. рис. S6 в разделе S7). Эти данные наглядно подтвердили эффективность терапии GcMAF Ямамото.
Сыворотка крови здоровых людей и больных раком демонстрирует явную активность Naga6
Мною показано, что сыворотка крови человека содержит четыре вида активности нага, различающихся по оптимальному рН (рН 4, 5,2, 5,8 и 8) [7, 8]. Выявлены четкие кинетические различия между активностью при рН 4 (Naga4) и остальными. Это подробно описано в Разделе S8. Мой вывод заключался в том, что активность при рН 5,8 (которую я называю Naga6) является нагалазой.
Источники нагалазы в опухолевой ткани и патогенных оболочечных вирусах по Ямамото
Как было описано выше, Ямамото доказал, что злокачественные опухоли являются источником повышенного уровня Naga6. Тем не менее, Ямамото также сообщил, что сыворотка крови пациентов с ВИЧ-1/СПИДом часто имеет повышенную активность Naga6 [65].
Кроме того, он показал, что в этом случае источник активности был скрыт (латентент) в гликопротеине оболочки gp160 вируса ВИЧ-1 (в настоящее время его часто называют спайковым белком).
Этот белок принимает непосредственное участие в прикреплении этого оболочечного вируса к клетке-мишени.
После связывания белок gp160 расщепляется (эндопротеазой фурином из клетки-мишени) на два белка: gp120 и gp41.
Последний, связываясь с мембраной вируса, тем самым вызывает слияние с мембраной клетки-мишени, что позволяет внедрить вирусный геном в клетку-мишень. Растворимый белок gp120 высвобождается в кровь пациента.
Показано, что покупной рекомбинантный белок gp160 не обладал активностью Naga6, но при обработке трипсином была обнаружена значительная активность [65]. Рекомбинантный gp120 также обладал четкой активностью нагалазы (анализируемой как экзогликогидролаза), в то время как белок gp41 — нет.
Ямамото также сообщил, что аналогичные гликопротеины оболочки (спайковые белки) различных других патогенных вирусов также имеют латентную активность нагалазы. Так, белок HA (гемагглютинин) гриппа [44], белок слияния (F) кори и краснухи (неопубликованный) несли (латентную) нагалазу в своих оболочках гликопротеинов. Их нагалазная активность может быть демаскирована протеолитическим расщеплением, например, белок НА1, отщепленный от белка ГК, проявляет активность [44, 65].
Эти результаты согласуются с первоначальными сообщениями Ямамото о том, что не существует перекрестной реакции моноклональных антител, выработанных против (очищенной) активности нагалазы у онкологических больных и пациентов, инфицированных ВИЧ-1, вирусом Эпштейна-Барр или герпесом [42]. Таким образом, активность нагалазы у больных раком и у пациентов, инфицированных различными оболочечными вирусами, обусловлена различными белками.
Pasquato et al. [66] рассмотрели механизм инфицирования различных патогенных оболочечных вирусов человека и сравнили расположение доменов нескольких вирусных гликопротеинов.
Многие из этих вирусов обладают аналогичными гликопротеинами, активными в результате слияния, которые должны быть активированы специфическими пропротеинконвертазами (Ca2+-зависимые Ser-эндопротеазы; EC 3.4.21) из ячейки-мишени. Отметим, что вирус SARS-CoV-2 (коронавирус тяжелого острого респираторного синдрома) также является оболочечным вирусом с шиповидными гликопротеинами.
Для того, чтобы найти возможный ключ к скрытой активности Naga6, я более детально сравнил аминокислотные последовательности связывающих белков (которые высвобождаются после заражения) у шести различных оболочечных вирусов (с Clustal X [67]).
Однако, в соответствии с выводами Рея и Лока [68], сходства не было абсолютно ничем. Следовательно, решение этого вопроса может быть найдено в трехмерных структурах этих связывающих белков. Я подробно изучил эту возможность, и результаты описаны в Приложении. Мой главный вывод состоит в том, что предполагаемый активный центр нагалазы может быть обнаружен в гликопротеинах ряда оболочечных вирусов.
Масс-спектрометрический анализ гликозилирования в Gc и GcMAF
Ямамото всегда описывал, что у больных раком или пациентов, инфицированных патогенными оболочечными вирусами, в сыворотке крови снижен уровень «предшественника» GcMAF. Термин «предшественник» использовался для обозначения гликозилированных форм Gc в сыворотке крови.
Было высказано предположение, но не показано, что дегликозилирование этого предшественника повышенной сывороточной активностью нагалазы у пациентов (предположительно эндогликогидролазы) приводило к несостоятельности активации макрофагов. После 2008 года это было исследовано несколькими группами (описанными в разделе S9).
Сделан вывод о том, что определяемая степень гликозилирования Gc в сыворотке крови онкологических больных не отличалась от таковой у здоровых людей.
Недавние исследования иммунотерапии GcMAF
В разделе S10 я подытожил недавний интерес к применению иммунотерапии рака с помощью GcMAF. Ямамото сообщил, что GcMAF также помогает бороться с инфекциями, вызываемыми рядом оболочечных вирусов. В настоящее время он тестируется на SARS-CoV-2, как указано в разделе S10.
Обсуждение
Вырабатывается ли нагалаза раковыми клетками, опухоль-ассоциированными макрофагами (ТАМ) или и тем, и другим?
Исследования Ямамото не оставляют сомнений в том, что источником нагалазы являются злокачественные опухоли. В то же время установлено, что возникающие опухоли часто рекрутируют иммунные клетки, а солидные злокачественные опухоли могут состоять из приобретенных иммунных клеток до 50% своей массы.
Большинство этих рекрутируемых иммунных клеток являются макрофагами. В 2002 году Ямамото опубликовал статью о том, что у носителей опухолей GcMAF активирует опухолеобразные макрофаги.
Кроме того, были представлены результаты, свидетельствующие о том, что GcMAF может также ингибировать ангиогенез, индуцированный эндотелиальными клетками. Далее предполагалось, что опухоль-ассоциированные макрофаги (ТАМ) могут индуцировать ангиогенез [69].
В настоящее время предполагается, что профиль экспрессии TAMs был изменен раковыми клетками таким образом, что они помогают опухоли расти и способствуют ангиогенезу. Кроме того, они индуцируют секрецию веществ (а/о цитокинов), которые инактивируют иммунную систему в непосредственной близости от опухоли. На мой взгляд, это также является причиной инактивации локально продуцируемого GcMAF В- и Т-клетками.
В настоящее время опухолецидные макрофаги называются М1-подобными макрофагами, а ТАМ также называются М2-подобными макрофагами [70], [71], [72], [73]. Свойства макрофагов (например, профиль экспрессии, транскриптосомы) могут быть очень разнообразными и представлять собой континуум многих типов макрофагов, начиная от М1 (противоопухолевый) и заканчивая М2 (проопухолевым) макрофагами.
Эта пластичность в основном исследовалась в экспериментах in vitro. Различные белки могут определить, превращаются ли моноциты в макрофаги типа М1 или М2. In vitro липополисахариды (ЛПС) плюс интерферон-гамма (ИФНγ) могут превращать моноциты в макрофаги типа М1, тогда как интерлейкин-4 или интерлейкин-13 могут превращать их в М2-подобные.
Кроме того, макрофагальные колониестимулирующие факторы (СМЖ) могут превращать моноциты в макрофаги М1-типа (СМФ-2) или М2-типа (СМФ-1), см., например, [72, 74]. Пластичность макрофагов при заживлении ран хорошо известна (см., например, [75]) и уже давно сравнивается с их действием в опухолях [76].
Это приводит к вопросу о том, является ли повышенный уровень Naga6 в сыворотке крови, о котором сообщил Ямамото для широкого круга онкологических больных, результатом секреции раковыми клетками, рекрутированными иммунными клетками или и тем, и другим.
Более глубокое понимание этих вопросов, возможно, может быть получено путем изучения профилей секреции (с акцентом на Naga4 и Naga6) линий раковых клеток и М2-подобных макрофагов.
Следует, однако, помнить, что свойства макрофагов, полученных из моноцитов в исследованиях in vitro, могут отличаться от одного эксперимента к другому. Кроме того, сообщалось, что знания, полученные в ходе этих экспериментов in vitro, могут значительно отличаться от таковых в экспериментах in vivo [77].
Я предлагаю проводить гистохимические эксперименты с опухолевыми купе с использованием X-GalNAc (X, 5-бром-4-хлор-3-индоксила) при рН 5,8. Это может дать более подробную информацию о точных участках активности Naga6 в различных опухолевых клетках. Этот метод был введен давно [78] и широко использовался для локализации участков ферментов, таких как гликозидазы, эстеразы или фосфатазы, в клетках и вирусах [79].
Мой тезис: нагалаза (Naga6) – это Naga4 с измененным N-гликозилированием
Ямамото никогда не раскрывал свойства очищенного препарата нагалазы из ткани рака легкого, который он использовал для получения моноклональных антител. Он, должно быть, использовал SDS-PAGE, чтобы следовать процедуре очистки, поэтому Mr Нагаласе был ему известен. То же самое относится и к нагалазам, выделенным из сыворотки крови пациентов, инфицированных патогенными оболочечными вирусами. В разделе S11 я представил данные, которые привели меня к тезису о том, что Naga6 может быть просто ферментом Naga4 с аберрантным N-гликозилированием, которое влияет на некоторые из его основных свойств, а также на его экскрецию. Анализ последовательности и гликозилирования очищенного фермента Naga6 может решить этот вопрос.
Иммунотерапия с помощью GcMAF, на мой взгляд, превосходит любой другой иммунопрепарат для начинающих раковых заболеваний
В современной литературе термин «иммунотерапия» (или биологическая терапия) для общего лечения рака включает ингибиторы контрольных точек иммунного ответа, терапию иммунными клетками, терапевтические антитела и вакцины, а также иммуномодулирующие агенты (например, бациллу Кальметта-Герена, БЦЖ) [80], [81], [82]. Почти все эти методы лечения имеют потенциально серьезные побочные эффекты. В 2020 году мРНК-вакцины против вируса SARS-CoV-2 открыли новую главу в иммунотерапии человека. На животных имеется больший опыт применения метода мРНК [83]. При применении на людях еще предстоит выяснить, возможны ли краткосрочные и/или долгосрочные побочные эффекты. Иммунотерапия GcMAF не имеет каких-либо побочных эффектов [4, 80]. Он также рассматривается для борьбы с SARS-CoV-2 [84] и уже изучается с участием 97 пациентов в Италии и 600 пациентов в Украине (www.clinicaltrials.gov; NCT04845971 и NCT04762628 соответственно).
В последнее десятилетие было доказано существование раковых стволовых клеток (ОСК) [85], [86], [87]. Это может объяснить, почему после традиционной терапии рака часто наблюдается рецидив: КСК обладают способностью инициировать рост опухоли заново. Результаты Ямамото (особенно те, о которых сообщается в отозванных статьях за 2008-2009 гг.) убедительно свидетельствуют о том, что иммунная система, стимулированная GcMAF, может быть способна удалять также последние остаточные раковые стволовые клетки.
Заключительные замечания
(a) Необходимо четко проверить, может ли повышенный уровень нагалазы у онкологических больных, определенный Ямамото с помощью косвенного, но чувствительного и специфического количественного определения белка (ИФА), также быть обнаружен с помощью прямых измерений активности, например, методом, описанным в 2017 г. [7, 8]. Это может быть выполнено только с пациентами до начала любого лечения или у пациентов, у которых все лечение было прекращено по крайней мере на 4 недели.
Прямое измерение активности может быть использовано без разбора, т.е. для онкологических больных или для пациентов, инфицированных различными патогенными вирусами оболочки (ВИЧ-1, грипп, краснуха, корь и, возможно, SARS-CoV-2). Для метода ИФА моноклональные антитела против очищенной активности Naga6 каждого отдельного типа заболевания должны быть получены методом гибридомы.
(b) Если (а) верен, то целесообразно регулярно (каждые 6-12 месяцев) определять сывороточную активность Naga6 взрослых людей прямым методом. Повышенный уровень Naga6, особенно у пожилых людей, указывает на появление нежелательных новообразований, которые пытаются ускользнуть от иммунной системы, а также на инфекции, вызванные патогенными вирусами оболочки. Иммунотерапия GcMAF напрямую активирует системные макрофаги, которые будут атаковать нежелательные источники повышенного уровня нагалазы без разбора. Кроме того, такие активированные макрофаги могут разрушать раковые стволовые клетки.
(c) Активность МАФ GcMAF зависит от присутствия в Gc одного остатка GalNAc, присоединенного к T418. Когда Gc продуцируется рекомбинантными методами в E. coli, полученный белок Gc не может быть преобразован в активный GcMAF [88], поскольку E. coli не может гликосилировать белки. Экспрессия в организме хозяина, который может осуществлять гликозилирование клонированного Gc, например, в клетках насекомых, дрожжах Pichia pastoris или эмбриональных клетках почек человека, может привести к образованию гликозилированного белка Gc, который может быть успешно преобразован в GcMAF. Еще лучше была бы экспрессия Gc2 в клетках ExpiCHO-S, способных непосредственно продуцировать GcMAF [89]. Жизненно важно определить процент и тип гликозилирования на Т418, чтобы спрогнозировать ожидаемую активность MAF продукта. До сих пор это никогда не упоминалось ни в одном из исследований Ямамото или других исследований, за исключением, может быть, Борхеса и Редера для купленного препарата GcMAF [32].
(d) Также бычий Gc может быть преобразован в GcMAF, который может активировать макрофаги человека [15]. Этот белок менее пригоден для инъекций людям, но он применяется при пероральном приеме для (косвенной) стимуляции иммунной системы путем прямого воздействия на тканевые резидентные макрофаги, например, полости рта (миндалинное кольцо Вальдейера) или участки Пейерса в желудочно-интерстициальном тракте (кишечная лимфоидная ткань). В форме спрея он может активировать резидентные макрофаги в легких (бронхоассоциированная лимфоидная ткань) [90]. Стоит попробовать, может ли спрей с бычьим GcMAF помочь в борьбе с заражением вирусом SARS-CoV-2. Есть надежда, что правительственные департаменты здравоохранения в скором времени разрешат продажу пероральных GcMAF в аптеках в качестве обычного питательного вещества для оптимальной иммунной функции, как и витамины C и D3.
(e) Белки МАФ, столь же активные, как и GcMAF, также могут быть получены в виде рекомбинантного полипептида, содержащего С-концевые 80 аминокислот Gc (и даже С-концевые 40 аминокислот). Такие пептиды не содержат доменов Gc, которые отвечают за связывание актина, витамина D или жирных кислот [ 36 , 37 ].
(f) Пациенты (раковые и нераковые) с повышенным уровнем Naga6 в плазме крови часто имеют низкие уровни аскорбата (витамина С) и кальцидиола (25(OH)D3, витамин D3). Оптимальная работа иммунных клеток зависит от достаточного уровня аскорбата и кальцидиола в плазме крови. Фактически, я предположил, что влияние этих двух соединений на иммунные клетки взаимозависимо (Albracht, S.P.J. (2021) Гипотеза: взаимная зависимость аскорбата и кальцидиола для оптимальной работы иммунной системы, Медицинская гипотеза, на рассмотрении). Следовательно, во время иммунотерапии GcMAF необходимо принимать достаточное количество аскорбиновой кислоты и кальцидиола для поддержания уровня аскорбата в плазме крови на уровне 70–80 мкМ (прием 200–500 мг в день) и 80–200 нМ кальцидиола (прием 50–70 мкг в день).
(h) Иммунотерапия GcMAF может помочь онкологическим больным, у которых традиционные методы лечения рака оказались неэффективными. Тем не менее, их иммунная система должна быть неповрежденной; GcMAF не будет эффективен у пациентов с анемией. Кроме того, поскольку иммунная система имеет лишь ограниченные возможности для удаления злокачественных опухолей, основная опухолевая масса должна быть сначала удалена хирургическим путем и/или уничтожена γ-облучением. Любое химиотерапевтическое лечение должно быть завершено не менее 4 недель, чтобы обеспечить достаточное восстановление иммунной системы.
(i) В большинстве случаев разрушение органов, вызванное злокачественными опухолями, не может быть излечено иммунотерапией GcMAF. Поэтому появление любых нежелательных злокачественных новообразований, обнаруживаемых по повышенному сывороточному уровню Naga6 (или иным образом), должно быть немедленно вылечено иммунотерапией GcMAF в сочетании с аскорбатом и кальцидиолом. Основываясь на литературе и собственном опыте, я полагаю, что повышенный уровень Naga6, независимо от причины, практически всегда будет снижаться при таком лечении.
Финансирование
Это исследование не получило какого-либо специального гранта от финансирующих организаций в государственном, коммерческом или некоммерческом секторах.
Заявление о вкладе авторов
S.P.J. Albracht является единственным автором
Декларация о конкурирующих интересах
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье
Благодарности
Я хочу почтить память покойного Петера ван Дейка, который был одной из движущих сил на начальных этапах моих исследований. Я выражаю особую благодарность Стивену У. Хофману (Steven W. Hofman, m.D.) за предоставление данных для рис. S6 за его постоянный интерес, энтузиазм и многочисленные стимулирующие дискуссии.
