Anticancer Research August 2014, 34 (8) 4589-4593;
Toshio Inui , Kaori Makita , Hirona Miura , Akiko Matsuda , Daisuke Kuchiike, Kentaro Kubo , Martin Mette , Yoshihiro Uto , Takahito Nishikata , Hitoshi Hori , Norihiro Sakamoto
Case Report: A Breast Cancer Patient Treated with GcMAF, Sonodynamic Therapy and Hormone Therapy.
Отчет о клиническом случае: пациентка с раком молочной железы, получавшая лечение GcMAF, сонодинамической терапией и гормональной терапией.
Фактор активации макрофагов, полученный из белка Gc (GcMAF), естественным образом встречается в организме человека. Он выполняет различные функции, такие как активация макрофагов и противоопухолевая активность.
В последнее время иммунотерапия стала новой привлекательной стратегией лечения рака. Иммунотерапию на основе GcMAF можно комбинировать со многими другими методами лечения.
Сонодинамическая терапия (СДТ) с использованием ультразвука низкой интенсивности является новым терапевтическим методом.
Было продемонстрировано, что ультразвук активирует ряд звукочувствительных агентов, что дает возможность неинвазивного таргетного лечения как поверхностных, так и глубоко расположенных опухолей.
Текущее тематическое исследование показывает, что GcMAF и SDT можно использовать в сочетании с традиционными методами лечения у пациентов с метастатическим раком, особенно там, где варианты лечения ограничены из-за таких факторов, как токсичность.
В этом тематическом исследовании также предлагается новая концепция лечения рака с использованием локальной деструкции раковой ткани, в данном случае проводимой с помощью SDT, которая будет использоваться в сочетании с иммунотерапией GcMAF в качестве системного лечения.
Иммунотерапия стала новой привлекательной стратегией лечения рака, отчасти благодаря минимальной токсичности и превосходному профилю безопасности по сравнению с традиционными методами лечения, такими как химиотерапия и лучевая терапия.
Фактор активации макрофагов, полученный из белка Gc (GcMAF).
Макрофаги являются важными фагоцитирующими клетками, которые усваивают и уничтожают патогены и выделяют цитокины. Кроме того, известно, что макрофаги играют решающую роль в противоопухолевом иммунитете. Они могут проникать в опухоли и обнаруживаются в большинстве локализаций опухолей.
GcMAF был впервые разработан доктором Нобуто Ямамото в 1991 году (1 ) , что позволяет предположить, что его можно использовать в качестве важной иммунотерапии для лечения рака ( 2-7 ).
В предыдущих исследованиях белок Gc (подтип 1f1f) выделяли из сыворотки человека с использованием аффинной колонки, модифицированной 25-гидроксивитамином D 3 . Затем GcMAF был получен из этого выделенного белка Gc искусственным ферментативным методом ( 8 ).
Процесс отделения белка Gc от сыворотки приводит к гораздо более низкой концентрации, стабильности и активности образующегося конечного GcMAF. Кроме того, следует избегать повторного использования аффинной колонки из-за перекрестного загрязнения различных образцов сыворотки.
Чтобы преодолеть проблемы, связанные с выделением белка Gc из сыворотки при производстве GcMAF, мы подготовили дегалактозилированную/десиалилированную человеческую сыворотку, которую мы назвали сывороточным GcMAF или GcMAF второго поколения. GcMAF второго поколения имеет более высокую концентрацию (1500 нг/0,5 мл) и более длительную стабильность благодаря этому новому производственному процессу, демонстрируя, что аффинная колонка с 25-OH витамином D не является необходимой (таблица I).
Сайсей Мирай разработал GcMAF второго поколения в 2011 году в сотрудничестве с доктором Хитоши Хори и доктором Ёсихиро Уто из Университета Токусима ( 9 ).
Помимо более высокой концентрации и стабильности, он обладает несколькими другими важными свойствами, которые включают повышение фагоцитарной активности макрофагов ( 10 ), генерацию супероксидных радикалов ( 11 ), антиангиогенные эффекты ( 12 ) и противоопухолевые эффекты ( 13 ). Увеличение количества моноцитов и процентного содержания моноцитов в крови наблюдалось у многих пациентов во время терапии GcMAF.
Кроме того, было показано, что сывороточный GcMAF увеличивает созревание дендритных клеток in vitro (неопубликованные данные). К марту 2014 года Saisei Mirai вылечит более 1000 пациентов с GcMAF, как с традиционными методами лечения, так и без них, доказав свою безопасность в качестве терапии.

Таблица I.
Сравнение фактора активации макрофагов, полученного из белка Gc первого и второго поколения.
Сонодинамическая терапия (СДТ). Постоянно растет количество данных, показывающих, что SDT, то есть использование ультразвука низкой интенсивности с соносенсибилизатором, может использоваться для производства свободнорадикального кислорода ( 14 ) для избирательного разрушения раковых клеток ( 15 , 16 , 17 ).
Концепция СДТ заключается во введении в организм вещества, которое преимущественно накапливается в раковых клетках ( 15 ).
Затем это вещество активируется ультразвуковой вибрацией вместо световой стимуляции, в отличие от традиционной фотодинамической терапии с использованием светоактивируемого сенсибилизатора.
Поскольку ультразвук способен полностью проходить через тело, становится возможной концепция уничтожения раковых клеток без использования повреждающих инвазивных процедур.
Он также обладает способностью уничтожать метастазы в большинстве мест тела, что делает его очень универсальной и важной терапией. СДТ считается новым многообещающим методом лечения рака, не вызывающим серьезных побочных эффектов. В ряде стран мира разрабатываются многочисленные сенсибилизаторы с различными свойствами. Недавно в Японии были разработаны новые соносенсибилизаторы, которые реагируют только на ультразвук ( 14 ). Это позволяет проводить лечение пациентов без светотоксичности, которая может сохраняться при воздействии естественного солнечного света, пока сенсибилизатор остается в организме.
Озоновая аутогемотерапия и гипербарическая оксигенация.
Опухолевая гипоксия, при которой опухоль лишается адекватного снабжения кислородом, является общепризнанным фактором устойчивости лечения рака к химиотерапии и лучевой терапии, а также к СДТ, для эффективности которой требуется выработка бескислородных радикалов (15 ) .
Следовательно, любой метод увеличения снабжения кислородом опухолевой среды должен повысить эффективность СДТ (15).
Озонотерапия – это медицинский метод лечения, который используется для увеличения количества кислорода в крови. Это достигается за счет озонирования собственной крови пациента вне тела и введения ее обратно в организм за относительно короткий промежуток времени.
Гипербарическая кислородная терапия — это медицинское использование кислорода в концентрациях, превышающих атмосферное давление. Оборудование, используемое для гипербарической оксигенации, состоит из барокамеры и средств подачи чистого кислорода.
В клинических ситуациях СДТ обычно комбинируют с озоновой аутогемотерапией для уменьшения местной гипоксии в опухолевой среде.
История болезни
У 55-летней женщины в августе 2009 года был диагностирован рак молочной железы (левой стороны, с инвазией в кожу). Лечение проводилось методом лампэктомии без химиотерапии и лучевой терапии.
От дальнейшего стандартного лечения после операции она отказалась. Опухоль была положительной к эстрогену (ER), прогестерону (PR) и рецептору герцептина (HER2). В октябре 2011 года у нее обнаружили опухоль правой подмышечной впадины. Никакого лечения на тот момент не проводилось.
Опухоль продолжала расти, а маркеры опухоли увеличивались. В июле 2012 года была проведена пункционная биопсия для подтверждения рецидива опухоли. Пациент по-прежнему отказался от стандартного лечения и перенес гипертермию (всего 24 раза с помощью Thermotron RF-8) и внутривенное введение высоких доз витамина С (всего 10 раз).
Она обратилась в нашу клинику в январе 2013 г. Симптомами при обращении были кашель, боль в спине и сильный отек правой руки (отек), а патологические данные: инвазивная протоковая карцинома, N0 (узлы не были вовлечены), отрицательный хирургический край. , 3 степень, ЭР+, ПР+, HER2+. Позитронно-эмиссионная томография и компьютерная томография (ПЭТ-КТ) грудной клетки 6 июня 2013 г. ( рис. 1 ) выявили опухоль правой подмышечной впадины, метастазы в позвоночник, внутриплевральную узловую опухоль и правый плевральный выпот.
Высокие дозы GcMAF второго поколения вводились по 0,5 мл два раза в неделю внутримышечно, всего 21 раз. Сенсибилизаторы для СДТ были модифицированы хлорином е6 в дозе 25 мг внутривенно и 5-аминолевулиновой кислотой в дозе 10 мг/кг перорально. Всего с июня по сентябрь 2013 года было проведено 19 курсов СДТ. Также пациенту назначался ингибитор ароматазы экземестан (Аромазин) в дозе 25 мг/сут перорально.
К началу октября 2013 года у пациента наблюдалось резкое улучшение таких симптомов, как кашель, боль в спине и отек правой руки, благодаря комбинированной терапии с SDT, GcMAF и гормональной терапией. Ее подмышечная опухоль (рис. 1А) уменьшилась в размерах и полностью исчезла.
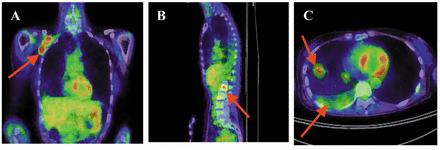
Рисунок 1.
Томография грудной клетки 55-летней пациентки 6 июня 2013 г.: опухоль правой подмышечной впадины (А), метастазы в позвоночник (В), внутриплевральная узловая опухоль и правый плевральный выпот (С).
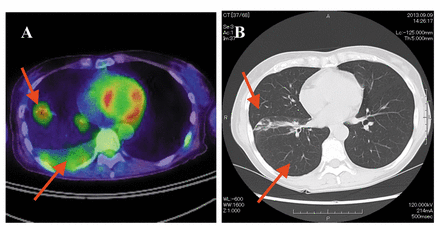
Рисунок 2.
A: Позитронно-эмиссионная томография грудной клетки и компьютерная томография (ПЭТ-КТ) в горизонтальной плоскости 55-летней пациентки, 6 июня 2013 г., демонстрирующая плевральный выпот в легких и внутриплевральную узловую опухоль до лечения сонодинамической терапией SDT. B: КТ грудной клетки в горизонтальной плоскости от 9 сентября 2013 г., показывающая полное исчезновение плеврального выпота в легких и узловой тени в правом легком после лечения СДТ и гормональной терапии.
ПЭТ-КТ грудной клетки 6 июня 2013 г. (рис. 2А) показала плевральный выпот в легких и внутриплевральную узловую опухоль до лечения СДТ. Более поздняя КТ грудной клетки, проведенная 9 сентября 2013 г. (рис. 2B ), показала полное исчезновение плеврального выпота и внутриплевральной узловой опухоли в правом легком после лечения SDT, GcMAF и гормональной терапии.
В период лечения с января 2013 года по октябрь 2013 года наблюдалось значительное увеличение процентного содержания моноцитов и количества моноцитов (Рисунок 3) и быстрое снижение онкомаркеров (Рисунок 4). Серьезных побочных эффектов от лечения не наблюдалось, за исключением незначительного поражения суставов. боль от гормональной терапии ингибитором ароматазы экземестаном.
Обсуждение
Рак — это обширная группа заболеваний, сопровождающихся дерегулированным ростом клеток, образующими злокачественные опухоли, которые проникают в близлежащие части тела и могут метастазировать и распространяться в более отдаленные части. Поэтому важно уничтожить местную раковую ткань, используя методы лечения с минимальными побочными эффектами, в то же время стимулируя иммунную систему и позволяя антигенпрезентирующим клеткам отображать опухолеассоциированные антигены Т-хелперам.
Эта базовая концепция распознавания опухолеассоциированных антигенов и обучения иммунной системы атаковать раковые клетки внутри организма очень похожа на идею противораковой вакцины, хотя сама противораковая вакцина всегда создается вне организма. Иммунотерапия представляет собой как местную, так и системную терапию, которую можно использовать в сочетании с местной деструкцией опухоли при большой опухолевой нагрузке.
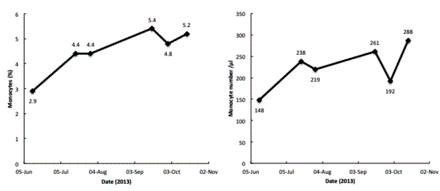
Рисунок 3.
Изменение процентного содержания моноцитов в крови и количества моноцитов у 55-летней пациентки во время терапии фактором активации макрофагов, полученным из белка Gc (GcMAF). Число моноцитов у пациента возросло во время лечения высокими дозами GcMAF, что указывает на хороший ответ на терапию.
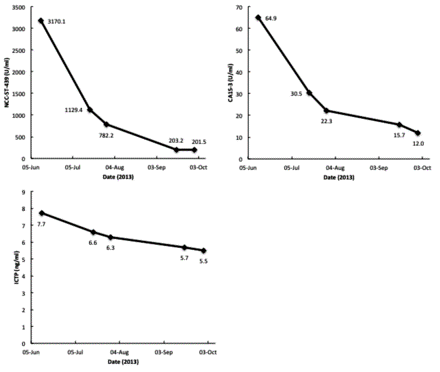
Рисунок 4.
Динамика опухолевых маркеров, Национального онкологического центра желудка-439 (NCC-ST-439), углеводного антигена 15-3 (CA15-3) и карбокси-концевого телопептида коллагена I типа (ICTP). В течение периода лечения у пациента быстро снизились опухолевые маркеры.
Мы выделяем этот случай пациентки с терминальной стадией рака молочной железы, у которой наблюдался хороший эффект от SDT, GcMAF и гормональной терапии.
Это предполагает, что SDT и GcMAF можно использовать в сочетании со стандартными методами лечения, в частности таргетной терапией, с минимальной токсичностью и без негативного воздействия на иммунную систему, для достижения лучших результатов для пациентов с раком. SDT, GcMAF и гормональная терапия — это неинвазивные, хорошо переносимые методы лечения, которые могут контролировать прогрессирование опухоли, действуя синергически.
Кроме того, SDT и GcMAF могут контролировать прогрессирование опухоли, индуцируя прямой воспалительный некроз внутри опухоли, создавая противоопухолевый иммунитет через антигенпрезентирующие клетки, чтобы предотвратить ускользание иммунного ответа в различных глубоких и поверхностных опухолях.
Использование этих новых подходов дает тем из нас, кто лечит рак, хорошее оружие, которое убивает раковые клетки избирательно, эффективно, нетоксичными и безболезненными способами. Мы планируем и дальше дорабатывать и улучшать наши протоколы с помощью SDT и GcMAF.
Сноски
Эта статья находится в свободном доступе в Интернете.
Поступила 4 апреля 2014 г.
Доработка получена 12 июня 2014 г.
Принято 13 июня 2014 г.
Copyright© 2014 Международный институт противораковых исследований (д-р Джон Г. Делинассиос), Все права защищены.
Рекомендации:
Ямамото Н. Хомма С.
Витамин D3 связывающий белок (группоспецифический компонент) является предшественником сигнального фактора активации макрофагов из лимфоцитов, обработанных лизофосфатидилхолином . Proc Natl Acad Sci USA 88: 8539-8543 ,
Ямамото Н. Суяма Х. Ямамото Н. Ушидзима Н.
Иммунотерапия метастатического рака молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF) . Int J Cancer 122: 461–467 , 2008 .
Пачини С. Пунци Т. Моруччи Г. Гулисано М. Руджеро М.
Влияние фактора активации макрофагов, связывающего витамин D, на клетки рака молочной железы человека . Anticancer Res 32: 45–52 , 2012 .
Аннотация / БЕСПЛАТНО полный текст Google Scholar
Ямамото Н. Суяма Х. Ямамото Н.
Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc, GcMAF . Перевод Онкол 1: 65–72 , 2008 .
Перекрестная ссылкаПабМедGoogle Scholar
Ямамото Н. Суяма Х. Наказато Х. Ямамото Н. Кога Ю.
Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF . Рак Иммунол Иммунотер 57: 1007–1016 , 2008 .
Перекрестная ссылка ПабМедGoogle Scholar
Ямамото Н.Ушиджима Н.Кога Ю.
Иммунотерапия ВИЧ-инфицированных пациентов с помощью фактора активации макрофагов, полученного из белка Gc (GcMAF) . J Med Virol 81: 16–21 , 2009 .
Ямамото Н Нарапараджу В.Р. Шринивасула С.М.
Структурная модификация сывороточного витамина D3 — связывающего белка и иммуносупрессия у больных СПИДом. СПИД Res Hum Retroviruses 11: 1373-1378 , 1995 .
Ямамото Н. Кумасиро Р.
Преобразование витамина D3 — связывающего белка (группоспецифического компонента) в фактор активации макрофагов путем поэтапного действия бета-галактозидазы В-клеток и сиалидазы Т-клеток . J Immunol 151: 2794-2802 , 1993 .
Уто Ю. Хори Х. Кубо К. Ичихаши М. Сакамото Н. Метте М. Инуи Т.
GcMAF: наша иммунотерапия нового поколения. Природа 485: S67 — S70 , 2012 .
Кучиике Д. Уто Ю. Мукай Х. Исияма Н. Эйб С. Танака Д. Каваи Т. Кубо К .Метте М. Инуи Т. Эндо Ю. Хори Х.
Дегалактозилированная/десиалилированная человеческая сыворотка, содержащая GcMAF, индуцирует фагоцитарную активность макрофагов и противоопухолевую активность in vivo . Anticancer Res 33: 2881-2885 , 2013 .
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar
Мохамад С.Б. Нагасава Х. Уто Ю. Хори Х.
Получение фактора активации макрофагов, полученного из белка Gc (GcMAF), его структурная характеристика и биологическая активность . Anticancer Res 22: 4297-4300 , 2002 . _
Кискер О. Онидзука С. Беккер С.М. Фэннон М. Флинн Э.Д’Амато Р.Зеттер Б. Фолкман Дж.
Рэй Р.Свами Н. Пири-Шеперд С.
Фактор активации белка-макрофагов, связывающий витамин D (DBP-maf), ингибирует ангиогенез и рост опухолей у мышей. Неоплазия 5: 32–40 , 2003 . _ _
Перекрестная ссылка ПабМедGoogle Scholar
Инуи Т. Кучиике Д.Кубо К. Метте М. Уто Ю. Хори Х.Сакамото Н.
Клинический опыт интегративной иммунотерапии рака с использованием GcMAF . Anticancer Res 33: 2917-2919 , 2013 . _
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar
Куроки М. Хачимин К. Эйб Х. Шибагути Х. Куроки М. Маэкава С. Янагисава Дж. Кинугаса Т.Танака Т. Ямашита Ю.
Сонодинамическая терапия рака с использованием новых соносенсибилизаторов . Anticancer Res 27: 3673-3678 , 2007 . _
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar
Кеньон Дж. Фуллер Р.
Показатели результатов после сонодинамической фотодинамической терапии: серия случаев . Современная лекарственная терапия 6: 12–16 , 2011 .
Хуан Цзы.
Обзор прогресса в клинической фотодинамике . Ther Technol Cancer Res Treat 4: 283–293 , 2005 .
Робертс В.Г. Хасан Т.
Секретируемый опухолью фактор сосудистой проницаемости/фактор роста эндотелия сосудов влияет на поглощение фотосенсибилизатора. Рак Res 53: 153-157 , 1993 .
