Anticancer Research July 2014, 34 (7) 3569-3578;
Marco Ruggiero, Emma Ward, Rodney Smith, Jacopo J V Branca, David Noakes, Gabriele Morucci, Margit Taubmann, Lynda Thyer, Stefania Pacini
Oleic Acid, Deglycosylated Vitamin D-Binding Protein, Nitric Oxide: A Molecular Triad Made Lethal to Cancer
Олеиновая кислота, дегликозилированный белок, связывающий витамин D, оксид азота: молекулярная триада, смертельная для рака
В ведущем журнале о раке AntiCancer Research:
Результаты применения Goleic в одной из клиник:
Oleic Acid, Deglycosylated Vitamin D-Binding Protein, Nitric Oxide: A Molecular Triad Made Lethal to Cancer
(Олеиновая кислота, дегликозилированный витамин D-связывающий белок, оксид азота: Молекулярная триада, смертельная для рака)
Было показано, что олеиновая кислота (ОК) обладает противораковыми свойствами, опосредованными взаимодействием с такими белками, как α-лактальбумин и лактоферрины.
Поэтому мы синтезировали комплексы ОА и Gc-протеинового фактора активации макрофагов (GcMAF), которые подавляют пролиферацию раковых клеток per se и метастатический потенциал.
Мы предположили, что комплексы OA-GcMAF могут использовать противораковые свойства как OA, так и GcMAF в синергетической манере.
Мы предположили, что стимулирующее действие GcMAF на макрофаги может привести к высвобождению оксида азота (NO).
Пациенты и методы:
Пациенты с последней стадией рака проходили лечение в центре лечения Immuno Biotech с помощью интегративной иммунотерапии на основе OA и GcMAF в сочетании с низкоуглеводной, высокобелковой диетой, кисломолочными продуктами, содержащими GcMAF естественного происхождения, витамином D3, омега-3 жирными кислотами и ацетилсалициловой кислотой в низких дозах.
Результаты:
При измерении опухоли с помощью ультрасонографических методов мы наблюдали уменьшение объема опухоли примерно на 25%. Заключение: Эти наблюдения показывают, что OA, GcMAF и NO могут быть правильно скомбинированы и целенаправленно доставлены пациентам с раком на поздних стадиях, оказывая значительное влияние на стимуляцию иммунной системы и уменьшение объема опухоли без вредных побочных эффектов.
Было показано, что олеиновая кислота (ОА) обладает противораковыми свойствами, опосредованными взаимодействием с белками, такими как α-лактальбумин и лактоферрины.
Поэтому мы синтезировали комплексы ОА и фактора активации макрофагов, полученного из белка Gc (GcMAF), который сам по себе ингибирует пролиферацию раковых клеток и их метастатический потенциал.
Мы предположили, что комплексы OA-GcMAF могут синергически использовать противораковые свойства как OA, так и GcMAF.
Мы предположили, что стимулирующее воздействие GcMAF на макрофаги может приводить к высвобождению оксида азота (NO).
Пациенты и методы:
Пациенты с распространенным раком проходили лечение в Центре лечения иммунобиотехнологий с помощью интегративной иммунотерапии на основе OA-GcMAF в сочетании с низкоуглеводной, высокобелковой диетой, кисломолочными продуктами, содержащими природный GcMAF, витамин D3, омега-кислоты. -3 жирные кислоты и низкие дозы ацетилсалициловой кислоты.
Результаты:
Измеряя опухоль ультразвуковыми методами, мы наблюдали уменьшение объема опухоли примерно на 25%.
Заключение:
Эти наблюдения показывают, что ОА, GcMAF и NO можно правильно комбинировать и целенаправленно доставлять больным раком на поздних стадиях, оказывая значительное влияние на стимуляцию иммунной системы и уменьшение объема опухоли, избегая вредных побочных эффектов.
Хорошо известно, что олеиновая кислота (ОА), признанный фундаментальный компонент здорового питания ( 1 ), проявляет противораковые свойства ( 2 ), которые способствуют увеличению продолжительности жизни и снижению риска смертности и заболеваемости, связанных с ее потреблением ( 1 ). . Хотя точный молекулярный механизм, ответственный за его противораковые свойства, до конца не понятен ( 2 ), похоже, что ОА участвует во внутриклеточной передаче сигналов кальция, связанной с индукцией апоптоза раковых клеток.
Было высказано предположение, что противораковые эффекты ОА опосредованы его взаимодействием с белками, широко представленными в биологических жидкостях, такими как α-лактальбумин и лактоферрины.
Эти белки связывают ОА с образованием комплексов ОА-белок, которые проявляют высокоселективную противоопухолевую активность in vitro и in vivo ( 3 ). Вскоре после их идентификации эти комплексы были названы HAMLET — аббревиатурой, означающей «человеческий α-лактальбумин, смертельный для опухолевых клеток», хотя дальнейшие исследования показали, что α-лактальбумин не является единственным белком, образующим такие комплексы.
Таким образом, другие белки, образующие комплексы с ОА, проявляют идентичные противораковые свойства ( 4 ). В настоящее время признано, что эти комплексы ОА-белок уничтожают опухолевые клетки с высокой селективностью и без признаков токсичности для нормальных тканей, что является ключевым моментом в поиске противораковых методов лечения, лишенных токсических побочных эффектов.
Изучение структурных характеристик таких противораковых комплексов ОА-белок показало, что общей молекулярной особенностью является склонность к ОА-индуцированной белковой олигомеризации. Поскольку ОА-индуцированная олигомеризация была обнаружена для ряда белков в дополнение к тем, которые были первоначально идентифицированы в HAMLET, было высказано предположение, что это явление может быть присуще многим белкам ( 5 ).
Некоторые из белков, образующих противораковые комплексы ОА-белок, такие как α-лактальбумин и лактоферрины, широко представлены в молоке. Известно, что эти соединения оказывают мощное стимулирующее воздействие на иммунную систему ( 6 ). Эти данные обеспечивают дополнительное подтверждение гипотезы о том, что иммунная система непосредственно участвует в общем противораковом эффекте комплексов ОА-белок.
Помимо α-лактальбумина и лактоферринов, еще одним иммуностимулирующим белком, широко представленным в молоке, а также в молозиве и крови, является белок, связывающий витамин D.
Это предшественник очень мощного фактора активации макрофагов, который возникает в результате его селективного дегликозилирования.
Поскольку белок, связывающий витамин D, также называют Gc-глобулином, этот фактор активации макрофагов известен как GcMAF (фактор активации макрофагов, полученный из Gc-глобулина) (обзор белка, связывающего витамин D, и GcMAF см. в ссылке 7 ).
Мощные иммунотерапевтические эффекты GcMAF в опухолях человека были продемонстрированы с 2007 года при различных видах рака, начиная от наиболее распространенных видов рака молочной железы и простаты и заканчивая менее частыми олигодендроглиомами ( 8-14 ) .
Таким образом, учитывая, что GcMAF связывает ОА способом, идентичным таковому с α-лактальбумином или лактоферринами ( 15 ), мы предположили, что комплексы OA-GcMAF обладают большей противораковой активностью, чем у OA или GcMAF по отдельности, при сочетании противораковых свойств GcMAF. с комплексами ОА-белок.
Поскольку комплексы OA-белок и GcMAF не проявляют признаков токсичности ( 4 , 16 ), комплекс OA-GcMAF использовался как часть интегративного иммунотерапевтического подхода к распространенным видам рака в контексте так называемого сострадательного подхода ( 14 ).
В настоящем исследовании мы предполагаем, что драматические эффекты OA-GcMAF у онкологических больных, о которых недавно сообщалось ( 14 ), опосредованы продукцией оксида азота (NO) активированными макрофагами.
Это идентифицирует триаду молекулярных элементов: OA, GcMAF и NO, каждый из которых наделен индивидуальными противораковыми свойствами, которые демонстрируют синергетические эффекты и могут открыть путь к значительно улучшенной стратегии лечения рака, лишенной вредных побочных эффектов.
Пациенты и методы
В Центре лечения иммунобиотехнологий пациентов с запущенным раком в настоящее время лечат с помощью интегративной иммунотерапии на основе OA-GcMAF.
Комплексы OA-GcMAF используются в сочетании со следующими подходами: (i) эквикалорийная диета с очень низким содержанием углеводов, высоким содержанием белка, которая, как известно, замедляет рост опухоли и предотвращает возникновение рака ( 17 ), (ii) кисломолочные продукты, содержащие GcMAF, (iii) добавки с высоким содержанием витамина D3 ( 18 ), (iv) низкие дозы ацетилсалициловой кислоты ( 19 ) и (v) добавки жирных кислот омега-3 ( 20 ).
Эти подходы, направленные на укрепление иммунной системы и снижение роста опухоли, считаются дополняющими, а не альтернативными другим противоопухолевым терапевтическим процедурам, которые могут принять во внимание пациенты и их лечащий медицинский работник.
Получение комплексов OA-GcMAF.
Комплексы OA-GcMAF (GOleic) были приготовлены в компании Immuno Biotech Ltd по запатентованной методике. Вкратце, GcMAF очищали согласно ранее описанной процедуре ( 10 ).
Витамин D-связывающий белок выделяли из очищенной человеческой сыворотки, полученной от Американского Красного Креста (2025 E St NW Washington, округ Колумбия, США), используя либо высокоаффинную хроматографию на 25-гидроксивитамине D3-сефарозе, либо аффинную хроматографию на актин-агарозе. Связанный материал элюировали, а затем дополнительно обрабатывали путем инкубации с тремя иммобилизованными ферментами, как описано ( 16 ).
Полученный GcMAF стерилизовали фильтрованием. Содержание и концентрацию белка анализировали с использованием стандартных методов анализа белка в Брэдфорде ( 21 ).
Чистоту оценивали с помощью SDS-PAGE и вестерн-блоттинга, проводимого после каждого этапа процедуры приготовления; была видна только одна полоса ожидаемой молекулярной массы ( 22 ).
В конце производственного процесса GcMAF был проверен на стерильность как внутри компании, так и снаружи независимыми лабораториями. Его безопасность и биологическая активность были протестированы на моноцитах человека, клетках рака молочной железы человека и хорионаллантоисной мембране куриного эмбриона ( 15 , 23 , 24 ).
Высокоочищенный ОА (молекулярная масса 282,46; молекулярная формула C18 H34 O2; Acros Organics, Geel, Бельгия) образовывали комплекс с GcMAF в соответствии с уже описанными молекулярными структурами и моделированием ( 15 ).
Оптимальные условия приготовления комплексов были установлены согласно описанным принципам ( 25 ).
Благодаря комплексообразованию белка с гидрофобным фрагментом жирной кислоты и ввиду хорошо известных свойств ОА как усилителя абсорбции, комплексы ОА-GcMAF можно вводить сублингвально ( 26 ) или в виде аэрозоля с помощью обычного небулайзера ( 27) . ), в виде суппозиториев ( 28 ) или чрескожно ( 29 ).
Оценка иммунотерапевтических эффектов, индуцированных OA-GcMAF.
Активацию макрофагов in vivo оценивали путем мониторинга артериального давления пациентов и селезеночного кровотока до и после введения OA-GcMAF.
Таким образом, хорошо известно, что активированные макрофаги выделяют NO, соединение, которое вызывает расширение сосудов и, по-видимому, отвечает за некоторые противораковые свойства активированных макрофагов ( 30 , 31 ).
Введение OA-GcMAF (440-880 нг, растворенных в 5 мл физиологического раствора) с помощью небулайзера приводило к быстрому снижению артериального давления, причем эффекты были четко заметны через 1 минуту после окончания распыления.
Чтобы еще раз оценить выработку NO и иммунную стимуляцию, селезеночный кровоток контролировали с помощью ультразвуковой системы (MyLab25Gold, Esaote, Генуя, Италия) с использованием метода эхо-цветного допплера.
Интегративная иммунотерапия рака с использованием OA-GcMAF.
Стандартный протокол Иммуно-Биотех-лечебного центра следующий: OA-GcMAF (от 880 до 2000 нг в зависимости от потребностей пациентов) вводится ежедневно, используя наиболее подходящий для каждого пациента путь введения, например, пациентам с раком легких. или метастазы, предпочтительно введение OA-GcMAF с помощью небулайзера.
У пациентов с раком печени или метастазами можно применять суппозитории. В других случаях внутримышечный путь, первоначально предложенный Yamamoto et al. ( 8 ), используется.
Другие дополнительные интегративные подходы.
Чтобы использовать известные противораковые свойства витамина D3 и учитывая, что GcMAF является компонентом оси витамина D ( 15 ), пациентам назначают пищевые добавки витамина D3 в дозе 20 000 МЕ в день ( 18 ) с мониторингом крови. уровень такого витамина. Пациентов приучают выпивать не менее 2 литров воды (или других жидкостей, например, травяных чаев) в день.
Пациентам рекомендуется соблюдать режим питания, основанный на недавних наблюдениях, демонстрирующих, что диета с низким содержанием углеводов и высоким содержанием белка замедляет рост опухоли и предотвращает возникновение рака ( 17 ).
Чтобы способствовать соблюдению этого типа диеты, пациентам обеспечивают пищу, содержащую всего 2% углеводов и относительно высокое содержание белка (Le Gamberi Foods, Форли, Италия).
Кроме того, чтобы использовать известные противораковые свойства ОА, содержащегося в оливковом масле экстра-класса ( 32 ), пациентам дают оливковое масло экстра-класса в качестве заметной части их ежедневного потребления жиров.
Вес и мышечная масса пациентов постоянно контролируются, и пациентов обучают стратегиям снижения показателя прогностического воспалительного индекса питания (PINI), а также стратегиям предотвращения синдрома раковой анорексии и кахексии (CACS) согласно Фабрису и соавт. ( 33 ).
Для этой цели предназначены добавки аминокислот (Master Aminoacid Pattern, Dr. Reinwald Healthcare GmbH, Шварценбрук, Германия) ( 34 ). Также назначение низких доз ацетилсалициловой кислоты и оливкового масла экстра-класса направлено на уменьшение системного воспаления и, следовательно, на снижение шкалы PINI ( 35 ).
Чтобы использовать хорошо известные иммуностимулирующие и противораковые эффекты пробиотических кисломолочных продуктов ( 36 ), пациентам дают пробиотический кисломолочный продукт, содержащий молозиво и микроорганизмы, которые, как известно, производят природный GcMAF из молока и молозивного Gc-глобулина во время ферментации. процесс (Браво Пробиотик, Ле Альпы, Веллингтон, Новая Зеландия). Наконец, учитывая хорошо оцененную роль низких доз ацетилсалициловой кислоты в профилактике рака ( 37 ), пациентам дают 100 мг такого активного начала в день.
Полученные результаты
Хорошо известно, что OA-GcMAF стимулирует макрофаги ( 15 ), которые, в свою очередь, высвобождают NO ( 30 ).
Учитывая впечатляющие эффекты NO на доклинических моделях рака, где он замедляет рост опухоли и повышает эффективность как химиотерапии, так и лучевой терапии ( 38 ), в качестве первого шага мы стремились определить, стимулирует ли OA-GcMAF высвобождение NO из макрофагов. в естественных условиях .
С этой целью мы решили изучить изменение систолического и диастолического артериального давления и селезеночного кровотока после введения OA-GcMAF (880 нг в 5 мл физиологического раствора) с помощью небулайзера. Согласно нашей гипотезе, OA-GcMAF будет стимулировать альвеолярные макрофаги, которые, в свою очередь, будут производить NO, тем самым снижая кровяное давление.
Затем OA-GcMAF всасывается в кровоток и в конечном итоге стимулирует макрофаги в других областях тела. Учитывая огромное количество макрофагов, находящихся в селезенке ( 39 ), мы могли бы ожидать массивного высвобождения NO активированными макрофагами в этом органе с сопутствующим увеличением кровотока, которое можно легко измерить с помощью эхо-цветной допплерографии.
Субъект с легким иммунодефицитом из-за множественных узлов щитовидной железы (испытуемый № 1; фигуры 1 и 2 ) самостоятельно вводил OA-GcMAF (880 нг в 5 мл физиологического раствора) путем распыления в течение примерно 5 минут. Примерно через 1 минуту после окончания распыления артериальное давление, измеренное, когда субъект удобно сидел, снизилось со 124/85 до 115/74.
Качественно аналогичный эффект наблюдался у большинства субъектов, которым вводили OA-GcMAF посредством небулайзера, и среднее снижение составляло порядка 10 мм рт. ст. Мы интерпретировали эти результаты как косвенное свидетельство продукции NO альвеолярными макрофагами, активированными OA-GcMAF. Фактически, хорошо известно, что NO снижает кровяное давление как у людей, так и у экспериментальных животных ( 40 , 41 ).
На рисунке 3 показан ультразвуковой снимок селезенки испытуемого №1 до распыления; Морфология, размер и ультразвуковая структура селезенки кажутся нормальными. Селезеночный кровоток можно оценить по соотношению ворот селезенки. В паренхиме органа можно было наблюдать незначительный сигнал или его отсутствие.
На рисунке 4 показан кровоток в селезенке через 5 минут (панель А) и через 1 час после распыления (панель Б). Увеличение паренхиматозного кровотока впечатляет. Мы интерпретировали это увеличение паренхиматозного кровотока как следствие внутриселезеночной активации макрофагов с высвобождением NO, который, в свою очередь, был ответственен за расширение внутригрудных и периферических кровеносных сосудов. Этот эффект длился не менее 48 часов.
На рисунке 5 изображен селезеночный кровоток через 24 часа (панель А) и 48 часов (панель В) после распыления. Обратите внимание, что испытуемый № 1, в отличие от добросовестных пациентов, не проходил никакого другого лечения, ни связанного с GcMAF, ни связанного с другими дополнительными стратегиями, описанными выше.
Надежность и воспроизводимость метода были быстро представлены как часть общей оценки реакции пациентов на введение OA-GcMAF. Аналогичный эффект, хотя и значительно более медленный в своем развитии, наблюдался у пациентов, которым вводили OA-GcMAF путем локальных подкожных инъекций.
На рисунке 6 показано увеличение селезеночного кровотока, наблюдаемое через 7 дней лечения у пациентки с метастатическим раком молочной железы и поражением ретростернального узла, где OA-GcMAF (1,320 нг/день) вводился посредством локальных подкожных инъекций в брюшную стенку (эпигастрий). , 880 нг) и подмышечной впадины (440 нг).
Активация альвеолярных и селезеночных макрофагов введением OA-GcMAF с последующим высвобождением NO была связана со значительным уменьшением объема опухоли во всех случаях, когда первичную опухоль, метастазы или лимфатические узлы можно было измерить с помощью ультразвуковых методов.
В среднем мы наблюдали уменьшение объема опухоли примерно на 25% за неделю ( 14 ). Хотя это снижение может показаться значительным, оно полностью соответствует результатам, полученным Nonaka et al. ( 42 ), которые наблюдали уменьшение объема гепатоцеллюлярной карциномы человека на 97% после 3 недель подкожной инъекции GcMAF. Это также согласуется с результатами неоадъювантной химиотерапии ( 43 ). Эти результаты подтверждают гипотезу о том, что молекулы OA, GcMAF и NO, наделенные индивидуальными противораковыми свойствами, воздействующими на различные аспекты неопластического роста, указывают на синергетический эффект при введении таким образом, чтобы использовать их физиологические характеристики.
Среди случаев, наблюдавшихся в Центре лечения иммунобиотехнологий, мы представляем случаи двух пациентов, каждый из которых является представителем распространенных видов рака, для которых интегративная иммунотерапия на основе ОА, GcMAF и NO оказалась чрезвычайно эффективной.
Насколько нам известно, это один из немногих примеров реальных изображений уменьшения объема опухоли после иммунотерапии GcMAF.
Таким образом, до сих пор эффективность иммунотерапии рака с помощью GcMAF зависела от неспецифических маркеров, таких как уровни α-N-ацетилгалактозаминидазы в сыворотке ( 8-10 , 12 ) или отдельных сообщений ( 11 , 13 ).
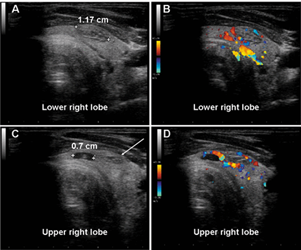
Рисунок 1.
Ультрасонографические данные испытуемого № 1: УЗИ щитовидной железы, аксиальное сканирование нижней правой доли. А. Слегка выступающий солидный узел размером 1,17 см в переднем отделе нижней доли. Внутренняя ультрасонографическая структура мелко неоднородна и гипоотражательна по сравнению с окружающей нормальной тканью щитовидной железы. Границы четко определены. B. Цветное допплеровское исследование того же узла. Кровеносные сосуды расположены вокруг твердого узла и имеют типичную «корзинку». C. Меньшее, преимущественно жидкое (гипоотражающее) поражение (0,7 см) с еще одним небольшим твердым узлом поблизости (белая стрелка). Внутри гипорефлекторного образования можно заметить участок выступающей солидной ткани. D. Цветное допплеровское исследование того же очага. Кровеносные сосуды расположены вокруг двух поражений.
Пациент 1. У мужчины 56 лет диагностирован метастатический плоскоклеточный рак, ранее лечившийся несколькими курсами лучевой терапии и химиотерапии. После периода ремиссии выявлено несколько новых метастазов, в том числе в мягких тканях правой брюшной стенки.
Кроме того, у пациента наблюдалось затруднение дыхания, вероятно, из-за бронхообструктивных метастазов, которые препятствовали вентиляции его апикальной правой доли.
Из-за этих симптомов OA-GcMAF (880 нг/день) вводили с помощью небулайзера, содержащего 440 нг активного начала, растворенного в 5 мл физиологического раствора, и локальными подкожными инъекциями (440 нг) в правую брюшную стенку вблизи подкожное поражение, указанное пациентом и легко распознаваемое при УЗИ.
Пациент не сообщил о каких-либо побочных эффектах после этих способов введения, которые были выбраны с его информированного согласия.
Для оценки изменений было проведено УЗИ поражения правой брюшной стенки. Принимая во внимание, что на измерения, проводимые на ультразвуковых изображениях, может влиять ряд переменных, предварительные данные, по-видимому, указывают на то, что это поражение, взятое за репрезентативное, показало уменьшение расчетного объема с 0,30 до 0,22 мл (возможно, на 27%) после 5 дни лечения ( рис. 7 ). Пациент сообщил о субъективном улучшении дыхания и вентиляции в апикальной правой доле.
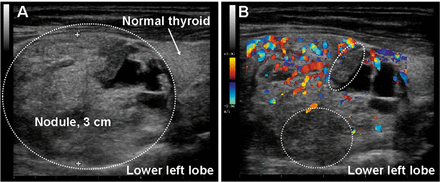
Рисунок 2.
Ультрасонографические данные испытуемого № 1: УЗИ щитовидной железы, продольное сканирование нижней левой доли. А. Может наблюдаться массивный смешанный (солидный и кистозный) выступающий узел, замещающий большую часть доли. Передне-задний диаметр составлял около 3 см, тогда как продольный диаметр превышал длину зонда (4 см). Структура резко неоднородна: кистозные участки и гипоотражающие участки чередуются с изо- или гиперотражающими участками. Границы, граничащие с остаточной нормальной тканью щитовидной железы, наблюдаемой справа на рисунке (белая стрелка, краниальная часть левой доли), кажутся четко выраженными. Гипоотражающая граница может указывать на область отека вокруг узла. B. Цветное допплеровское исследование того же узла. Кровеносные сосуды расположены вокруг и внутри узла. Стоит отметить, что в гипоотражающих областях (обозначенных белыми пунктирными кружками) можно наблюдать небольшое количество кровеносных сосудов или вообще их не наблюдается, что указывает на наличие метаболически неактивной опухолевой ткани.
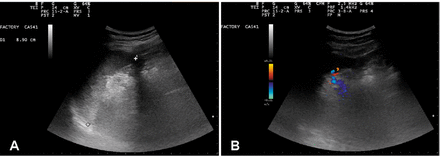
Рисунок 3.
Ультрасонографический вид селезенки испытуемого №1 до введения OA-GcMAF. Панель А: Морфология, размер и ультрасонографическая структура селезенки выглядят нормальными. Панель B: Кровоток в селезенке можно оценить по соотношению ворот селезенки. В паренхиме органа можно было наблюдать незначительный сигнал или его отсутствие.
Пациент 2. У 62-летней женщины диагностирован обширный рак молочной железы с распространенным поражением подмышечных лимфатических узлов. Пациент решил не подвергаться хирургическому вмешательству или любому другому традиционному лечению с момента первоначального диагноза.
Поскольку размер первичной опухоли был больше зонда (4 см), мы решили измерить сросшиеся подмышечные узлы, чтобы контролировать ответ на OA-GcMAF. OA-GcMAF (880 нг/день) вводили с помощью небулайзера, содержащего 440 нг активного начала, растворенного в 5 мл физиологического раствора, и с помощью локализованных подкожных инъекций (440 нг) в подмышечную область, на 1 см дистальнее узлов, выявленных с помощью УЗИ.
Пациентка не сообщила о каких-либо побочных эффектах после применения этих способов введения, которые были выбраны с ее информированного согласия. На рисунке 8 видно, что через 4 дня лечения диаметр двух сросшихся подмышечных узлов уменьшился с 3,90 до 3,46 см.
С точки зрения расчетного теоретического объема, если предположить, что поражение имело сферическую форму, это соответствует уменьшению примерно на 28%.
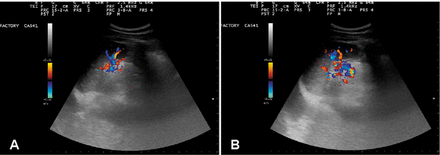
Рисунок 4.
Немедленное увеличение селезеночного кровотока после введения OA-GcMAF путем распыления испытуемому №1. Селезеночный кровоток оценивали с помощью эхо-цветной допплерографии. Панель А: Селезеночный кровоток через 5 минут после окончания распыления OA-GcMAF. Панель B: Селезеночный кровоток через 1 час после окончания распыления. Увеличение паренхиматозного кровотока впечатляет.
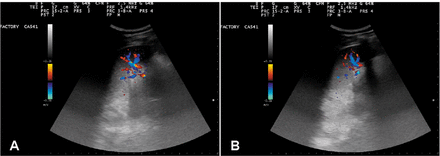
Рисунок 5.
Устойчивое увеличение селезеночного кровотока после введения OA-GcMAF путем распыления испытуемому №1. Селезеночный кровоток оценивали с помощью эхо-цветной допплерографии после введения OA-GcMAF. Панель А: Селезеночный кровоток через 24 часа после окончания распыления. Панель B: Селезеночный кровоток через 48 часов после окончания распыления. Увеличение паренхиматозного кровотока оказывается стойким.
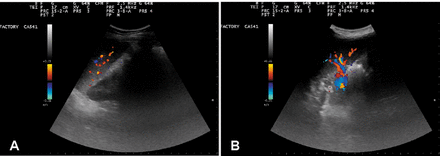
Рисунок 6.
Увеличение селезеночного кровотока после введения OA-GcMAF путем локальной подкожной инъекции больному раком. Селезеночный кровоток оценивали после введения OA-GcMAF с помощью эхо-цветного допплеровского ультразвукового метода. Панель А: Кровь селезенки перед введением. Панель B: Селезеночный кровоток через 7 дней введения. Очевидно усиление паренхиматозного кровотока.
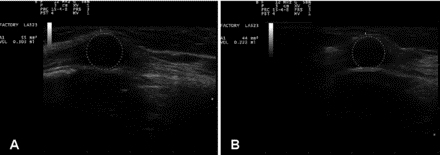
Рисунок 7.
Ультрасонография метастазов в мягких тканях до и после введения OA-GcMAF. Пациент № 1: 56-летнему мужчине был поставлен диагноз метастатического плоскоклеточного рака, ранее он лечился несколькими курсами лучевой терапии и химиотерапии. После периода ремиссии выявлено несколько новых метастазов, в том числе в мягких тканях правой брюшной стенки. Панель А: Ультрасонографический вид поражения до введения OA-GcMAF. Панель B: Ультрасонографический вид поражения после 4 последовательных дней введения OA-GcMAF. Можно оценить приблизительное уменьшение объема на 27%.
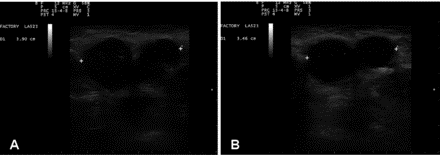
Рисунок 8.
Ультрасонография неопластических подмышечных лимфатических узлов до и после введения OA-GcMAF. Пациент № 2: 62-летняя женщина, у которой диагностирован обширный рак молочной железы с распространенным поражением подмышечных лимфатических узлов. Измерялись ипсилатеральные сросшиеся подмышечные узлы. После 4 дней подряд лечения OA-GcMAF диаметр двух сросшихся подмышечных узлов уменьшился с 3,90 см (панель А, т.е. до лечения) до 3,46 см (панель В, т.е. после 4 дней лечения). С точки зрения расчетного теоретического объема, если предположить, что поражение имело сферическую форму, это соответствует уменьшению примерно на 28%.
Обсуждение
OA, GcMAF и NO — это молекулы, обладающие множеством биологических активностей, которые можно использовать в стратегиях противоракового лечения. Избирательное действие комплексов ОА-белок, таких как HAMLET, на уничтожение опухолей, приписывается ОА, который, попав внутрь опухолевых клеток благодаря ассоциации с белками, активирует определенные этапы гибели опухолевых клеток.
К ним относятся вмешательство в экспрессию онкогенов ( Ras, erbB-2 и c-Myc ) и гликолитических ферментов ( 2 , 4 ).
В этом сценарии белок служит главным образом, если не единственным, средством переноса ОА внутрь опухолевой клетки, где жирная кислота может воздействовать на цитоплазматическую мембрану, цитоскелет, митохондрии, протеасомы, лизосомы и ядро ( 4 ).
Таким образом, недавнее исследование показало, что биологическая активность комплексов ОА-α-лактальбумин связана с жирными кислотами. Кроме того, фрагмент α-лактальбумина сам по себе не обладает эффектом уничтожения опухолей, а просто действует как солюбилизирующий агент при ОА ( 44 ).
Таким образом, синтез комплексов OA-GcMAF может представлять собой преимущество перед HAMLET, поскольку GcMAF, в отличие от α-лактальбумина, оказывает прямое воздействие на раковые клетки. В частности, мы и другие продемонстрировали, что GcMAF ингибирует пролиферацию раковых клеток и метастатический потенциал ( 24 , 45 ).
Другими словами, комплексы OA-GcMAF могут использовать противораковые свойства как OA, так и GcMAF, возможно, синергическим образом. В этом сценарии ОА будет способствовать связыванию комплекса с цитоплазматической мембраной, как уже было продемонстрировано ( 15 ), и мультимолекулярный комплекс ОА-GcMAF-рецептор витамина D (VDR) будет интернализован. Оказавшись внутри клетки, ОА и GcMAF могут воздействовать на соответствующие метаболические/сигнальные пути, быстро вызывая апоптоз раковых клеток.
Фактически, мы недавно заметили, что комплексы OA-GcMAF примерно в 200 раз более эффективны, чем один GcMAF, в индукции апоптоза клеток рака молочной железы человека in vitro (Thyer L и др. , личное сообщение об экспериментальных данных, представленных на 18-й конференции). Международное собрание Европейского общества гинекологической онкологии, Ливерпуль, Великобритания, октябрь 2013 г.), возможно, из-за этого синергетического эффекта.
Если эта гипотеза верна, она может помочь объяснить прямое воздействие комплексов OA-GcMAF на опухолевые клетки; отчетливые стимулирующие эффекты GcMAF на макрофаги могут быть ответственны за синтез и высвобождение третьей противораковой молекулы, то есть NO.
Таким образом, мы продемонстрировали, что эффекты GcMAF опосредованы VDR ( 15 , 46 ), а активация VDR приводит к синтезу и высвобождению NO макрофагами ( 47 ). По нашим наблюдениям, о синтезе и высвобождении NO после введения OA-GcMAF можно судить по снижению артериального давления и увеличению селезеночного кровотока (см. раздел «Результаты»).
Противораковые эффекты NO известны уже много лет ( 30 ), и похоже, что ОА и NO имеют общие мишени в раковых клетках. Таким образом, NO подавляет клеточное дыхание и синтез ДНК и индуцирует апоптоз раковых клеток путем активации протеаз семейства каспаз, что является общим признаком ОА ( 2 , 48 ).
Однако наиболее интересными с точки зрения клинического применения являются совпадающие эффекты ОА и NO на гликолитические пути раковых клеток ( 49 , 2 ).
В соответствии с гипотезой о гликолизе как основной мишени противораковых эффектов ОА и NO было продемонстрировано, что лишение глюкозы повышает чувствительность опухолевых клеток к гибели клеток, индуцированной HAMLET ( 50 ).
Действительно, это наблюдение легло в основу одного из принципов интегративного противоракового подхода, описанного выше, а именно плана питания с низким содержанием углеводов. Фактически, мы пришли к выводу, что низкоуглеводная диета не только лишит раковые клетки их единственного источника энергии ( 17 ), но также сделает их более восприимчивыми к противораковым эффектам ОА и NO.
В заключение, наблюдения, представленные в этом исследовании, вместе с недавними результатами молекулярного моделирования ( 15 ), демонстрируют, что OA, GcMAF и NO, молекулы, наделенные индивидуальными противораковыми свойствами, могут быть правильно объединены и специфично доставлены пациентам с поздними стадиями рака со значительными противораковыми свойствами. влияние на стимуляцию иммунной системы и уменьшение объема опухоли.
Фактически, из 40 пациентов, которые соответствовали критериям приема Центра лечения иммунобиотехнологий, большинство из которых страдали раком поздней стадии 4, продемонстрировали одинаковые и значительные клинические улучшения.
Эти наблюдения могут совершить революцию в области лечения рака, поскольку оказывается, что предлагаемые противораковые стратегии полностью лишены каких-либо зарегистрированных вредных побочных эффектов.
Благодарности
Стефания Пачини получила гранты Университета Флоренции и проекта PRIN 2009.
Сноски
Потенциальные конфликты интересов
Д.Н. является генеральным директором Immuno Biotech, Ltd (компании, выделяющей и очищающей белок GcMAF и производящей OA-GcMAF). Однако DN не знала ни об используемых методах лечения, ни об именах пациентов, чьи данные анализировались. Ни он, ни какой-либо сотрудник Immuno Biotech, Ltd не имел никаких знаний о клинических записях или именах пациентов, использованных в этом исследовании. М.Р. является научным руководителем-консультантом компании Immuno Biotech, Ltd и профессором молекулярной биологии; он внес свой вклад в описанное молекулярное моделирование и интерпретацию результатов.
Поступила 23 апреля 2014 г.
Доработка получена 26 мая 2014 г.
Принято 27 мая 2014 г.
Copyright © Международный институт противораковых исследований, 2014 г. (д-р Джон Г. Делинассиос), Все права защищены.
Рекомендации
Мартин-Пелаес С. ,Ковас М.И. ,Фито М ,Кушар А ,
: Влияние полифенолов оливкового масла на здоровье: последние достижения и возможности использования заявлений о пользе для здоровья . Мол Нутр Фуд Рес 57 ( 5 ) : 760–771 , 2013 .
Каррильо С ,Кавиа Мдел М ,Алонсо-Торре СР
: Противоопухолевый эффект олеиновой кислоты; механизмы действия: обзор . Нутр Хосп 27 ( 6 ): 1860 — 1865 , 2012 .
Фанг Б ,Чжан М ,Тянь М ,Цзян Л ,Го ХИ ,Рен ФЗ
: Бычий лактоферрин связывает олеиновую кислоту, образуя противоопухолевый комплекс, аналогичный HAMLET . Biochim Biophys Acta 1841 ( 4 ) : 535–543 , 2013 .
Хо CSJ ,Ридстрем А ,Трульссон М ,Болфорс Дж .,Шторм П ,Путиа М ,Надим А ,Сванборг С
: ГАМЛЕТ: функциональные свойства и терапевтический потенциал . Будущий Онкол 8 ( 10 ) : 1301–1313 , 2012 .
Немашкалова Е.Л. ,Казаков А.С. ,Хасанова Л.М. ,Пермяков Е.А. ,Пермяков С.Е.
: Структурная характеристика более мощных альтернатив HAMLET, туморицидного комплекса α-лактальбумина и олеиновой кислоты . Биохимия 52 ( 36 ) : 6286-6299 , 2013 . _
Фогель Х.Дж.
: Лактоферрин, вид с высоты птичьего полета . Biochem Cell Biol 90 ( 3 ) : 233–244 , 2012 .
Руджеро М ,Пачини С
: Ось витамина D при хронической болезни почек – современное состояние и перспективы . Европейская нефрология 5 ( 1 ) : 15–19 , 2011 .
Ямамото Н ,Суяма Х ,Ямамото Н ,Ушидзима Н
: Иммунотерапия метастатического рака молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF) . Int J Cancer 122 ( 2 ) : 461–467 , 2008 .
Перекрестная ссылкаПабМедGoogle Scholar
Ямамото Н ,Суяма Х ,Наказато Х ,Ямамото Н ,Кога Ю
: Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF . Рак Иммунол Иммунотер 57 ( 7 ) : 1007–1016 , 2008 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Ямамото Н ,Суяма Х ,Ямамото Н
: Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc, GcMAF . Transl Oncol 1 ( 2 ) : 65–72 , 2008 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Инуи Т ,Кучиике Д ,Кубо К ,Метте М ,Уто Ю ,Хори Х ,Сакамото Н
: Клинический опыт интегративной иммунотерапии рака с использованием GcMAF . Anticancer Res 33 ( 7 ) : 2917–2919 , 2013 .
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Тьер Л ,Уорд Э ,Смит Р ,Бранка Джей Джей ,Моруччи Г ,Гулисано М ,Ноукс Д. ,Эслингер Р. ,Пачини С
: Фактор активации макрофагов, полученный из белка GC, снижает уровни α-N-ацетилгалактозаминидазы у больных раком на поздних стадиях . Онкоиммунология 2 ( 8 ): e25769 , 2013 .
Тьер Л ,Уорд Э ,Смит Р ,Бранка JJV ,Моруччи Г ,Гулисано М ,Ноукс Д. ,Пачини С
: Терапевтические эффекты высокоочищенного дегликозилированного gcmaf в иммунотерапии пациентов с хроническими заболеваниями . Am J Immunol 9 ( 3 ) : 78–84 , 2013 .
Уорд Э ,Смит Р ,Бранка JJV ,Ноукс Д. ,Моруччи Г ,Тьер Л.
: Клинический опыт иммунотерапии рака, интегрированной с олеиновой кислотой в комплексе с дегликозилированным белком, связывающим витамин D. Am J Immunol 10 ( 1 ) : 23–32 , 2014 .
Тьер Л ,Уорд Э ,Смит Р ,Фиоре МГ ,Магерини С ,Бранка ДжейДжей ,Моруччи Г ,Гулисано ,
Руджеро М ,Пачини С
: Новая роль основного компонента оси витамина D: фактор активации макрофагов, связывающий витамин D, индуцирует апоптоз клеток рака молочной железы человека посредством стимуляции макрофагов . Питательные вещества 5 ( 7 ) : 2577–2589 , 2013 .
Брэдстрит Джей Джей ,Вогелаар Э ,Тьер Л.
: Первоначальные наблюдения повышенной активности альфа-н-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдаемое снижение активности после инъекций белка GC и фактора активации макрофагов . Понимание аутизма 4 : 31–38 , 2012 . _
Хо , ВВ ,Люнг К ,Сюй А ,Люк Б ,Лай Дж .,Шен С.Ю. ,Минчинтон А.И. ,Уотерхаус Д. ,Балли МБ ,
Лин В ,Нельсон Б.Х. ,Хитрый ЛМ ,Кристал Джи
: Диета с низким содержанием углеводов и высоким содержанием белка замедляет рост опухоли и предотвращает возникновение рака . Cancer Res 71 ( 13 ) : 4484–4493 , 2011 .
Перекрестная ссылкаПабМедGoogle Scholar↵
ден Холландер П. ,Сэвидж М.И. ,Браун ПХ
: Таргетная терапия для профилактики рака молочной железы . Фронт Онкол 3 : 250 , 2013 .
Тун М.Дж. ,Джейкобс Э.Дж. ,Патроно С
: Роль аспирина в профилактике рака . Nat Rev Clin Oncol 9 ( 5 ) : 259–267 , 2012 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Чжэн Дж.С. ,Ху XJ ,Чжао Ю.М. ,Ян Дж ,Ли Д
: Потребление рыбы и морских полиненасыщенных жирных кислот n-3 и риск рака молочной железы: метаанализ данных 21 независимого проспективного когортного исследования . БМЖ 346 : f3706 , 2013 г.
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Брэдфорд ММ
: Быстрый и чувствительный метод количественного определения микрограммов белка, использующий принцип связывания белка с красителем . Анальная Биохимия 72 : 248-254 , 1976 . _
Перекрестная ссылкаПабМедGoogle Scholar↵
Смит Р ,Тьер Л ,Уорд Э,Меаччи Э ,Бранка JJV ,Моруччи Г ,Гулисано М ,Руджеро М ,Пачини ,Патерностро Ф ,Ди Чезаре Маннелли Л. ,Ноукс Д. ,Пачини С
: Эффекты фактора активации Gc-макрофагов в нейронах человека; Значение для лечения синдрома хронической усталости . Am J Immunol 9 ( 4 ) : 120–129 , 2013 .
Пачини С ,Моруччи Г ,Пунци Т ,Гулисано М ,Руджеро М
: Фактор активации макрофагов, полученный из белка Gc (GcMAF), стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоисной мембраны куриного эмбриона .
Рак Иммунол Иммунотер 60 ( 4 ) : 479–485 , 2011 .
Пачини С ,Пунци Т ,Моруччи Г ,Гулисано М ,Руджеро М
: Влияние фактора активации макрофагов, связывающего витамин D, на клетки рака молочной железы человека . Anticancer Res 32 ( 1 ) : 45–52 , 2012 .
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Князева Е.Л. ,Грищенко В.М. ,Фадеев Р.С. ,Акатов В.С. ,Пермяков С.Е. ,Пермяков Е.А.
: Кто такой господин ГАМЛЕТ? Взаимодействие альфа-лактальбумина человека с мономерной олеиновой кислотой . Биохимия 47 ( 49 ) : 13127-13137 , 2008 . _
Перекрестная ссылкаПабМедGoogle Scholar↵
Цуй С.И. ,Лу ВЛ ,Сяо Л ,Чжан СК ,Хуан ЮБ ,Ли С.Л. ,Чжан Р.Дж. ,Ван Г.Л. ,Чжан Х ,Чжан Ц
: Сублингвальная доставка инсулина: влияние усилителей на текучесть липидов слизистой оболочки и конформацию белка, транспорт и гипогликемическую активность in vivo . Биол Фарм Бюллетень 28 ( 12 ): 2279-2288,2005.
Перекрестная ссылкаПабМедGoogle Scholar↵
Лу ХТ ,Чен РН ,Шеу М.Т. ,Чанг СС ,Чжоу ПЯ ,Хо Хо
: Назальный спрей силденафил быстрого действия, переносимый микроэмульсионными системами: оценка in vitro и фармакокинетические исследования in vivo на кроликах . Ксенобиотика 41 ( 7 ) : 567–577 , 2011 . _
Перейти к S ,Кавата М ,Сузуки Т ,Ким Н.С. ,Ито С
: Приготовление и оценка гелей Eudragit. I: Органогели Юдражит, содержащие лекарственные средства в виде ректальных препаратов пролонгированного действия . J Pharm Sci 80 ( 10 ) : 958-961 , 1991 .
Пачини С ,Моруччи Г ,Бранка Джей Джей ,Атерини С ,Амато М ,Гулисано М ,Руджеро М
: Влияние витамина D 3 и парикальцитола на незрелые кардиомиоциты: новая роль аналогов витамина D в профилактике сердечно-сосудистых заболеваний . Питательные вещества 5 ( 6 ) : 2076–2092 , 2013 .
Штур диджей ,Натан CF
: Оксид азота. Продукт макрофагов, ответственный за цитостаз и торможение дыхания в опухолевых клетках-мишенях . J Exp Med 169 ( 5 ) : 1543-1555 , 1989 .
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Натан К.Ф. ,Хиббс Джей Би младший .
: Роль синтеза оксида азота в антимикробной активности макрофагов . Curr Opin Immunol 3 ( 1 ) : 65-70 , 1991 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Наска А ,Трихопулу А
: Назад в будущее: парадигма средиземноморской диеты . Нутр Метаб Кардиоваск Дис 24 ( 3 ) : 216–219 , 2014 .
Фабрис А ,Бьяджиони П. ,Пунци Т ,Моруччи Г ,Гулисано М ,Пачини С ,Руджеро М
: Роль ангиотензинпревращающего фермента и полиморфизма гена рецептора витамина D в синдроме раковой анорексии-кахексии . Am J Immunol 8 ( 3 ) : 65–70 , 2012 .
Лука-Моретти М ,Гранди А ,Лука Э ,Муратори Г ,Нофрони М.Г. ,Муччи , депутат парламента ,Гамбетта П. ,Стимоло Р ,Драго П ,Джудис Дж .,Тамбурлин Н
: Комплекс аминокислот в качестве заменителя пищевых белков во время диеты для снижения веса для достижения баланса азотистого баланса организма практически без калорий . Adv Ther 20 ( 5 ) : 282–291 , 2003 .
Чичерале С. ,Лукас Л.Дж. ,Кист РС
: Антимикробная, антиоксидантная и противовоспалительная фенольная активность оливкового масла первого отжима . Curr Opin Biotechnol 23 ( 2 ) : 129–135 , 2012 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Лакриц -младший ,Путахидис Т. ,Левкович Т ,Вариан Би Джей ,Ибрагим ЮМ ,Хацигиагкос А ,Мирабал С ,Альм Э.Дж. ,Эрдман С.П.
: Полезные бактерии стимулируют иммунные клетки хозяина, чтобы противодействовать диетической и генетической предрасположенности к раку молочной железы у мышей . Int J Cancer 135 ( 3 ) : 529–540 , 2014 .
Торат М.А. ,Кьюзик Дж.
: Роль аспирина в профилактике рака . Curr Oncol Rep 15 ( 6 ) : 533–540 , 2013 г.
Сингх С ,Гупта АК
: Оксид азота: роль в биологии опухолей и противораковой терапии на основе iNOS/NO . Cancer Chemother Pharmacol 67 ( 6 ) : 1211-1224 , 2011 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Свирски ФК ,Нарендорф М ,Эцродт М ,Вильдгрубер М ,Кортес-Ретамосо В. ,Паницци П. ,
Фигейредо Х.Л. ,Колер Р.Х. ,Чудновский А ,Уотерман П. ,Айкава Э ,Мемпель Т.Р. ,Либби П ,
Вайсследер Р. ,Питтет М.Дж.
: Идентификация моноцитов селезеночного резервуара и их размещение в очагах воспаления . Science 325 ( 5940 ) : 612–616 , 2009 . _
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Гомпф Х ,Люфт ФК ,Морано I
: Повышение регуляции синтазы оксида азота и снижение артериального давления перед родами у крыс со спонтанной гипертензией . J Hypertens 20 ( 2 ) : 255–261 , 2002 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Холл Дж.Э. ,Грейнджер Дж.П. ,ду Карму Дж.М. ,да Силва А.А. ,Дубинион Дж .,Джордж Э ,
Хамза С.
: Гипертония: физиология и патофизиология . Compr Physiol 2 ( 4 ) : 2393–2442 , 2012 .
Нонака К ,Онидзука С ,Исибаши Х ,Уто Ю ,Хори Х ,Накаяма Т. ,Мацуура Н ,Канемацу Т. ,
Фудзиока Х
: Фактор активации макрофагов, связывающий витамин D, ингибирует ГЦК у мышей SCID . J Surg Res 172 ( 1 ) : 116–122 , 2012 .
Куропатка СК ,Гиббс Дж.Э. ,Лу Й ,Эссерман Л.Дж. ,Трипатия Д ,Вулвертон Д.С. ,Руго Х.С. ,
Хван Э.С. ,Юинг Калифорния ,Хилтон, Нью-Мексико
: МРТ-измерения объема опухоли молочной железы предсказывают ответ на неоадъювантную химиотерапию и безрецидивную выживаемость . Am J Roentgenol 184 ( 6 ) : 1774–1781 , 2005 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Фонтана А ,Сполаоре Б ,Полверино де Лаурето П
: Биологическая активность комплексов белок/олеиновая кислота заключается в жирных кислотах . Biochim Biophys Acta 1834 ( 6 ) : 1125–1143 , 2013 .
Грегори К.Дж. ,Чжао Б ,Биленберг Д.Р. ,Дриди С ,Ву Дж ,Цзян В ,Хуан Б ,Пири-Шеперд С ,
Фэннон М
: Фактор активации макрофагов, связывающий витамин D, непосредственно ингибирует пролиферацию, миграцию и экспрессию uPAR клеток рака простаты . PLoS One 5 ( 10 ): e13428 , 2010 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Пачини С ,Моруччи Г ,Пунци Т ,Гулисано М ,Руджеро М ,Амато М ,Атерини С
: Влияние парикальцитола и GcMAF на ангиогенез и пролиферацию и передачу сигналов мононуклеарных клеток периферической крови человека . Дж . Нефрол 25 ( 4 ) : 577–581 , 2012 .
Рокетт К.А. ,Брукс Р. ,Удалова И ,Видаль В. ,Хилл А.В. ,Квятковски Д
: 1,25-Дигидроксивитамин D3 индуцирует синтазу оксида азота и подавляет рост Mycobacterium Tuberculosis в линии макрофагоподобных клеток человека . Infect Immun 66 ( 11 ) : 5314-5321 , 1998 .
Аннотация / БЕСПЛАТНО полный текстGoogle Scholar↵
Чоудхари СК ,Чаудхари М ,Багде С ,Гадбейл А.Р. ,Джоши В.
: Оксид азота и рак: обзор . World J Surg Oncol 11 : 118 , 2013 .
Борутайте В. ,Браун Джи
: Что еще должно произойти, чтобы оксид азота вызвал гибель клеток? Biochem Soc Trans 33 ( Часть 6 ) : 1394–1396 , 2005 .
Перекрестная ссылкаПабМедGoogle Scholar↵
Шторм П ,Айтс С ,Путия МК ,Урбано А ,Северный Т ,Пауэрс С ,Боуэн Б ,Чао Ю ,Рейндл В ,
Ли Д.И. ,Салливан Н.Л. ,Чжан Дж ,Трульссон М ,Ян Х ,Уотсон Джей Ди ,Сванборг С
: Консервативные особенности раковых клеток определяют их чувствительность к смерти, вызванной HAMLET; c-Myc и гликолиз . Онкоген 30 ( 48 ) : 4765-4779 , 2011 . _
Перекрестная ссылкаПабМедGoogle Scholar
Два постера о новых результатах, полученных в трех европейских клиниках
В мае 2014 года два дополнительных исследования, описывающие наш успешный подход к лечению рака (уменьшение опухоли на 25% в неделю), были приняты для презентации после исчерпывающей экспертной оценки престижным научным комитетом.
Научный комитет IX Национальной конференции Итальянского общества иммунологии, клинической иммунологии и аллергологии принял два наших исследования, сообщающих о последних успехах в лечении рака с помощью олеиновой кислоты-GcMAF (Goleic).
Эти впечатляющие результаты были представлены международной аудитории врачей и исследователей, собравшихся во Флоренции, Италия, 28-31 мая. Конференция проходила под патронажем Европейской федерации иммунологических обществ, Европейской академии аллергии и клинической иммунологии, Национальной федерации итальянских медицинских ассоциаций, муниципалитета Флоренции и главной университетской больницы Фиренце (AOL Careggi).
Покровительство таких выдающихся медицинских и научных обществ и учреждений свидетельствует о международном престиже конференции и, соответственно, представленных исследований.
Первое исследование, авторами которого являются Уорд, Смит, Бранка, Ноакс, Моруччи и Тайер, описывает успешный интегративный подход на основе Голеика у пациентов с раком, считающимся неизлечимым.
Фактические изображения опухолей, уменьшившихся в среднем на 25% за одну неделю, были четко представлены и получили высокую оценку высококвалифицированной аудитории.
Мы были особенно горды тем, что показали изображения аденокарциномы поджелудочной железы, одного из наиболее быстро смертельных видов рака, которая не только уменьшилась в размерах, но и в конечном итоге инкапсулировалась, фактически превратившись в доброкачественную опухоль.
Нажмите здесь: Clinical results with Goleic
Другое исследование, авторами которого являются Уорд, Смит, Бранка, Ноакс, Моруччи, Пачини, Руджеро и Тиер, описывает молекулярный механизм действия, лежащий в основе таких потрясающих результатов.
Здесь показано, что голеика вызывает синтез мощной противораковой молекулы — оксида азота, который, в свою очередь, убивает раковые клетки, тем самым способствуя уничтожению рака.
Благодаря этим результатам мы демонстрируем еще одну атаку голеика на рак, о которой ранее не было известно.
Это исследование лежит в основе полной статьи, которую мы намерены опубликовать в одном из самых престижных, рецензируемых научных журналов, включенных в базу данных Национальной медицинской библиотеки Национальных институтов здравоохранения США.
Нажмите здесь: Molecular mechanism and spleen
Американский журнал иммунологии 10 (1): 23-32, 2014
Опубликована первая статья о результатах лечения в нашем лечебном центре.
Основные моменты раздела результатов включают среднее уменьшение опухоли на 25% в неделю, а также снимки до и после ультразвукового исследования уменьшения опухоли с измерениями. Пациентка 3 — самая представительная с уменьшением опухоли на 27%, и еще четыре пациента (не показаны) с аналогичными результатами. У всех 26 пациентов отмечено значительное клиническое улучшение.
