NCBI Literature Resources Vavilovskii Zhurnal Genet Selektsii. 2020 May; 24(3): 284–291.
E.V. Levites, S.S. Kirikovitch, E.V. Dolgova, A.S. Proskurina, G.S. Ritter, A.A. Ostanin, E.R. Chernykh, and S.S. Bogachev
In vitro evaluation of biological activity of a domestic preparation of macrophage-activating factor (GcMAF-RF)
Оценка in vitro биологической активности отечественного препарата макрофаг-активирующего фактора (GcMAF-RF)
Содержание
В статье сообщается о разработанном оригинальном способе получения витамин D3-связывающего белка (DBP) и его конвертации в макрофаг-активирующий фактор GcMAF-RF.
Согласно разработанному регламенту, DBP получали из плазмы крови человека, применяя аффинную колоночную хроматографию, очи- щали и модифицировали до GcMAF-RF с использованием цитоиммобилизованных гликозидаз (бета-галакто- зидаза и нейраминидаза).
Принадлежность полученного полипептида к Gc-группе глобулинов плазмы крови подтверждали вестерн-блотом с использованием специфических антител.
Полученный полипептид по своим молекулярным свойствам соответствует описанному в литературе белку GсMAF, находящемуся на стадии кли- нических испытаний в США, Британии, Израиле и Японии (Saisei Mirai, Reno Integrative Medical Center, Immuno Biotech Ltd, Efranat, Catalytic Longevity).
Биологическую активность препарата GcMAF-RF определяли по индук- ции у перитонеальных макрофагов мыши фагоцитарной активности и способности продуцировать моноок- сид азота (NO) in vitro.
Фагоцитарную активность макрофагов оценивали по эффективности захвата магнитных шариков. Степень активации макрофагов рассчитывали по отношению числа захваченных шариков к общему числу макрофагов.
Уровень продукции NO оценивали по накоплению монооксида азота в культуральных су- пернатантах перитонеальных макрофагов колориметрическим методом с использованием реактива Грисса.
Показано, что GcMAF-RF кратно увеличивает фагоцитарную активность макрофагов и достоверно увеличивает продукцию ими монооксида азота. Выделенный оригинальным способом активатор макрофагов GcMAF-RF по своим характеристикам (согласно материалам, опубликованным в печати) соответствует препаратам GcMAF, представляемым на рынке зарубежными компаниями, и может рассматриваться как новый отечественный био- логически активный препарат с широким спектром действия.
Наибольший интерес вызывает его способность через активацию макрофагов усиливать адаптивный иммунитет организма. В этой связи предполагаются два направления терапевтического применения препарата GcMAF-RF. Препарат может быть востребован в области лечения онкологических заболеваний и, кроме того, может быть использован при лечении ряда нейродегене- ративных патологий и иммунодефицитных состояний.
Keywords: макрофаг-активирующий фактор (GcMAF), витамин D3-связывающий белок (DBP), фагоцитоз, монооксид азота (NO), перитонеальные макрофаги.
Введение
GcMAF (group-specific component protein-derived macrophage activating factor), важный компонент системы акти- вации макрофагов, образуется в результате сайт-специфического дегликозилирования витамин D3-связывающего белка (DBP), который присутствует в плазме крови человека в большом количестве (300–600 мг/л) (Malik et al., 2013; Delanghe et al., 2015).
Нативный DBP содержит один трисахарид, ковалентно связанный с треонином в позиции 420 и состоящий из N-ацетилгалактозамина (GalNAc) с присоединенными к нему галактозой и сиало- вой кислотой.
Преобразование DBP в GcMAF происходит путем отсоединения от GalNAc галактозы и сиаловой кислоты под действием β-галактозидазы и сиалидазы, ло- кализованных на клеточных мембранах активированных В- и Т-лимфоцитов соответственно (Yamamoto, Homma, 1991; Yamamoto, Kumashiro, 1993).
В результате такого селективного дегликозилирования образуется активный белок GcMAF. Считается, что именно GalNAc, входящий в состав активного центра GcMAF, обеспечивает активацию макрофагов (Naraparaju, Yamamoto, 1994; Mohamad et al., 2002; Saburi et al., 2017a, b).
Исследовательский и практический интерес к GcMAF определяется его способностью через активацию макро- фагов участвовать в защитных реакциях организма: в за- щите от патогенов, в элиминации стареющих, опухолевых и поврежденных клеток, а также в процессах заживления.
Широта биологических эффектов макрофагов, имеющих в ряде случаев оппозитную направленность, обеспечивается высокой функциональной гетерогенностью макрофагов (Gordon, 2003; Cassetta et al., 2011). Наиболее четко вы- деляются два субтипа макрофагов, которые обозначаются как М1- и М2-клетки с про- и противовоспалительной активностью соответственно.
М1-макрофаги играют важную роль в элиминации опу- холевых клеток. Они способны проявлять цитотоксиче- скую, микробицидную и антипролиферативную активно- сти, опосредованные продукцией активных метаболитов кислорода (например, Н2О2), монооксида азота (NO) и провоспалительных цитокинов. М2-макрофаги, напротив, проявляя противовоспалительную активность, ограничивают воспалительный/иммунный ответ. Повышенная активность М2-макрофагов сопряжена с развитием имму- носупрессии, приводящей к опухолевому росту (Lamagna et al., 2006; Sica, Bronte, 2007; Murray, Wynn, 2011).
Установлено, что функциональный тип макрофагов во многом определяется условиями их активации и инак- тивации (Korbelik et al., 1998; Mosser, 2003; Saburi et al., 2017a, b). Одним из факторов, препятствующих активации макрофагов, является ингибирование продукции GcMAF, осуществляемое ферментом нагалазой (α-N ацетилгалактозаминидазой), секретируемым опухолевыми клетками (Korbelik et al., 1998; Rehder et al., 2009; Saburi et al., 2017a, b).
Сывороточная нагалаза у больных раком способна полностью дегликозилировать предшественник MAF (DBP), осуществляя гидролиз по GalNAc-остатку. Лишенный активного сайта, полипептид теряет способность активировать инфильтрующие опухоль макрофаги, что в клинических наблюдениях характеризуется как иммуносупрессия, связанная с потерей макрофагами специфических активностей (Yamamoto et al., 1996; Mohamad et al., 2002; Matsuura et al., 2004; Thyer et al., 2013a).
У здоровых людей уровень нагалазы в несколько раз ниже, чем у онкологических больных, и нагалаза в отсутствие патологии не дегликозилирует трисахарид DBP (Ioannou et al., 1992; Nagasawa et al., 2005).
В пионерных работах N. Yamamoto (Yamamoto, Homma, 1991; Yamamoto, Kumashiro, 1993; Yamamoto et al., 1996) было сделано предположение, что инъекции очищенного экзогенного GcMAF могут компенсировать дефектный фактор, активировать систему макрофагов и их противораковую активность.
Проведенные клинические исследования свидетельствовали об эффективном воздействии GcMAF на опухоль, приводящем к значительной редукции опухолевого очага или полному уходу опухоли с продолжительным (несколько лет) безрецидивным периодом (Yamamoto et al., 2008; Rehder et al., 2009; Inui et al., 2013; Thyer et al., 2013a, b).
Со времени опубликования N. Yamamoto своих результатов относительно принадлежности выделенного полипептида к групп-специфическому активатору макрофагов прошло более 15 лет.
Исследованием полипептида в направлении поиска мишеней его клинического применения занимались разные лаборатории. Получены многочис- ленные, противоречивые данные о его функциональных возможностях в качестве активатора иммунных реакций при лечении злокачественных новообразований, аутизма, различных нарушений в работе иммунной системы.
Противоречивые результаты, касающиеся эффективности клинических возможностей GcMAF, вызвали немалую долю скептицизма в научном сообществе (Rehder et al., 2009; Ugarte et al., 2014; Borges, Rehder, 2016; Ruggiero et al., 2016).
Такое состояние вопроса связано еще и с тем, что препарат невозможно сделать предметом промышленной собственности, а можно только патентовать различные способы его получения и различные композиции, в составе которых он может применяется.
Именно по такому пути идут все производители GcMAF (Saisei Mirai, Reno Integrative Medical Center, Immuno Biotech Ltd, Efranat, Catalytic Longevity). Тем не менее о перспективности возможного практического использования препарата GcMAF свидетельствуют многочисленные данные, полученные на экспериментальных животных, а также данные доклинических исследований и накопленный положительный опыт его клинического применения (Korbelik et al., 1997; Kisker et al., 2003; Yamamoto et al., 2008; Toyohara et al., 2011; Pacini et al., 2012; Inui et al., 2013, 2016a, b; Kuchiike et al., 2013; Thyer et al., 2013a, b; Klokol, Teppone, 2016; Saburi et al., 2017a, b; Moya et al., 2018; Păduraru et al., 2019; Greilberger, Herwig, 2020).
Проведенный нами анализ литературных источников продемонстрировал большой интерес к препарату GcMAF в мире, несмотря на имеющиеся различные точки зрения (Останин и др., 2019), и определил направление его исследования в нашей лаборатории.
Поскольку практически во всех исследованиях процедура получения и активации препарата переписывается с одной-двух пионерных работ (Link et al., 1986; Yamamoto, Homma, 1991; Yamamoto, Kumashiro, 1993), что связано с его коммерческой перспективностью и нежеланием раскрывать детали выделения больших количеств активатора, мы решили разработать независимый регламент получения и активации фактора и экспериментально определить его возможную «клиническую мишень».
В настоящей работе, представляющей собой первую статью цикла из трех статей, описывающих действие препарата на экспериментальные биологические системы, оценивается способность полученного оригинальным способом препарата GcMAF-RF (GcMAF-Related Factor) активировать фагоцитарную функцию макрофагов и продуцировать монооксид азота in vitro.
Оригинальный способ выделения DBP и процедура его конвертации в GcMAF-RF цитоэнзиматическим способом были разработаны в ООО «Активатор MAF» совместно с лабораторией индуцированных клеточных процессов Федерального исследовательского центра Институт цитологии и генетики (ФИЦ ИЦиГ) СО РАН.
Способ получения препарата GcMAF-RF, в связи с его статусом «предмета промышленной собственности» компании ООО «Активатор MAF», охарактеризован здесь без указания деталей процедур.
Тем не менее общая характеристика способа, представленная в разделе «Результаты», дает достаточно полную информацию, демонстрирующую оригинальность подхода. По своим молекулярным свойствам полученный полипептид соответствует описанному в литературе белку GсMAF, находящемуся на стадии клинических испытаний в США, Британии, Израиле и Японии (Saisei Mirai, Reno Integrative Medical Center, Immuno Biotech Ltd, Efranat, Catalytic Longevity).
Материалы и методы
В экспериментах использовали по две-три месячных мыши линии СВА разведения вивария № 2 ФИЦ ИЦиГ СО РАН (стандартное содержание). Перитонеальные макрофаги (5 × 105 клеток/лунку) культивировали в 12-луночных планшетах в среде RPMI-1640 (Biolot), содержащей 10 % FBS (HyClone) и 40 мкг/мл гентамицина в течение 12 ч. Затем адгезивную фракцию макрофагов три раза отмывали забуференным физиологическим раствором (PBS) для удаления неприкрепленных клеток. Полученные макрофаги использовали в дальнейшем для анализа их биологической активности.
Фагоцитарную функцию макрофагов оценивали согласно методике, представленной в работе (Ishikawa et al., 2014). Перитонеальные макрофаги выделяли из брюшной полости двух-трех мышей, объединяли, распределяли по лункам планшета в равном количестве и культивировали в бессывороточной среде RPMI-1640 в течение 2 ч.
Затем среду меняли на RPMI-1640, содержащую 10 % FBS в отсутствие (контроль) или в присутствии следующих активаторов (позитивный контроль): липополисахарида (LPS, Sigma, 10 мкг/мл, Е. coli 0114:B4) либо полученных нами DBP (5 мкг/мл) или GcMAF-RF (5 мкг/мл). В каждую лунку добавляли также магнитные шарики (Dynabeads M-280, Invitrogen) в дозе 60 мкг/лунку.
После трехчасовой инкубации макрофаги три раза отмывали PBS для удаления неинтернализованных шариков, затем фотографировали в проходящем свете с использованием инвертированного микроскопа AxioObserver Z1 (Zeiss) и подсчитывали количество интернализованных гранул (IBN).
Фагоцитарную активность макрофагов оценивали по формуле: IBN = количество интернализованных шариков/ количество макрофагов. Для статистического анализа IBN учитывали данные четырех независимых экспериментов, в каждом эксперименте оценивали 300–500 клеток. Учет клеток был проведен из нескольких полей, расположенных в разных частях лунки планшета.
Продукцию NO определяли в пяти повторностях на семи мышах по накоплению нитритов после 3 ч инкубирования с активаторами в культуральных супернатантах перитонеальных макрофагов колориметрическим методом с использованием реактива Грисса (Green et al., 1982).
Для этого 100 мкл каждого тестируемого супернатанта переносили в 96-луночный планшет, смешивали с равным объемом реактива Грисса и инкубировали при комнатной температуре в течение 15 мин. Оптическую плотность оценивали на многоканальном спектрофотометре при длине волны 540 нм. Результаты соотносили со стандартной калибровочной кривой, полученной на основе серийных разведений 3 мМ раствора нитрита натрия.
Статистический анализ проводили с использованием программного обеспечения Statistica 10. В каждом эксперименте было выполнено минимум четыре повторения. Существование статистически значимых различий между исследуемыми группами проанализировано при помощи критерия Краскела–Уоллиса.
Для апостериорных сравнений между группами использовали U-критерий Манна–Уитни с учетом поправки Бонферрони (минимальный уровень значимости p = 0.05/ число сравнений). Таким образом, в случае анализа IBN различия считали достоверными при уровне значимости p < 0.017 (три попарных сравнения), а в случае анализа продукции NO – при p < 0.013 (четыре попарных сравнения) (Гржибовский, 2008).
Результаты
Как сказано выше, витамин D3-связывающий белок содержит три функциональных сайта: витамин D3-связывающий домен, актин-связывающий сегмент полипептидной цепи и сайт гликозилирования. Соответственно, существуют два очевидных способа аффинного выделения специфического белка, за актин- и витамин D3-связывающие домены (Haddad et al., 1984; Link et al., 1986; Swamy, Ray, 1995).
В исследованиях других авторов описывается практически всегда один и тот же способ получения активатора макрофагов GcMAF. Витамин D3 модифицируется в производную молекулу, содержащую гидроксил в положении 25, или химическим, или энзиматическим способом. Модифицированный витамин «пришивается » к активированной бромцианом сефарозе, и проводится аффинная хроматография. Далее белок активируется в GcMAF энзиматической конвертацией двумя гидролазами – салидазой и β-галактозидазой, ковалентно фиксированными на носителе (Yamamoto, Kumashiro, 1993; Yamamoto, 1996; Mohamad et al., 2002).
Функциональная активность полученного GcMAF тестируется по его способности индуцировать у макрофагов способность фагоцитировать разнообразные внеклеточные частицы. Главным образом используются опсонированные эритроциты барана (Hammarstrom, Kabat, 1971; Yamamoto, Kumashiro, 1993).
Наши многочисленные попытки выделить, активировать и оценить функциональную активность полученного полипептида способами, описанными в статьях, не увенчались успехом. Основными причинами неудач были: невозможность в достаточном количестве быстро получить составляющие компоненты всех сложных процедур, их высокая цена, постоянное утаивание авторами опубликованных работ принципиальных технических деталей той или иной процедуры.
В этой связи после тотальной проработки принципов получения GcMAF мы разработали следующий регламент выделения большого количества препарата витамин D3-связывающего белка, его конвертации в GcMAF-RF и оценки его способности активировать фагоцитарную функцию макрофагов и продукцию ими NO
Витамин D3-связывающий белок был выделен из сыворотки крови здоровых доноров с использованием аффинной хроматографии на колонке с ковалентно пришитым актином. Данный подход состоял из двух процедур.
Во первых, актин, необходимый в качестве аффинного лиганда, получали самостоятельно из мышц кролика (Spudich, Watt, 1971), благодаря чему удалось быстро наладить аффинную хроматографию и на порядки сократить затраты.
Одновременно из крабовых панцирей был выделен субстрат, необходимый для пришивки аффинного лиганда (de Souza et al., 2008).
Этот способ также позволил не опираться на импортные дорогие реактивы и существенно ускорил время получения фактора. Для конвертации DBP в GcMAF-RF был разработан оригинальный способ с использованием активированных лизофосфатидил- холином (Lyso-Pc, Sigma) воспалительных лимфоцитов, получаемых от того же донора (Ngwenya, Yamamoto, 1986; Yamamoto, Homma, 1991; Asaoka et al., 1992).
Суть подхода состоит в том, что на цитоплазматической мембране активированных к воспалению В- и Т-лимфоцитов присутствуют оба необходимых для конвертации DBP в GcMAF фермента: β-галактозидаза и салидаза соответственно.
Полученные от донора лимфоциты после воспалительной активации добавлялись к DBP. После инкубации полученный GcMAF-RF проверялся на способность активировать специфическую фагоцитарную активность макрофагов.
Для этого был валидирован способ с использованием металлических бус (Ishikawa et al., 2014). Процедура хорошо стандартизируется, не требует многостадийного получения опсонированных эритроцитов барана и высокотехнологична.
Дополнительно для оценки специфичности выделенного GcMAF-RF был разработан оригинальный метод получения лектина, позволяющий оценить эффективность отщепления хвостов сахаров и сохранения в сайте гликозилирования N-ацетилгалакозамина, который является основной молекулой, участвующей в активации макрофагов.
Для проверки соответствия DBP, выделенного с использованием в качестве аффинного лиганда актина, препарату DBP, выделяемому аффинно на 25-гидроксивитамин D3-сефарозе, и характеристики принадлеж- ности обоих полипептидов к группе специфических Gc-белков был про- веден сравнительный вестерн-блот анализ.
Прямой сравнительный вестерн- блот анализ образцов препарата с антителами против Gc-группы свидетельствует об идентичности упомя- нутых двух вариантов белков (рис. 1).
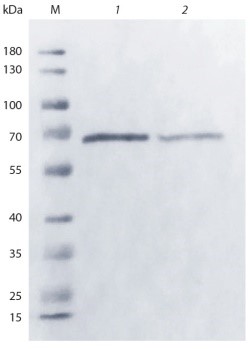
Western blot analysis of DBP samples obtained by actin and sepharose (with 25-hydroxyvitamin D3) chromatography.
После получения, конвертации и проверки специфической активности, способности активировать фагоцитарную активность макрофагов, препарат GcMAF-RF стерилизовали фильтрованием, а затем или замораживали и хранили при –70 °С, или лиофилизировали (см. рис. 1).
Биологическую активность GcMAF-RF оценивали по его влиянию на фагоцитарную функцию перитонеальных макрофагов (Ishikawa et al., 2014) (рис. 2). Было выполнено три апостериорных сравнения экспериментальных групп с контролем с использованием U-критерия Манна–Уитни с учетом поправки Бонферрони.
Показано, что по сравнению с контролем только препарат GcMAF-RF статистически значимо усиливает способность макрофагов интернализировать магнитные шарики. В присутствии GcMAF-RF фагоцитарная активность макрофагов увеличивалась в 3.7 раза ( p = 0.011), тогда как в ответ на DBP или ЛПС – в 1.2 и 1.6 раза соответственно.
Репрезентативные фотографии макрофагов (см. рис. 2, б ) четко демонстрируют, что при стимуляции препаратом GcMAF-RF (но не его предшественником DBP) в общей популяции перитонеальных макрофагов значительно возрастает число клеток с интернализованными магнитными шариками. В данном тесте оценивали биологическую активность образцов из каждой полученной партии препарата, при этом различные образцы GcMAF-RF демонстрировали трех-семикратное увеличение фагоцитарной функции макрофагов.
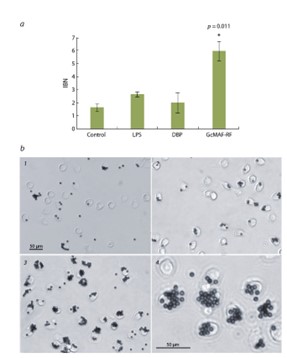
Effect of GcMAF-RF on the phagocytic activity of peritoneal macrophages.
Препарат GcMAF-RF усиливал не только фагоцитарную активность перитонеальных макрофагов, но также их способность продуцировать NO (рис. 3). Было проведено четыре апостериорных сравнения (экспериментальные группы с контролем и ЛПС и GcMAF-RF между собой) с использованием U-критерия Манна–Уитни с учетом поправки Бонферрони.
Оказалось, что GcMAF-RF (но не его предшественник DBP) статистически значимо ( p < 0.013) повышал уро- вень продукции монооксида азота, при этом уровень индуцированной NO- продукции был даже выше, чем в ответ на стандартный активатор макрофагов ЛПС ( p = 0.008).
Все перечисленные процедуры, ва- лидирующие препарат как активатор макрофагов (GcMAF-RF), постоянно проводятся для характеристики каж- дого нового выделения препарата и доведения до состояния технологии, которая готовится к сертификации.
Обсуждение
В настоящем исследовании проведена оценка биологической активности первого отечественного препарата GcMAF-RF, который был вы- делен из плазмы крови человека в соответствии с новым технологическим регламентом, разработанным компанией OOO «Активатор MAF».
Прямой сравнительный вестерн-блот анализ образцов препарата с антителами против Gc-группы показал (см. рис. 1), что молекулярная масса белков, выделенных двумя вариантами аффинной хроматографии, соответствует размеру GcMAF в 65–67 кДа, определенному другими авторами в аналогичной трис-глициновой электрофоретической системе (Smith et al., 2013).
Полученный результат свидетельствует об идентичности полипептидов, выделяемых с использовани-ем двух имеющихся в молекуле DBP доменов, различающихся по своей функциональной специфичности (актин- связывающий и витамин D3-связывающий).
В витральных тестах образцы GcMAF-RF из каждой полученной партии препарата проявляли свойства, харак- терные для макрофаг-активирующего фактора, а именно: кратно усиливали фагоцитарную функцию перитонеаль- ных макрофагов мыши (см. рис. 2), а также статистически значимо стимулировали продукцию NO (см. рис. 3).
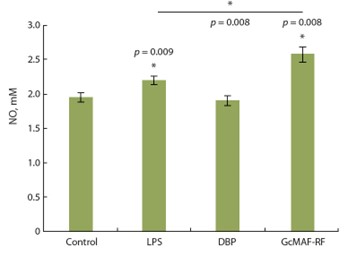
Effect of the drug GcMAF-RF on the production of NO.
Выявленные в нашем исследовании факты стимули- рующего влияния полученного препарата GcMAF-RF на свойства макрофагов согласуются с данными целого ряда исследователей (Mohamad et al., 2002; Thyer et al., 2013b; Ishikawa et al., 2014; Ruggiero et al., 2014; Saburi et al., 2017a, b). Это позволяет заключить, что препарат GcMAFRF соответствует известным импортным аналогам не только по своим физико-химическим характеристикам, но и по проявляемой биологической активности.
Следующие два сообщения будут содержать результаты по влиянию препарата GcMAF-RF на культуру дендрит- ных клеток и поляризацию М2-макрофагов. Также будет продемонстрирована способность активированных пре- паратом GcMAF-RF перитонеальных макрофагов лизи- ровать клетки нескольких опухолевых культур и оценена его противораковая активность в биологических тестах на экспериментальных животных.
Заключение
Представлены первые экспериментальные данные, характеризующие способность препарата GcMAF-RF, полученного оригинальным способом, активировать перитонеальные макрофаги мыши, что проявляется кратным усилением их фагоцитарной функции и значимым по-вышением уровня продукции монооксида азота.
Выделенный активатор макрофагов (GcMAF-RF) по своим характеристикам соответствует аналогичным препаратам, представляемым на рынке зарубежными компаниями, и может рассматриваться как новый отечественный биологически активный фактор разнонаправленного действия.
Конфликт интересов
Соавторы статьи А.С. Проскурина и С.С. Богачев являются директорами компаний «Активатор МАФ» и «БА Фарма» соответственно.
Ссылки
Гржибовский А.М. Анализ трех и более независимых групп коли- чественных данных. Экология человека. 2008;3:50-58. Гржибовский А.М. Анализ трех и более независимых групп количественных данных. Экология человека = Экология человека. 2008; 3:50-58.
Останин А.А., Кирикович С.С., Долгова Е.В., Проскурина А.С., Черных Е.Р., Богачев С.С. Тернистый путь макрофаг-активиру- фактора (GcMAF): от открытия к клинической практике. Вавиловский журнал генетики и селекции. 2019; 23(5):624-631. DOI 10.18699/VJ19.535. [Останин А.А., Кирикович С.С., Долгова Е.В., Проскурина А.С., Черных Е.Р., Богачев С.С. Тернистый путь активации макрофагов коэффициент (GcMAF): от скамьи до постели больного. Вавиловский журнал Генетика и селекция = Вавиловский журнал генетики и селекции. 2019; 23(5):624-631. DOI 10.18699/VJ19.535. (на русском)]
Асаока Ю., Ота М., Йошида К., Сасаки Ю., Нисидзука Ю. Роль лизофосфатидилхолина в активации Т-лимфоцитов: вовлечение фосфолипазы А2 при сигнальной трансдукции через протеинкиназу С. Proc. Natl. Acad. Sci. США. 1992; 89(14):6447-6451. DOI: 10.1073/ ПНАС.89.14.6447.
Борхес К.Р., Редер К.Р. Гликановая структура белка Gc Активирующий фактор макрофагов по данным масс-спектрометрии. Арх. Биофиз. 2016;606:167-179. DOI 10.1016/j.abb. 2016.08.006.
Кассетта Л., Кассол Э., Поли Г. Поляризация макрофагов в здоровье и болезнь. Sci. World J. 2011;11:2391-2402. DOI 10.1100/2011/213962.
Деланге Дж.Р., Шпиккерт Р., Шпиккерт М.М. За кулисами Белок, связывающий витамин D: больше, чем связывающий витамин D. Лучшая практика. Res. Clin. Эндокринол. Метаб. 2015; 29(5):773-786. DOI 10.1016/ Дж.Бим.2015.06.006.
де Соуза М.Г., Гросси А.Л., Перейра Э.Л., да Круз К.О., Мендес Ф.М., Камерон Л.С., Пайва К.Л. Иммобилизация актина на хитине для очищения миозин II: лабораторное упражнение, объединяющее понятия молекулярная клеточная биология и химия белков. Биохимия. Mol. Biol. Educ., 2008; 36(1):55-60. DOI 10.1002/bmb.122.
Гордон С. Альтернативная активация макрофагов. Nat. Rev. Immunol. 2003; 3(1):23-35. DOI 10.1038/nri978.
Грин Л.С., Вагнер Д.А., Глоговски Я., Шкипер.Л., Вишнок Ю.С., Танненбаум С.Р. Анализ нитратов, нитритов и [15N]нитратов в биологических Жидкости. . Биохим. 1982; 126(1):131-138. DOI 10.1016/ 0003-2697(82)90118-Х.
Грейлбергер Дж., Хервиг Р. Витамин D – дегликозилированный витамин D-связывающий белковый димер: положительное синергическое действие на узнавание, активацию, фагоцитоз и окислительный стресс макрофагов. Клин. Лаборатория. 2020; 66(1):169-177. DOI 10.7754/Clin.Lab.2019.191121.
Хаддад Дж.Г., Ковальски М.А., Сэнгер Дж.В. Актиновая аффинная хроматография при очистке плазмы человека, птиц и других млекопитающих белки, связывающие витамин D и его метаболиты (глобулины Gc). Биохимия. J. 1984; 218(3):805-810. DOI 10.1042/bj2180805.
Хаммарстрем С., Кабат Е.А. Исследования специфичности и связующих свойств реактивного гемагглютинина группы крови А из Хеликса Поматия. Биохимия. 1971; 10(9):1684-1692. DOI 10.1021/bi00 785А028.
Инуи Т., Амитани Х., Кубо К., Кучике Д., Уто Ю., Нисиката Т., Метте М. Клинический случай: пациент с немелкоклеточным раком легкого лечился с GcMAF, сонодинамической терапией и полями лечения опухолей. Противоопухолевой Резолюция 2016a;36:3767-3770. ПМИД: 27354652.
Инуи Т., Кацуура Г., Кубо К., Кучиике Д., Ченери Л., Уто Ю., Нисиката Т., Метте М. Клинический случай: Лечение GcMAF у пациента с рассеянный склероз. Anticancer Res. 2016b;36:3771-3774. ПМИД: 27354653.
Инуи Т., Кучике Д., Кубо К., Метте М., Уто Ю., Хори Х., Сакамото Н. Клинический опыт интегративной иммунотерапии рака с ГцМАФ. Противораковая резолюция 2013 г.; 33(7):2917-2919. ПМИД: 23780980
Иоанну Ю.А., Бишоп Д.Ф., Десник Р.Дж. альфа-галактозидаза А приводит к ее внутриклеточной агрегации, кристаллизации в лизосомах и селективной секреции. J. Cell Biol., 1992; 119:1137-1150. DOI 10.1083/jcb.119.5.1137.
Исикава М., Иноуэ Т., Инуи Т., Кучиике Д., Кубо К., Уто Ю., Нисиката T. Новая система анализа активности макрофаг-активирующих факторов с использованием клеточной линии U937 человека. Противораковая резолюция 2014 г.; 34(8): 4577-4581. ПМИД: 25075102.
Кискер О., Онидзука С., Беккер К.М., Фэннон М., Флинн Э., Д’Амато Р., Зеттер Б., Фолкман Дж., Рэй Р., Свами Н., Пири-Шеперд С. Витамин D-связывающий белок-фактор активации макрофагов (DBP-maf) Ингибирует ангиогенез и рост опухоли у мышей. Неоплазия. 2003; 5(1):32-40. DOI 10.1016/S1476-5586(03)80015-5.
Клокол Д., Теппоне М. Лечение метастатической колоректальной карциномы с GcMAF Forte и пептидами тимуса: клинический случай. Дж. Ячейка. Иммунол. 2016;7:4. DOI: 10.4172/2155-9899.1000449.
Корбелик М., Нарапараджу В.Р., Ямамото Н. Макрофаг-направленная иммунотерапия в качестве вспомогательного средства к фотодинамической терапии рака. Бр. Рак. 1997; 75(2):202-207. DOI 10.1038/bjc.1997.34.
Корбелик М., Нарапараджу В.Р., Ямамото Н. Значение сывороточного α-нацетилгалактозаминидазы Измерение для оценки опухоли ответ на радио- и фотодинамическую терапию. Br. J. Cancer. 1998; 77:1009-1014. DOI 10.1038/bjc.1998.166.
Кучиике Д., Уто Ю., Мукай Х., Исияма Н., Абэ К., Танака Д., Каваи Т., Кубо К., Метте М., Инуи Т., Эндо Ю., Хори Х. Дегалактозилированный/ Дезиалированная сыворотка крови человека, содержащая GcMAF, индуцирует макрофаги фагоцитарная активность и противоопухолевая активность in vivo. Противоопухолевой Резолюция 2013 г.; 33(7):2881-2885. ПМИД: 23780974.
Ламанья К., Орранд-Лайонс М., Имхоф Б.А. Двойная роль макрофагов в опухолевом росте и ангиогенезе. J. Leukoc. Biol., 2006; 80(4):705- 713. DOI 10.1189/jlb.1105656.
Линк Р.., Перлман К.Л., Пирс Э.А., Шнос Х.К., ДеЛука Х.Ф. Очищение витамин-D-связывающего белка сыворотки крови человека 25-гидроксивитамином D3-сефарозная хроматография. . Биохим. 1986; 157(2):262-269. DOI 10.1016/0003-2697(86)90624-x.
Малик С., Фу Л., Юрас Д.Дж., Кармали М., Вонг Б.Ю., Гоздзик А., Коул Д.Е. Распространенные варианты гена белка, связывающего витамин D и неблагоприятные последствия для здоровья. Преподобный Клин. 2013; 50(1): 1-22. DOI: 10.3109/10408363.2012.750262.
Мацуура Т., Уэмацу Т., Ямаока М., Фурусава К. Влияние слюны аденокарцинома железы клеточного происхождения α-N-ацетилгалактозаминидаза на Биологическая активность фактора активации макрофагов. Int. J. Oncol. 2004; 24(3):521-528. DOI 10.3892/ijo.24.3.521.
Мохамад С.Б., Нагасава Х., Уто Ю., Хори Х. Получение Gc-белка производный фактор активации макрофагов (GcMAF) и его структурный фактор характеристика и биологическая активность. Противораковая резолюция 2002 г.; 22(6К):4297-4300. ПМИД: 12553073.
Моссер Д.М. Многогранность активации макрофагов. J. Leukoc. Biol., 2003; 73(2):209-212. DOI 10.1189/jlb.0602325.
Мойя Р., Чан М.К.С., Клокол Д., Пан С.И. Активная специфическая иммунотерапия (ASI) и GcMAF Forte в лечении метастатических инвазивных Карцинома – обзор терапевтических методов и клинический случай сообщать. Дж. Exp. Immunol. 2018; 3(2):1-4.
Мюррей.Дж., Винн Т.А. Защитные и патогенетические функции макрофагов Подмножества. Nat. Rev. Immunol. 2011;11:723-737. DOI: 10.1038/ НРИ3073.
Нагасава Х., Уто Ю., Сасаки Х., Окамура Н., Мураками А., Кубо С., Кирк К.Л., Хори Х. Белок Gc (витамин D-связывающий белок): генотипирование Gc и активность прекурсоров GcMAF. Противораковая резолюция 2005 г.; 25: 3689-3696. ПМИД: 16302727.
Нарапараджу В.Р., Ямамото Н. Роль β-галактозидазы В-лимфоцитов и сиалидаза Т-лимфоцитов при активации, вызванной воспалением макрофагов. Иммунол. Lett., 1994; 43(3):143-148. ДОЙ 10.1016/0165-2478(94)90214-3.
Нгвенья Б.З., Ямамото Н. Влияние продуктов воспаления на иммунную систему Системы. Лизофосфатидилхолин стимулирует макрофаги. Рак Иммунол. Иммунотер. 1986; 21(3):174-182. DOI 10.1007/ БФ00199358.
Пачини С., Пунци Т., Моруччи Г., Гулизано М., Руджеро М. Эффекты витамин-D-связывающий белок, макрофаг-активирующий фактор на клетках рака молочной железы человека. Противораковая резолюция 2012 г.; 32(1):45-52. ПМИД: 22213287.
Пэдурару Д.Н., Буариу А., Ион Д., Андроник О., Думитрашку М.С., Болокан А. Соображения относительно лечения GcMAF молочной железы рак. Rom. Biotechnol. Lett., 2019; 24(5):851-855. DOI: 10.25083/ РБЛ/24.5/851.855.
Редер Д.С., Нельсон Р.В., Борхес К.Р. Статус гликозилирования витамина D-связывающий белок у онкологических больных. Protein Sci., 2009; 18(10): 2036-2042. DOI 10.1002/pro.214.
Руджеро М., Рейнвальд Х., Пачини С. Отвечает ли хондроитин сульфат за биологический эффект, приписываемый макрофагу, полученному из белка GC Активирующий фактор (GcMAF)? Гипотезы. 2016; 94: 126-131. DOI 10.1016/j.mehy.2016.07.012.
Руджеро М., Уорд Э., Смит Р., Бранка Дж.Дж., Ноакс Д., Моруччи Г., Таубманн М., Тьер Л., Пачини С. Олеиновая кислота, дегликозилированный витамин D-связывающий белок, оксид азота: молекулярная триада, ставшая смертельной для рак. Противораковая резолюция 2014 г.; 34(7):3569-3578. ПМИД: 24982371.
Сабури Э., Сабури А., Ганей М. Перспективная роль Gc-MAF при раке Иммунотерапия: от скамьи до постели больного. Каспиан Дж. Мед. 2017г; 8(4):228-238. DOI 10.22088/cjim.8.4.228.
Сабури Э., Тавакол-Афшари Дж., Биглари С., Мортазави Ю. Является ли α-N-ацетилгалактозаминидаза Ключ к лечению рака? Мини-обзор и гипотеза. ДЖБУОН. 2017б; 22(6):1372-1377. ПМИД: 29332325.
Сика А., Бронте В. Измененная дифференцировка макрофагов и иммунная дисфункция в опухолевом развитии. Дж. Вкладывать. 2007; 117(5):1155- 1166. DOI 10.1172/JCI31422.
Смит Р., Тайер Л., Уорд Э., Меаччи Э., Бранка ДЖ.ДЖ.В., Моруччи Г., Гулизано М., Руджеро М., Пачини А., Патерностро Ф., Маннелли Л.Д.К., Ноукс Д.Дж., Пачини С. Эффекты фактора активации Gc-макрофагов в нейронах человека; Значение для лечения хронической усталости синдром. Am. J. Immunol. 2013; 9(4):120-129. DOI 10.3844/ajisp. 2013.120.129.
Спудич Дж.А., Уотт С. Регуляция сокращения скелетных мышц кролика. I. Биохимические исследования взаимодействия тропомиозинтропонина комплекс с актином и протеолитическими фрагментами миозина. J. Biol. Chem. 1971; 246(15):4866-4871. ПМИД: 4254541.
Свами Н., Рэй Р. 25-гидрокси[26,27-метил-3H]витамин D3-3β- (1,2-эпоксипропил)эфир: реагент для аффинного мечения витаминов человека D-связывающий белок. Арх. Биофиз. 1995; 319(2):504- 507. DOI 10.1006/abbi.1995.1323.
Тайер Л., Уорд Э., Смит Р., Бранка Дж.Дж., Моруччи Г., Гулизано М., Ноакс Д., Эслингер Р., Пачини С. Макрофаги, полученные из белка GC, активирующие снижает уровень α-N-ацетилгалактозаминидазы в онкологические больные на поздних стадиях. Онкоиммунология. 2013г; 2(8):e25769. DOI 10.4161/onci.25769.
Тайер Л., Уорд Э., Смит Р., Фиоре М.Г., Магерини С., Бранка Дж.Дж., Моруччи Г., Гулисано М., Руджеро М., Пачини С. Новая роль для Основной компонент оси витамина D: белок, связывающий витамин D, полученный Фактор активации макрофагов индуцирует рак молочной железы человека апоптоз клеток через стимуляцию макрофагов. Питательных веществ. 2013б; 5(7):2577-2589. DOI: 10.3390/nu5072577.
Тойохара Ю., Хаситани С., Кишимото Х., Ногучи К., Ямамото Н., Урад М. Ингибирующее действие витамина D-связывающего белка, полученного из Фактор активации макрофагов на ДМБА-индуцированной щеке хомяка канцерогенез мешочка и производная от него клеточная линия карциномы. Онкол. Lett., 2011; 2(4):685-691. DOI 10.3892/ol.2011.306.
Угарте А., Буше Г., Мехеус Л. Несоответствия и сомнительная надежность публикации «Иммунотерапия метастатических колоректальных заболеваний рак с активацией макрофагов, полученных из витамина D, белок, полученных из макрофагов, GcMAF» by Yamamoto et al. Cancer Immunol. Иммунотер. 2014; 63(12):1347-1348. DOI 10.1007/s0262-014-1587-y.
Ямамото Н. Структурное определение мощного активирующего макрофага фактор, полученный из витамина D3-связывающего белка, обладающего адъювантной активностью для выработки антител. Mol. Immunol. 1996;33:1157-1164. ПМИД: 8360493.
Ямамото Н., Хомма С. Белок, связывающий витамин D3 (группоспецифический компонента) является предшественником сигнала, активирующего макрофаги фактор из лимфоцитов, обработанных лизофосфатидилхолином. Proc. Natl. Acad. Sci. США. 1991; 88(19):8539-8543. DOI 10.1073/pnas. 88.19.8539.
Ямамото Н., Кумаширо Р. Конверсия белка, связывающего витамин D3 (группоспецифический компонент) к фактору активации макрофагов путем ступенчатое действие бета-галактозидазы В-клеток и сиалидазы Т-клетки. Ж. Иммунол. 1993; 151(5):2794-2802. ПМИД: 8360493.
Ямамото Н., Нарапараджу В.Р., Асбелл С.О. Дегликозилирование сыворотки витамин D3-связывающий белок приводит к иммуносупрессии при раке Пациентов. Cancer Res. 1996; 56(12):2827-2831. ПМИД: 8665521.
Ямамото Н., Суяма Х., Ямамото Н. Иммунотерапия предстательной железы рак с макрофаг-активирующим фактором, полученным из белка Gc, ГцМАФ. Пер. онкол. 2008; 1(2):65-72. DOI 10.1593/tlo.08106.
Подтверждения
Авторы выражают благодарность руководителю Центра коллективного доступа «Клеточные технологии» Института цитологии и генетики РАН, г. Новосибирск, для доступа к микроскопу. Работа выполнена при поддержке компаний «Активатор МАФ» и «БА Фарма», а также Госбюджетного проекта 0324-2019-0042 (регистрационный номер АААА-А17-117071240065-4).
Информация об авторе
Е.В. Левитес, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия .
С.С. Кирикович, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия .
Е.В. Долгова, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия .
А.С. Проскурина, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия .
Г.С. Риттер, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия, Новосибирский национальный исследовательский государственный университет, Новосибирск, Россия .
А.А. Останин, Научно-исследовательский институт фундаментальной и клинической иммунологии, Новосибирск, Россия .
Е.Р. Черных, Научно-исследовательский институт фундаментальной и клинической иммунологии, Новосибирск, Россия.
С.С. Богачев, Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия.
