MDPI journals Nutrients 2013, 5(7), 2577-2589
Lynda Thyer ,Emma Ward ,Rodney Smith ,Maria Giulia Fiore ,Stefano Magherini ,Jacopo J. V. Branca ,Gabriele Morucci ,ORCID,Massimo Gulisano ,Marco Ruggiero , andStefania Pacini
A Novel Role for a Major Component of the Vitamin D Axis: Vitamin D Binding Protein-Derived Macrophage Activating Factor Induces Human Breast Cancer Cell Apoptosis through Stimulation of Macrophages
Новая роль основного компонента оси витамина D: белок, связывающий витамин D, фактор активации макрофагов, индуцирующий апоптоз клеток рака молочной железы человека посредством стимуляции макрофагов
Роль витамина D в поддержании здоровья оказывается большей, чем первоначально предполагалось, а концепция оси витамина D подчеркивает сложность биологических событий, контролируемых биологически активным витамином D (1,25(OH)(2)D3), его двумя связывающие белки, которыми являются рецептор витамина D (VDR) и фактор активации макрофагов, производный от связывающего витамин D белка (GcMAF).
В этом исследовании мы показываем, что GcMAF стимулирует макрофаги, которые, в свою очередь, атакуют клетки рака молочной железы человека, вызывают их апоптоз и, в конечном итоге, фагоцитируют их.
Эти результаты согласуются с наблюдением, что макрофаги проникают в имплантированные опухоли у мышей после инъекций GcMAF.
Кроме того, мы предполагаем, что последние 23 гидрофобные аминокислоты VDR, расположенные во внутренней части плазматической мембраны, взаимодействуют с первыми 23 гидрофобными аминокислотами GcMAF, расположенными во внешней части плазматической мембраны.
Это позволяет 1,25(OH)(2)D3 и олеиновой кислоте оказаться зажатыми между двумя витамин D-связывающими белками, тем самым постулируя новый молекулярный способ взаимодействия между GcMAF и VDR. В совокупности эти результаты подтверждают и усиливают гипотезу о том, что GcMAF обладает множественными биологическими активностями, которые могут быть ответственны за его противораковые эффекты, возможно, за счет молекулярного взаимодействия с VDR, который, в свою очередь, отвечает за множество негеномных, а также геномных эффектов. последствия.
Ключевые слова:
Витамин Д ; макрофаги ; рак молочной железы ; человек ; апоптоз
Графическая абстракция
- Введение
Так называемая ось витамина D участвует в различных аспектах рака молочной железы человека, самой распространенной опухоли человека. Ось витамина D состоит из биологически активной формы витамина D (1,25(OH)(2)D3) и двух белков, которые специфически связывают его. Этими белками являются рецептор витамина D (VDR) и белок, связывающий витамин D, который является предшественником фактора активации макрофагов, связывающего витамин D, также называемого GcMAF [ 1 ]. Роль витамина D в развитии рака молочной железы у человека подтверждается количеством опубликованных исследований по этой теме [ 2 ].
Однако более интригующим является относительный недостаток информации о GcMAF и раке молочной железы человека; Фактически в рецензируемой литературе на сегодняшний день (май 2013 г.) имеется всего четыре исследования по этой теме. В двух из этих исследований эффекты GcMAF наблюдались на линии клеток рака молочной железы человека MCF-7 in vitro [ 3 , 4 ].
В другом исследовании изучался статус гликозилирования белка, связывающего витамин D, у больных раком, включая больных раком молочной железы [ 5 ], тогда как в менее недавнем исследовании сообщалось об эффектах введения GcMAF пациентам с метастатическим раком молочной железы [ 6 ].
Интересно отметить, что до сих пор не было проведено никаких исследований, чтобы оценить, действительно ли GcMAF, который является известным мощным активатором макрофагов, способен активировать макрофаги, которые, в свою очередь, могут «атаковать» клетки рака молочной железы человека. Имеются косвенные данные, свидетельствующие о том, что GcMAF активирует макрофаги, которые инфильтрируют экспериментальные опухоли на животных моделях [ 7 , 8 ].
Однако эти доказательства являются косвенными и, что самое важное, относятся к экспериментальным опухолям, отличным от рака молочной железы человека. Кроме того, поскольку приведенные выше наблюдения проводились на экспериментальных животных, наличие мешающих факторов, связанных со сложностью ответов всего организма на наличие трансплантированных или распространённых опухолей, ограничивает возможность интерпретации представленных результатов.
Поэтому, чтобы восполнить этот пробел в знаниях, мы провели эксперименты, чтобы предоставить четкие доказательства того, что GcMAF, как часть оси витамина D, активирует нормальные макрофаги, которые, в свою очередь, оказывают противоопухолевое действие против клеток рака молочной железы человека без присутствия смешанные факторы.
- Экспериментальный участок
Очищенный GcMAF с проверенной активностью был получен от Immuno Biotech Ltd., Гернси, Нормандские острова. Парикальцитол был произведен в Эбботте, Рим, Италия. Все остальные реагенты были от Sigma Aldrich, Милан, Италия.
2.1. Сотовые линии
Клетки рака молочной железы человека (линия клеток MCF-7) были получены из Istituto Zooprofilattico Sperimentale della Lombardia e dell’Emilia-Romagna, Брешиа, Италия. Клетки обычно поддерживали при 37°C во влажной атмосфере с 5% CO 2 в минимально необходимой среде Игла в сбалансированном солевом растворе Эрла с добавлением 1 мМ пирувата натрия, 10% фетальной бычьей сыворотки (FBS), 100 ед/мл пенициллина, и 100 мкг/мл стрептомицина (Invitrogen, Карлсбад, Калифорния, США). 1,25(OH)(2)D3 в культуральной среде не присутствовал. В экспериментах по совместному культивированию макрофаги (клеточная линия Raw 264.7, Коллекция культур HPA) активировали путем их культивирования в той же среде, что и клетки MCF-7, и в присутствии 100 нг/мл GcMAF в течение 72 ч перед добавлением к культуре. Культура клеток MCF-7. Концентрация GcMAF была установлена с помощью предварительных экспериментов, показывающих линейную кривую зависимости от дозы.
Первоначальный ответ наблюдался при концентрации 1 нг/мл, а плато достигалось при концентрации 100 нг/мл. Эти концентрации соответствовали ранее полученным результатам [ 3 , 4 ].
Перед добавлением в культуру клеток MCF-7 макрофаги осторожно центрифугировали и ресуспендировали в свежей среде во избежание переноса GcMAF в совместную культуру.
Таким образом, мы могли исключить прямое воздействие GcMAF на клетки MCF-7. Макрофаги добавляли в соотношении 1:1 к культуре клеток MCF-7. Затем клеткам давали возможность осесть в течение 1 часа перед покадровой фотографией. Фотография была сделана в течение 7 дней с использованием микроскопа Olympus CK2 и GXCAM-3 с программным обеспечением NCH Debut.
В экспериментах, описанных на рисунках 1А и 2 , клетки фиксировали и окрашивали, как описано ниже, через 40 часов после их совместного культивирования.
2.2. Исследование клеточной морфологии
Морфологию клеток изучали методом фазово-контрастной микроскопии с использованием инвертированного микроскопа Optika (модель XDS-2; Optika Microscopes, Бергамо, Италия).
Этот микроскоп имел пластинку с положительной фазой для получения фазово-контрастных изображений под конденсорной линзой с большим рабочим расстоянием и цифровую камеру 8 Мп с ЖК-экраном (Optika Microscopes, Бергамо, Италия). Источником света служил галогенный предцентрированный осветитель напряжением 6 В/30 Вт с регулируемой интенсивностью.
Фазово-контрастную визуализацию проводили на живых клетках без какой-либо фиксации или обработки. Для каждой экспериментальной точки записывали серию цифровых изображений живых клеток и выбирали наиболее репрезентативные.
Также проводили окраску гематоксилин-эозином и Папаниколау.
Последнее окрашивание приводит к получению очень прозрачных клеток, поэтому можно регистрировать даже более толстые образцы с перекрывающимися клетками. Вкратце, клетки окрашивали гематоксилином Харриса в качестве ядерного красителя. Orange G и EA-65 (светло-зеленый, бисмарк-коричневый и эозин) использовали для окрашивания цитоплазмы (Sigma Aldrich, Милан, Италия).
Слайды фиксировали постоянной средой для монтажа и наблюдали под световой микроскопией (Nikon Instruments SpA, Милан, Италия). Представленные изображения представляют собой типичные экспериментальные данные. Каждый эксперимент проводился с учетверенными образцами и повторялся трижды.
2.3. Исследование пролиферации клеток
Оценку пролиферации клеток определяли с помощью набора для быстрой пролиферации клеток Calbiochem (Calbiochem, DBA, Милан, Италия) [ 9 ]. Каждое условие повторялось с четырехкратными образцами, а каждый эксперимент повторялся три раза. Различия между экспериментальными значениями оценивали с помощью t -критерия Стьюдента .
2.4. Исследование расположения и функций аминокислот
Анализы проводились на нуклеотидных и аминокислотных последовательностях генов, кодирующих витамин D-связывающий белок/GcMAF (предшественник изоформы 1; gi|324021743|ref|NP_001191235.1) и VDR (gi|38511972|gb|AAH60832.1). ) у человека разумного. Что касается выравнивания белков, были приняты во внимание три параметра:
— идентичность последовательности
— сходство последовательностей
— гидрофобный профиль
Эти критерии были оценены, поскольку они определяют качество выравниваний. Кроме того, мы оценили функциональную ценность замененных аминокислот, т . е. важность, которую приобретает любое расхождение внутри последовательности.
Полученные значения позволили складывать баллы, а не умножать их при глобальном расчете баллов выравнивания. Информация о выбранных генах была получена из базы данных Калифорнийского университета в Санта-Крус [ 10 ] со ссылкой на последнюю опубликованную версию генома человека [ 11 ].
В частности, мы использовали таблицу refGene, содержащую все гены, кодирующие и некодирующие белки. Таким образом удалось получить подробную информацию о генах человека, такую как: хромосома, положение начала и конца транскрипции, положение начала и конца кодирующей части, а также количество и положение экзонов. Аннотации для генов были получены с помощью алгоритма LiftOver [ 12 ].
Наличие консервативных элементов в выравнивании проверялось с использованием информации, содержащейся в таблице phastConsElements28way базы данных UCSC. Эта таблица содержит прогнозы консервативных элементов, полученные программой phastCons.
Позиции были доложены на выравнивании. Все операции, от поиска геномной информации до создания выравниваний, выполнялись с использованием статистического математического программного обеспечения R. После выравнивания последовательностей учитывали столбцы остатков.
Любой выстроенный в ряд остаток следует считать неявно связанным с эволюцией. Гидрофобный профиль был получен с помощью программного обеспечения на сайте [ 13 ].
Среди нескольких систем, которые можно использовать для расчета индекса гидрофобности/гидрофильности аминокислотной последовательности, мы выбрали метод Кайта и Дулитла [ 14 ].
Трехмерные белковые структуры витамина D-связывающего белка и VDR были получены с использованием архива PDB [ 15 ].
Суперпозиция между двумя структурами стала возможной благодаря использованию программного обеспечения Swiss Pdb Viewer [ 16 ].
Архив PDB содержит информацию об экспериментально установленных структурах белков, нуклеиновых кислот и сложных ансамблей.
SwissPdb Viewer — это приложение, предоставляющее интерфейс, позволяющий анализировать несколько белков одновременно. Белки можно накладывать друг на друга, чтобы определить структурное выравнивание и сравнить их активные центры или любые другие соответствующие части. Мутации аминокислот, Н-связи, углы и расстояния между атомами легко получить благодаря интуитивно понятному графическому интерфейсу и меню.
- Результаты
При совместном культивировании с клетками рака молочной железы человека в отсутствие GcMAF макрофаги не взаимодействовали с клетками рака молочной железы человека, и их характерная нерегулярная морфология сохранялась ( рис. 1А ).
В цитоплазме макрофагов можно наблюдать небольшое количество вакуолей или их отсутствие, что является косвенным свидетельством отсутствия активации. Как описано ранее, клетки рака молочной железы человека имеют типично неоднородную морфологию: некоторые клетки крупнее других.
Морфология клеток была неправильно-полигональной. Как и ожидалось, клетки рака молочной железы человека имели тенденцию расти одна на другой, образуя кластеры, что отражало характерную потерю контактного торможения.
На фигуре 1B изображена фазово-контрастная микрофотография кластера клеток рака молочной железы человека, культивированных в отсутствие макрофагов или каких-либо других добавок. Раковые клетки видны как многослойные тяжи клеток в центре рисунка.
При большем увеличении ( рис. 1С ) клетки выглядели плотно упакованными, с линейными, нефрагментированными краями и с четко распознаваемой организацией хроматина внутри ядра, что указывает на сильную синтетическую активность, совместимую с высокой скоростью пролиферации этих клеток. клетки. Ядрышки хорошо видны. На фигуре 1D показано окрашивание по Папаниколау только клеток рака молочной железы человека; значительное скопление можно наблюдать в левой нижней части изображения.
Ядра выглядят сильно окрашенными, как и ожидалось в растущих раковых клетках.
Периметр ячеек линейный, без углублений и признаков фрагментации. Также хорошо заметны пустые (белые) участки в лунке. Они представляют собой обнаженные участки пластиковой лунки, отражающие потерю адгезии, типичную для раковых клеток. Потеря приверженности является предпосылкой отслоения клеток, инвазивности и метастатического потенциала.
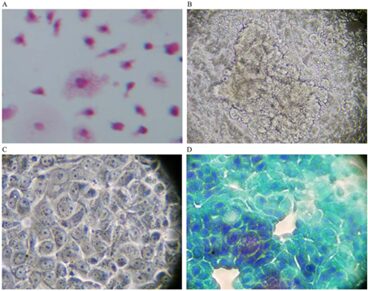
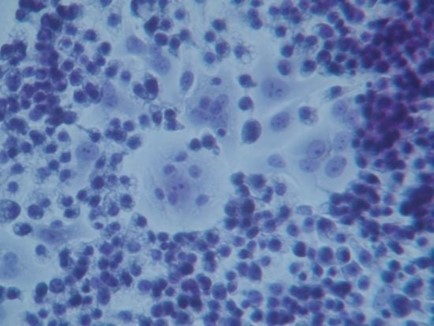
Рисунок 1. ( А ) Окрашивание гематоксилин-эозином (увеличение 300×); в отсутствие GcMAF мелкие макрофаги, по-видимому, не взаимодействуют с клетками рака молочной железы человека MCF-7. Изображение относится к 40-часовому совместному культивированию. ( Б ) Фазово-контрастная микрофотография (300×) скопления раковых клеток в центре. ( C ) При большем увеличении (1200×) клетки кажутся плотно упакованными. ( D ) окрашивание по Папаниколау (1200×); кластер в левой нижней части изображения. Ядра сильно окрашены, периметр клеток линейный, без углублений и признаков фрагментации.
Однако когда клетки рака молочной железы человека совместно культивировали с макрофагами, которые ранее были активированы GcMAF (100 нг/мл) в течение 72 часов, картина была совершенно иной, как показано на рисунках 2 и 3 .
На фотографиях показано совместное культивирование GcMAF-активированных макрофагов и клеток рака молочной железы человека после 40-часовой инкубации. GcMAF-активированные макрофаги выглядели как маленькие клетки, окружающие клетки рака молочной железы человека. На рисунке 2А (окрашивание по Папаниколау) четко видна группа клеток рака молочной железы человека в центре изображения, окруженная сотнями мелких макрофагов.
При большем увеличении ( рис. 2В ) одна клетка рака молочной железы человека кажется полностью окруженной макрофагами, которые также можно наблюдать на верхней части клетки. Ядро макрофагов хорошо окрашено, тогда как хроматин в ядре раковой клетки выглядит фрагментированным и дезорганизованным.
Однако ядрышки все еще можно распознать; это явление можно интерпретировать как показатель остаточной синтетической активности, ожидаемой в клетках, подвергающихся активному апоптозу.
Цитоплазма макрофагов выглядит вакуолизированной, что указывает на активный фагоцитоз.
На рисунке 2C показано еще одно поле, где две крупные клетки рака молочной железы человека окружены GcMAF-активированными макрофагами, которые, по-видимому, испускают цитоплазматические выступы, которые ищут контакт с мембраной раковых клеток. Ячейка в центре рисунка 2 C при большем увеличении ( рис. 2 D) демонстрирует необычный вид; хроматин в ядре выглядит фрагментированным, а в правом нижнем углу цитоплазма выглядит изрезанной, как будто два макрофага в этой области активно деконструируют цитоплазматическую сборку раковой клетки. Аналогичное явление можно наблюдать слева, где два макрофага вдавливают цитоплазматический профиль раковой клетки.
Стоит отметить, что все эти морфологические изменения согласуются с индукцией апоптоза клеток рака молочной железы человека активированными макрофагами [ 17 ]. В частности, некоторые морфологические изменения соответствовали ранним фазам апоптоза, а морфология ядра клеток рака молочной железы человека, показанная на рисунке 2 , практически сопоставима с морфологией, представленной на рисунке 1 (левая панель) Hacker, 2000 [ 17] . ].
Даже изменения в морфологии цитоплазмы соответствовали индукции апоптоза GcMAF-активированными макрофагами, а цитоплазма клеток рака молочной железы человека демонстрировала типичный образец распада, который предшествует образованию апоптотических телец. Кроме того, в этом случае морфология цитоплазмы раковых клеток удивительно похожа на представленную на рисунке 1 (средняя панель) Hacker, 2000 [ 17 ].
Хотя наблюдаемые здесь морфологические особенности наводят на мысль об активном апоптозе, дальнейшие исследования с использованием тестов ELISA для количественного определения уровня человеческого активного белка каспазы-3, основной протеазы-исполнителя апоптоза, позволят количественно определить степень апоптоза, индуцированного GcMAF-активированными макрофагами.
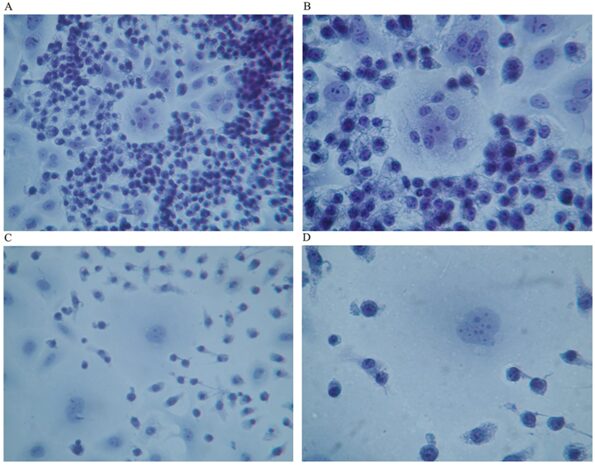
Рисунок 2. Совместное культивирование GcMAF-активированных макрофагов и клеток рака молочной железы человека; Окраска по Папаниколау. ( А ) Раковые клетки в центре окружены сотнями мелких макрофагов (100×). ( Б ) Одна клетка рака молочной железы человека полностью окружена макрофагами, которые также можно наблюдать на верхней части клетки (200×). ( C ) Две большие раковые клетки окружены GcMAF-активированными макрофагами (100×). ( D ) Та же ячейка (200×); хроматин в ядре фрагментирован, а в правом нижнем углу цитоплазма должна быть с углублением, как если бы два макрофага в этой области активно разрушали цитоплазму раковой клетки.
Покадровая микрофотография показывает, что примерно через семь дней совместного культивирования GcMAF-активированных макрофагов с клетками рака молочной железы человека неравномерный рост клеток карциномы молочной железы был остановлен, а биомасса крупных выступающих клеток уменьшилась.
На рисунке 3А показаны клетки рака молочной железы человека и GcMAF-активированные макрофаги в первый день; раковые клетки, как и ожидалось, образуют неравномерный слой, покрывающий поле наблюдения.
Можно распознать отдельные раковые клетки, а также обнаженные участки пластины, как описано выше. GcMAF-активированные макрофаги выглядят как маленькие клетки, которые прикрепляются к раковым клеткам, в большинстве случаев над ними.
Интересно отметить, что на обнаженных участках пластины почти не наблюдается макрофагов, что подтверждает наблюдение о том, что GcMAF-активированные макрофаги стремятся к контакту с раковыми клетками.
После семи дней совместной инкубации ( рис. 3В ) ни одна раковая клетка не может быть распознана. После апоптоза, индуцированного макрофагами, их апоптотические тельца группируются вместе в центре поля наблюдения, и большая часть поля пуста от раковых клеток.
Большинство GcMAF-активированных макрофагов окружают и проникают в массу остатков раковых клеток в центре.
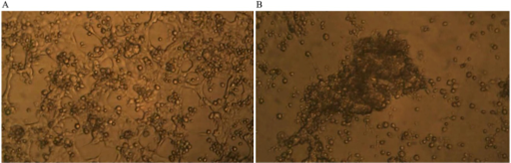
Рисунок 3. Фазово-контрастная микрофотография, полученная при покадровой записи совместной культуры GcMAF-активированных макрофагов и клеток рака молочной железы человека. ( A ) Первый день совместной культуры; раковые клетки образуют неравномерный слой. Можно распознать отдельные раковые клетки. GcMAF-активированные макрофаги выглядят как маленькие клетки, прикрепленные к раковым клеткам, в большинстве случаев над ними. ( Б ) День седьмой совместной культуры. Ни одна отдельная раковая клетка не может быть распознана. Их апоптотические тела сгруппированы в центре поля, и большая часть поля пуста от раковых клеток. Большинство GcMAF-активированных макрофагов окружают и проникают в массу остатков раковых клеток в центре.
В совокупности эти результаты впервые демонстрируют, что GcMAF-активированные макрофаги индуцируют апоптоз клеток рака молочной железы человека и последующее снижение массы раковых клеток после фагоцитоза апоптотических раковых клеток макрофагами.
- Дискуссия
Долгое время считалось, что роль витамина D в поддержании здоровья гораздо значительнее, чем первоначально предполагалось, вплоть до того, что некоторые авторы в шутку задаются вопросом, «заставляет ли витамин D мир вращаться?» [ 18 ]. Появление концепции оси витамина D [ 1 , 19 ] еще раз подчеркивает сложность биологических событий, контролируемых 1,25(OH)(2)D3 через два его связывающих белка (VDR и витамин D-связывающий белок/GcMAF). ), которые вмешиваются в растущее число событий на клеточном и молекулярном уровне.
В этом исследовании мы сосредоточили наше внимание на продукте дегликозилирования витамина D-связывающего белка, который представляет собой GcMAF, вероятно, один из самых мощных активаторов макрофагов, обнаруженных на данный момент [ 20 ].
Наши результаты показывают, что GcMAF стимулирует макрофаги, которые, в свою очередь, атакуют клетки рака молочной железы человека, возможно, вызывают их апоптоз и, в конечном итоге, фагоцитируют их.
Эти результаты согласуются с наблюдением, что макрофаги проникают в экспериментальные опухоли, имплантированные мышам с тяжелым иммунодефицитом после инъекций GcMAF [ 8 ].
Однако, в отличие от приведенного выше наблюдения, в наших экспериментах мы могли исключить косвенные эффекты, обусловленные адаптивной реакцией всего организма на наличие распространенной опухоли и на GcMAF-индуцированное ингибирование ангиогенеза с последующей гипоксией и некрозом опухоли. [ 8 ].
Ограничением настоящего исследования является использование только двух клеточных линий, а именно линии клеток рака молочной железы человека MCF-7 и макрофагов Raw 264.7 мыши. Следует, однако, отметить, что GcMAF оказывает качественно наложимое воздействие на первичные мононуклеарные клетки человека [ 21 ] и на линию моноцитоидных клеток человека MonoMac 6 [ 22 ]. Будущие эксперименты выяснят, можно ли экстраполировать эффекты, наблюдаемые в этом исследовании, на другие клеточные линии рака молочной железы человека, зараженные GcMAF-активированными человеческими макрофагами.
Наблюдение того, что GcMAF, компонент оси витамина D, оказывает туморицидное действие на клетки рака молочной железы человека посредством активации макрофагов, поднимает вопрос о том, существует ли какое-либо взаимодействие между GcMAF и VDR. Такой тип взаимодействия будет иметь решающее значение для понимания эффектов 1,25(OH)(2)D3 и GcMAF на молекулярном уровне. На первый взгляд этот вопрос может показаться странным, поскольку в течение многих лет считалось, что VDR локализован в цитоплазме и ядре, а GcMAF не может проникать через плазматическую мембрану и поэтому должен распознаваться поверхностным рецептором, возможно, рецептор лектинового типа [ 23 ].
Однако наблюдение ассоциации между полиморфизмом гена, кодирующего VDR, и дифференциальными ответами на GcMAF в моноцитах человека [ 21 ], а также с метастатическим раком молочной железы [ 24 ], поднимает очевидно странный вопрос о молекулярном взаимодействии между GcMAF и VDR. В поддержку этой гипотезы имеется наблюдение, что VDR транслоцируется на плазматическую мембрану [ 25 ], а связанный с плазматической мембраной VDR отвечает за быстрые, негеномные эффекты витамина D [ 26 ].
Таким образом, чтобы проверить возможность молекулярного взаимодействия между GcMAF и VDR, мы сравнили аминокислотные последовательности, соответствующие их соответствующим сайтам связывания 1,25(OH)(2)D3. Около аминоконца GcMAF (——MKRVLVLLLAVAFGHALERGRDY) имеется 23 гидрофобные аминокислоты, а возле карбоксильного конца VDR (SFQPECSMKLTPLVLEVFGNEIS——) — 23 аминокислоты.
Если эти две последовательности выровнены ( рис. 4А ), можно наблюдать не только то, что в обоих белках имеется длинный участок [ 21 , 24 ] гидрофобных аминокислот (выделен зеленым на рис. 4А , верхняя вставка) , но четыре гидрофобные аминокислоты идентичны (LL FG; обозначены желтым и зеленым над и под выравниванием.
Последовательность GcMAF указана выше). Кроме того, 11 аминокислот имеют сходную функциональную валентность, на что указывают условные символы (*), (.) и (:). Таким образом, в 1,25(OH)(2)D3-связывающих доменах GcMAF и VDR всего 11 из 23 аминокислот обладают функциональной идентичностью или сходством, а 13–14 являются гидрофобными.
Таким образом, можно предположить молекулярное взаимодействие между двумя белками ( рис. 4А ). Согласно этой модели, последние 23 гидрофобные аминокислоты VDR (VDR справа на рисунке 4А ), расположенные во внутренней части плазматической мембраны (представлены пунктирной линией), могли взаимодействовать с первыми 23 гидрофобными аминокислотами. кислоты GcMAF (GcMAF находится слева на рисунке 4).А) расположен во внешней части плазматической мембраны, где 1,25(OH)(2)D3 (изображен желтым цветом) находится между двумя витамин D-связывающими белками.
Олеиновая кислота, взятая в качестве примера ненасыщенной жирной кислоты, связанной с GcMAF [ 27 ], может стабилизировать комплекс на уровне плазматической мембраны. Фактически, и 1,25(OH)(2)D3, и олеиновая кислота в GcMAF расположены в неглубокой щели белка GcMAF, что делает их доступными для плазматической мембраны. В дополнение к способу взаимодействия, предложенному на рисунке 4А , может существовать дополнительное дополнительное взаимодействие, которое учитывает только тот факт, что белок, связывающий витамин D (и, следовательно, также GcMAF), связывает ненасыщенные жирные кислоты, как продемонстрировали Williams et al ., 1998 [ 27 ].
Сайт связывания жирных кислот расположен между доменами II и III, то есть между положениями 304 и 387. Когда мы выровняли 23 гидрофобные аминокислоты указанного выше VDR (представлены на вставке на рисунке 4 B; также в этом случае последовательность GcMAF представлена выше последовательности VDR) и соответствующих гидрофобных аминокислот сайта связывания ненасыщенных жирных кислот GcMAF (в частности, в положениях 356–386), мы наблюдали значительную степень функциональной гомологии; на самом деле в длинном отрезке гидрофобных аминокислот (выделено синим) есть восемь аминокислот с одинаковой функциональной валентностью.
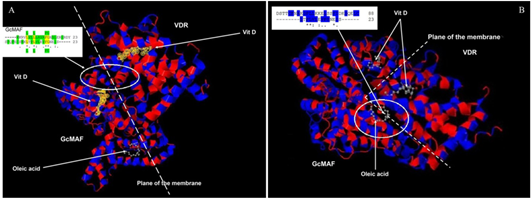
Рисунок 4. Выравнивание аминокислот и трехмерные белковые структуры витамина D-связывающего белка/GcMAF и VDR. ( А ) 23 гидрофобные аминокислоты VDR (справа), расположенные во внутренней части плазматической мембраны (пунктирная линия), взаимодействуют с 23 гидрофобными аминокислотами GcMAF (слева на рисунке), расположенными во внешней часть плазматической мембраны. На вставке гидрофобные аминокислоты выделены зеленым цветом, а четыре идентичные гидрофобные аминокислоты (LL FG) выделены желтым и зеленым над и под выравниванием. Витамин D обозначает 1,25(OH)(2)D3. ( Б ) 23 гидрофобные аминокислоты VDR взаимодействуют с участком гидрофобных аминокислот сайта связывания ненасыщенных жирных кислот GcMAF. На вставке восемь аминокислот с одинаковой функциональной валентностью в длинном участке гидрофобных аминокислот выделены синим цветом.
Следовательно, можно предположить, что GcMAF и VDR имеют множество сайтов взаимодействия на уровне плазматической мембраны. Согласно этой модели, присутствие 1,25(OH)(2)D3 в культуральной среде должно усиливать эффекты GcMAF за счет облегчения взаимодействия между GcMAF и VDR. В соответствии с этой моделью мы ранее продемонстрировали, что эффекты 1,25(OH)(2)D3 и GcMAF синергичны в ингибировании пролиферации клеток MCF-7 [ 4 ], а предварительные результаты, представленные в Таблице 1 , показывают, что GcMAF и парикальцитол , негиперкальциемический VDR-агонист, также обладает синергическим эффектом. В эксперименте, описанном в Таблице 1 , мы решили использовать парикальцитол вместо 1,25(OH)(2)D3, чтобы определить, наблюдается ли синергизм между 1,25(OH)(2)D3 и GcMAF, который мы наблюдали ранее. [ 4 ] должно было быть приписано исключительно 1,25(OH)(2)D3 или также могло быть получено с другими агонистами VDR. Из результатов, представленных в Таблице 1 , следует, что парикальцитол и, возможно, другие агонисты VDR могут соответствовать молекулярной модели, предложенной на Фигуре 4 .
Таблица 1. Влияние GcMAF и парикальцитола на макрофаги Raw 264.7. Необработанные клетки 264.7 инкубировали в течение 30 минут с указанными добавками. Влияние GcMAF на активацию макрофагов оценивали путем определения пролиферации клеток. Фактически было продемонстрировано, что моноциты/макрофаги, активированные введением GcMAF, немедленно прекращают репликацию ДНК и быстро синтезируют большое количество Fc-рецепторов, а также огромное разнообразие рецепторов [ 28 ].
Парикальцитол добавляли в концентрации 300 фг/мл. В этой концентрации парикальцитол не оказывал никакого эффекта. В присутствии парикальцитола (300 фг/мл) эффект GcMAF в концентрации 4 нг/мл был идентичен эффекту GcMAF в концентрации 40 нг/мл в отсутствие парикальцитола. Эти результаты демонстрируют, что присутствие селективного агониста VDR в концентрации, недостаточной для активации VDR как таковой, на порядок увеличивает ответ на GcMAF. Данные представлены как средние значения ± стандартная ошибка среднего ( n = 12). * p < 0,02 по сравнению с контролем.
В совокупности эти результаты подтверждают гипотезу о том, что взаимодействие между GcMAF и VDR может облегчаться агонистами VDR. Эта гипотеза дополнительно подкрепляется недавним наблюдением о том, что активированные макрофаги способны генерировать достаточное количество биологически активного витамина D, чтобы его можно было обнаружить в общем кровообращении [ 29 ], что указывает на паракринную/аутокринную петлю положительной обратной связи.
- Выводы
Результаты, представленные в этом исследовании, показывают, что роль витамина D в физиологии и патологии гораздо сложнее, чем предполагалось ранее. Таким образом, помимо самого 1,25(OH)(2)D3, по крайней мере еще один компонент оси витамина D, GcMAF, оказывает значительное влияние на клеточном уровне, и, по-видимому, эффекты GcMAF взаимосвязаны с активацией VDR. Таким образом, можно предположить, что эти взаимосвязи между 1,25(OH)(2)D3, GcMAF и VDR будут способствовать разработке новых терапевтических применений компонентов оси витамина D.
Благодарности
Марко Руджеро, Стефания Пачини и Массимо Гулисано получили гранты Университета Флоренции и проекта PRIN 2009.
Конфликт интересов
Все авторы заявляют об отсутствии конфликта интересов.
Рекомендации
Руджеро, М.; Пачини, С. Ось витамина D при хронической болезни почек – современное состояние и перспективы на будущее. Евро. Нефрол. 2011 , 5 , 15–19. [ Google Scholar ]
Шао, Т.; Кляйн, П.; Гроссбард, М.Л. Витамин D и рак молочной железы. Онколог 2012 , 17 , 36–45. [ Академия Google ] [ CrossRef ]
Пачини, С.; Моруччи, Г.; Пунци, Т.; Гулисано, М.; Руджеро, М. Фактор активации макрофагов, полученный из белка Gc (GcMAF), стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоисной мембраны куриных эмбрионов. Рак Иммунол. Иммунотер. 2011 , 60 , 479–485. [ Google Scholar ]
Пачини, С.; Пунци, Т.; Моруччи, Г.; Гулисано, М.; Руджеро, М. Влияние фактора активации макрофагов, связывающего витамин D, на клетки рака молочной железы человека. Противораковый Рез. 2012 , 32 , 45–52. [ Google Scholar ]
Редер, Д.С.; Нельсон, RW; Борхес, К.Р. Статус гликозилирования белка, связывающего витамин D, у онкологических больных. Белковая наука. 2009 , 18 , 2036–2042. [ Академия Google ] [ CrossRef ]
Ямамото, Н.; Суяма, Х.; Ямамото, Н.; Ушидзима, Н. Иммунотерапия больных метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF). Межд. Дж. Рак 2008 , 122 , 461–467. [ Академия Google ] [ CrossRef ]
Тойохара, Ю.; Хашитани, С.; Кисимото, Х.; Ногучи, К.; Ямамото, Н.; Ураде, М. Ингибирующее действие витамина D-связывающего белка, полученного из фактора активации макрофагов, на DMBA-индуцированный канцерогенез защечного мешка хомяка и производную от него клеточную линию карциномы. Онкол. Летт. 2011 , 2 , 685–691. [ Google Scholar ]
Нонака, К.; Онидзука, С.; Исибаши, Х.; Уто, Ю.; Хори, Х.; Накаяма, Т.; Мацуура, Н.; Канемацу, Т.; Фудзиока, Х. Фактор активации белка-макрофагов, связывающий витамин D, ингибирует ГЦК у мышей SCID. Дж. Сург. Рез. 2012 , 172 , 116–122. [ Академия Google ] [ CrossRef ]
Хайон, Т.; Двиланский А.; Шпильберг, О.; Натан, И. Оценка анализа на основе МТТ как полезного инструмента для прогнозирования химиочувствительности к лекарствам при лейкемии. Лейк. Лимфома 2003 , 44 , 1957–1962. [ Академия Google ] [ CrossRef ]
Геномная биоинформатика UCSC. Доступно онлайн: http://genome.ucsc.edu (по состоянию на 22 января 2013 г.).
макромолекулярный ресурс. Доступно в Интернете Индекс /goldenPath/hg18. Доступно в Интернете: http://hgdownload.cse.ucsc.edu/goldenPath/hg18 (по состоянию на 25 января 2013 г.).
Поднимите аннотации генома. Доступно онлайн: http://genome.ucsc.edu/cgi-bin/hgLiftOver (по состоянию на 26 января 2013 г.).
ПротСкейл. Доступно онлайн: http://web.expasy.org/protscale/ (по состоянию на 6 февраля 2013 г.).
Доступно онлайн: http://web.expasy.org/protscale/pscale/Hphob.Doolittle.html (по состоянию на 6 февраля 2013 г.).
Биологический: http://www.rcsb.org/pdb/home/home.do (по состоянию на 11 февраля 2013 г.).
DeepView – Swiss-PdbViewer. Доступно онлайн: http://spdbv.vital-it.ch/ (по состоянию на 13 февраля 2013 г.).
Хакер, Г. Морфология апоптоза. Клеточная ткань Res. 2000 , 301 , 5–17. [ Академия Google ] [ CrossRef ]
Вагнер, CL; Тейлор, С.Н.; Холлис, Б.В. Заставляет ли витамин D мир вращаться? Кормить грудью. Мед. 2008 , 3 , 239–250. [ Академия Google ] [ CrossRef ]
Чишимба, Л.; Тикетт, доктор медицинских наук; Стокли, РА; Вуд, А.М. Ось витамина D в легких: ключевая роль белка, связывающего витамин D. Торакс 2010 , 65 , 456–462. [ Академия Google ] [ CrossRef ]
Уто, Ю.; Ямамото, С.; Мукаи, Х.; Исияма, Н.; Такеучи, Р.; Накагава, Ю.; Хирота, К.; Терада, Х.; Онидзука, С.; Хори, Х. Лечение β-галактозидазой представляет собой обычную модификацию на первом этапе трех основных подтипов белка Gc в GcMAF. Противораковый Рез. 2012 , 32 , 2359–2364. [ Google Scholar ]
Пачини, С.; Моруччи, Г.; Пунци, Т.; Гулисано, М.; Руджеро, М.; Амато, М.; Атерини, С. Влияние парикальцитола и GcMAF на ангиогенез, пролиферацию и передачу сигналов мононуклеарных клеток периферической крови человека. Дж. Нефрол. 2012 , 25 , 577–581. [ Академия Google ] [ CrossRef ]
Пачини, С.; Бранка, JJV; Моруччи, Г.; Гулисано, М.; Руджеро, М. Влияние GcMAF на моноцитарно-макрофагальные клетки. 2013 . представить для публикации. [ Google Scholar ]
Иида, С.; Ямамото, К.; Иримура, Т. Взаимодействие лектина человеческого макрофага C-типа с O -связанными остатками N -ацетилгалактозамина на гликопептидах муцина. Ж. Биол. хим. 1999 , 274 , 10697–10705. [ Академия Google ] [ CrossRef ]
Руджеро, М.; Пачини, С.; Атерини, С.; Фаллаи, К.; Руджеро, К.; Пачини, П. Полиморфизм гена рецептора витамина D связан с метастатическим раком молочной железы. Онкол. Рез. 1998 , 10 , 43–46. [ Google Scholar ]
Капиати, Д.; Бенассати, С.; Боланд, Р.Л. 1,25(OH)2-витамин D3 индуцирует транслокацию рецептора витамина D (VDR) на плазматическую мембрану в клетках скелетных мышц. Дж. Селл. Биохим. 2002 , 86 , 128–135. [ Академия Google ] [ CrossRef ]
Челия, Л.; Харрис, С.С. Витамин d и его роль в скелетных мышцах. Кальциф. Ткани Int. 2013 , 92 , 151–162. [ Академия Google ] [ CrossRef ]
Уильямс, Миннесота; ван Олстайн, Эль; Гэлбрейт, Р.М. Доказательства новой ассоциации ненасыщенных жирных кислот с Gc (белок, связывающий витамин D). Биохим. Биофиз. Рез. Коммун. 1988 , 153 , 1019–1024. [ Академия Google ] [ CrossRef ]
Ямамото, Н.; Ушиджима, Н.; Кога, Ю. Иммунотерапия ВИЧ-инфицированных пациентов с помощью фактора активации макрофагов, полученного из белка Gc (GcMAF). Дж. Мед. Вирол. 2008 , 81 , 16–26. [ Академия Google ] [ CrossRef ]
Адамс, Дж. С.; Хьюисон, М. Экстраренальная экспрессия 25-гидроксивитамина d -1-гидроксилазы. Арх. Биохим. Биофиз. 2012 , 523 , 95–102. [ Академия Google ] [ CrossRef ]
© 2013 авторы; лицензиат MDPI, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution ( http://creativecommons.org/licenses/by/3.0/ ).
