NCBI Literature Resources Int J Mol Sci 2023 Dec; 24(24): 17396.
Svetlana S. KirikovichEvgeniy V. Levites, Anastasia S. Proskurina, Genrikh S. Ritter, E. Peltek,Asya R. Vasilieva, Vera S. Ruzanova, Evgeniya V. Dolgova and other
The Molecular Aspects of Functional Activity of Macrophage-Activating Factor GcMAF
Молекулярные аспекты функциональной активности фактора активации макрофагов GcMAF
Группоспецифический компонент фактора активации макрофагов (GcMAF) представляет собой витамин D3 — связывающий белок (DBP), дегликозилированный по Thr 420 .
Считается, что белок проявляет широкий спектр терапевтических свойств, связанных с активацией макрофагального иммунитета. В этом исследовании был разработан оригинальный метод получения GcMAF, преобразования DBP в GcMAF и анализа активирующей активности GcMAF.
Получены данные, раскрывающие молекулярные причины активации макрофагов. Было обнаружено, что GcMAF взаимодействует с тремя производными CLEC10A, имеющими молекулярную массу 29 кДа, 63 кДа и 65 кДа. GcMAF взаимодействует с высокомолекулярными производными посредством взаимодействия с Ca 2+ -зависимым рецептором.
Связывание с производным 65 кДа или 63 кДа определяет про- и противовоспалительное направление экспрессии мРНК цитокинов: 65 кДа — провоспалительное (TNF-α, IL-1β) и 63 кДа — противовоспалительное (TGF-β, Ил-10). Для взаимодействия с каноническим CLEC10A массой 29 кДа ионы Ca 2+ не требуются. Обе формы, белок DBP и GcMAF, связываются с CLEC10A массой 29 кДа. Это взаимодействие характеризуется стохастическим синтезом мРНК анализируемых цитокинов.
Эксперименты ex vivo показали, что при избытке лиганда GcMAF CLEC10A образует агрегат, и синтез мРНК анализируемых цитокинов ингибируется. Представлена принципиальная схема предполагаемого механизма взаимодействия производных CLEC10A и GcMAF. Разработаны принципы и элементы стандартизации препарата GcMAF.
Ключевые слова: витамин D3-связывающий белок, группоспецифический компонент белкового фактора активации макрофагов, CLEC10A, провоспалительные и противовоспалительные цитокины.
- Введение
Фактор активации макрофагов GcMAF относится к категории белков плазмы, обладающих широким спектром свойств и значительным терапевтическим потенциалом [ 1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 ].
Различные исследовательские группы сообщили о противораковой активности фактора активации макрофагов [ 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 ].
Было показано, что GcMAF обладает способностью устранять нейродегенеративные заболевания, включая расстройства аутистического спектра [ 7 , 20 , 21 , 22 , 23 ].
Проведенные эксперименты показывают, что широкий спектр терапевтических свойств GcMAF напрямую связан с его воздействием на макрофаги [ 8 , 9 , 24 , 25 , 26 ].
Считается, что предшественник GcMAF, витамин D3 — связывающий белок, превращается в фактор активации макрофагов посредством частичного дегликозилирования трисахарида, связанного с Thr 420 О-гликозидной связью, что приводит к образованию терминального остатка GalNAc. Имеющиеся экспериментальные данные указывают на то, что именно этот углевод отвечает за активирующую макрофаги способность GcMAF [ 11 , 27 , 28 , 29 , 30 , 31 ].
Некоторые препараты называются GcMAF, но на самом деле не являются GcMAF. Это примеры так называемого GcMAF второго поколения, который на самом деле представляет собой смесь обработанных ферментами белков плазмы, и так называемого GcMAF третьего поколения, который представляет собой молозиво, содержащее концевой несвязанный GalNAc [ 26 , 32 , 33 , 34 ].
В наших ранних исследованиях GcMAF мы столкнулись со сложностью процедуры выделения ДБФ из плазмы и преобразования его в GcMAF [ 11 , 21 , 35 , 36 ].
В настоящем исследовании мы разработали оригинальный метод получения и преобразования GcMAF, а также анализа его активности активации. Одновременно мы сформулировали принципы и элементы стандартизации препарата GcMAF. Производство препарата GcMAF запатентовано (приоритет № 47390 2023121663 от 17.08.2023).
Техническое примечание. Цель исследования и общий дизайн.
В настоящем исследовании мы попытались идентифицировать молекулярные элементы, которые определяют про- или противовоспалительные реакции GcMAF-активированных перитонеальных макрофагов (ПМ).
Статья включает две основные части результатов, обсуждение и общий вывод.
Первая часть раздела результатов исследования включает в себя следующие этапы:
(1) Охарактеризованы белки, связывающиеся со смолой 25-OH/Sepharose® через аффинный сайт;
(2) Разработаны элементы стандартизации выделения и анализа GcMAF, а также оценки специфической активности ПМ, обработанных препаратами GcMAF, полученными различными методами конверсии;
(3) Оценивали активацию синтеза мРНК медиаторов воспаления IL-1b и TNF-α и основных противовоспалительных цитокинов TGF-β и IL-10 в ПМ, выделенных от мышей C57BL|6 с помощью препаратов DBP от различных доноров.
(4) Оценивали активацию синтеза мРНК IL-1b, TNF-α, TGF-β и IL-10 в ПМ препаратами GcMAF, полученными путем конверсии предшественников лейкоцитов, активированных при различных режимах обработки.
(5) Был проведен флуоресцентный микроскопический анализ распределения Cy5-меченного GcMAF на ПМ.
В заключении к первой части подводятся основные итоги экспериментальной работы.
Вторая часть раздела результатов исследования включает в себя следующие этапы:
(1) На основании литературных данных проанализирован возможный механизм активации макрофагов GcMAF.
(2) Разработан сэндвич-блот-анализ, который позволил охарактеризовать взаимодействие GcMAF и очищенного коммерческого белка CLEC10A.
(3) Используя подход, упомянутый в предыдущем абзаце, было проанализировано взаимодействие между GcMAF и CLEC10A в ПМ мышей.
В заключении второй части суммируются основные молекулярные элементы и формулируется принцип активации макрофагов в сторону про- или противовоспалительного ответа.
В разделе «Обсуждение» анализируются механизмы возникновения воспалительной реакции ПМ и ее ингибирования в ответ на обработку фагоцитов GcMAF.
В заключении представлена гипотетическая схема взаимодействия GcMAF и CLEC10A, приводящая к возникновению про- или противовоспалительного ответа в ПМ мышей.
- Результаты
Часть I.
2.1. Сравнительная характеристика GcMAF-RF, полученного с помощью аффинной хроматографии на колонках актин/хитин и 25-ОН/сефароза ® . Тандемный масс-спектрометрический анализ двух белковых фракций, выделенных хроматографией на колонке 25-ОН/Сефароза ®
В наших более ранних исследованиях [ 36 ] фактор активации макрофагов GcMAF-RF получали с использованием витамина D3 — связывающего белка (DBP) после аффинной хроматографии донорской плазмы на колонке актин/хитин с последующим превращением DBP в специфического фактора активации макрофагов GcMAF-RF путем обработки ДБФ взвесью лейкоцитов в течение 12–24 ч в атмосфере CO 2 (Рисунок 1А).
Специфичность полученного фактора активации макрофагов определяли либо с помощью вестерн-блоттинга (для антител против Gc), либо в специальных экспериментах по оценке взаимодействия с лектином H. pomatia [ 37 ].
Во всех экспериментах по выделению вместе с целевым белком всегда выделяли примесные белки, которые также специфически взаимодействуют с актином. Некоторые из этих основных фракций примесей были охарактеризованы в других исследованиях [ 11 , 29 , 38 , 39 , 40 , 41 ]. Целевой белок, выделенный с помощью этой процедуры, не подлежал стандартизации, что требовалось для проведения детальных молекулярных исследований и разработки лекарственного препарата на основе специфического фактора активации макрофагов.
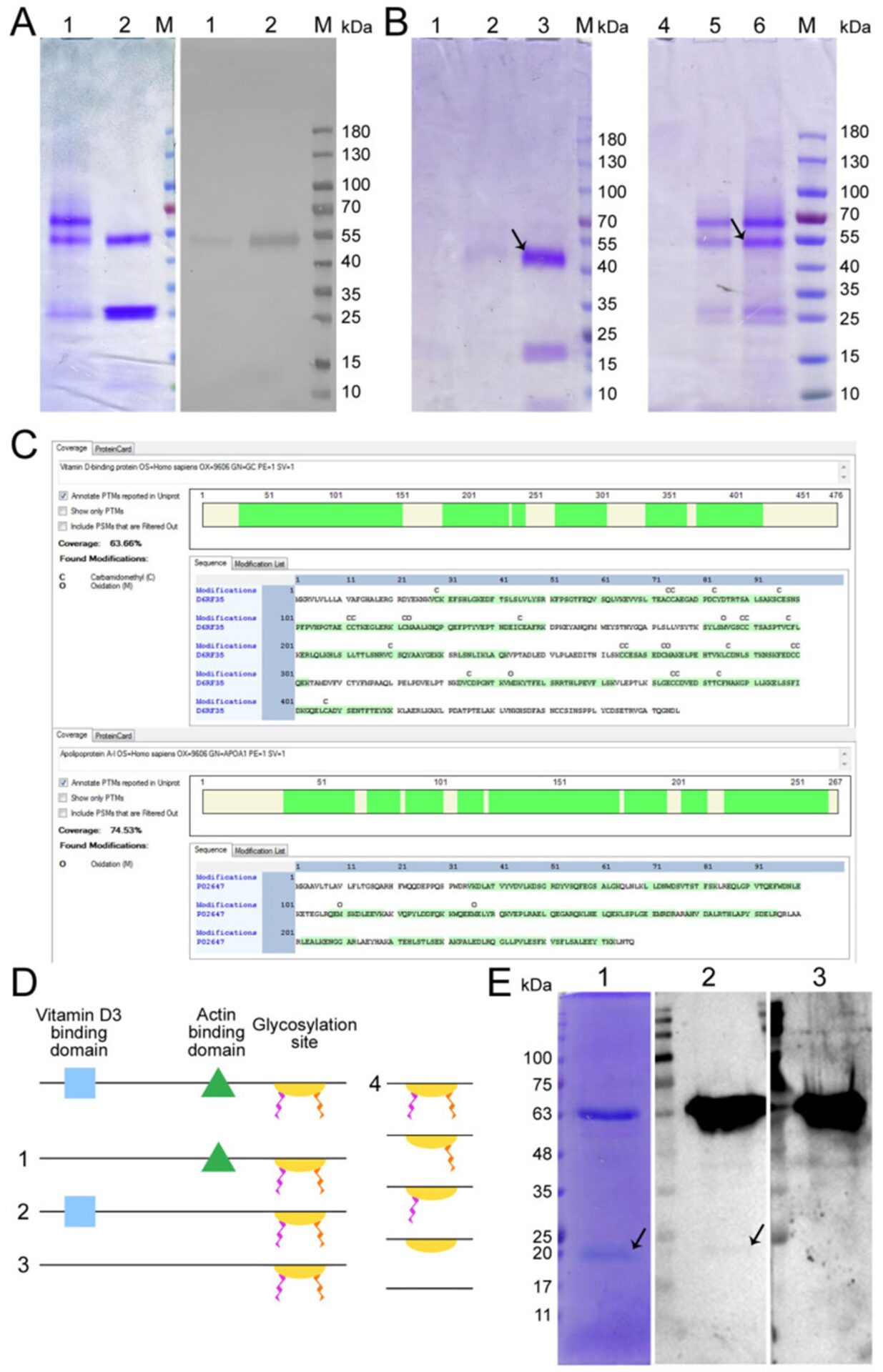
Структурно-функциональная характеристика ДАД. ( A ) Полиакриламидный гель образцов DBP, полученных с использованием актин-хитиновой смолы (1) и 25-OH-D 3 /Sepharose ® (2), аффинной хроматографии (слева) и вестерн-блоттинга этих образцов с антителами против Gc (справа). ( Б ) Полиакриламидные гели образцов ДБФ, полученных методом последовательной двуаффинной хроматографии: хроматография на 25-OH-D 3 /Сефароза ® /актин-хитин (1-3) и хроматография на актин-хитин/25-OH-D 3 /Сефароза ® (4–6), с прорывом после второго этапа хроматографии (1 и 5), образцы ДБФ, полученные с помощью последовательной двухаффинной хроматографии (2 и 4), и исходный ДБФ, полученный на первом этапе хроматографии, стрелки обозначают ДБФ (3 и 6). М — молекулярный маркер «The Thermo Scientific™ Page Ruler™ Prestained Protein Ladder» (Thermo Fisher Scientific Inc., Карлсбад, Калифорния, США). ( C ) Результат сравнения аминокислотных последовательностей двух полос 58 кДа и 28–30 кДа с последовательностями протеома UP000005640. ( D ) Схематическое изображение структуры ДБФ и предполагаемые варианты дегликозилирования трисахарида GalNAc-сиаловая кислота-галактоза. Два «хвоста» представляют собой сиаловую кислоту и галактозу. Отсутствие «хвостов» означает только GalNAc. ( E ) Полиакриламидный гель образцов DBP3, полученных с использованием аффинной хроматографии на 25-OH-D 3 /Sepharose® ( 1) и вестерн-блоттинга сэндвич-типа (DBP3//GcMAF3 Ex L pl 39 °C/αGc) (2) и ( ДБФ3//αGc) (3). Стрелками показан аполипопротеин А1 А1 (АпоА1).
Поэтому была разработана система выделения предшественников с помощью аффинной хроматографии, использующая 25-OH-D 3 /сефарозу ® в качестве аффинной матрицы. Матрица изготовлена способом, совершенно отличным от способа, описанного в [ 35 ], и ее изготовление находится в промышленной собственности Открытого акционерного общества «АКТИВАТОР МАФ».
Продукт, полученный с помощью данной системы аффинной хроматографии, состоял из двух белков (Рисунок 1Левый блок). Один из них мигрировал на уровне, идентичном ранее описанному в литературе уровню GcMAF, и специфически взаимодействовал с антителами против Gc. Другой белок мигрировал на уровне ~28–30 кДа и не взаимодействовал с антителами против Gc (Рисунок 1Правый блок).
Было сделано вполне обоснованное, на наш взгляд, предположение, что последовательная двуаффинная хроматография позволит получить белок высшей степени чистоты. Анализировали оба варианта последовательной хроматографии (актин/хитин-25-OH-D 3 /сефароза ® и 25-OH-D 3 /сефароза ® -актин/хитин). Результаты показаны наРисунок 1Б.
ДНК и аминокислотная последовательность, а также функциональные домены как DBP, так и GcMAF охарактеризованы в ссылках. [ 6 , 42 , 43 , 44 ].
В структуру полноразмерного и потенциально максимально функционального белка входят витамин D3 — связывающий и актинсвязывающий домены, а также домен, отвечающий за взаимодействие с нейтрофилами, и сайт гликозилирования, состоящий из трех сахаридов и включающий N-ацетилгалактозамин ( GalNAc), присоединенный к Thr 420 посредством О-гликозидной связи, помимо концевой сиаловой кислоты и галактозы, ковалентно связанных с GalNAc (Рисунок 1Д). Наряду с многочисленными аллельными формами [ 44 , 45 , 46 ] в организме человека могут существовать формы (варианты) нативного белка с уменьшенным числом функциональных групп и меньшей степенью гликозилирования.
Эта идея была подтверждена результатами, полученными в исследованиях, посвященных сайт-специфическому гликозилированию, где были обнаружены различные варианты гликозилирования, положения остатков сахаридов и возможность нескольких сайтов прикрепления остатков сахаридов [ 4 , 27 , 47 , 48 , 49]. ] (Рисунок 1(Д4)).
Кроме того, конформация белка важна для специфического взаимодействия; ее изменение может привести как к полному, так и к частичному ухудшению аффинности [ 30 ].
Проведенный анализ показал, что с помощью аффинной хроматографии в случае двух разных доменов выделяются две разные формы ДБФ. Если колонка 25-OH-D 3 /Сефароза ® является основной, то с колонкой с Актином связывается <10% МАФ, полученного от исходного количества ДБФ, элюированного с колонки 25-ОН-D 3 /Сефароза ® .
Если основной колонкой является колонка Actin, следовые количества (<1%) исходного белка связываются с матрицей 25-OH-D 3 /Sepharose ®.
Это означает, что (1) большая часть DBP, удаленная из колонки 25-OH-D 3 /Sepharose® , не содержит актинсвязывающего домена, или соответствующая аминокислотная последовательность или конформация белка функционально изменены, и (2) большая часть ДБФ, удаленный из колонки актин/хитин, не содержит D3 — связывающего домена (Рисунок 1Б).
Описываемая часть исследования проводилась с использованием плазмы, полученной из донорского LEV (C GcMAF LEV L pure 37 °C). Все эксперименты, описанные в наших исследованиях [ 36 , 37 , 50 , 51 ], проводились с использованием биологического материала, полученного от этого самого донора.
Прекурсор конвертировали в ДБФ с использованием суспензии лейкоцитов, полученных как от одного донора, так и от разных доноров (активирующая способность лейкоцитов охарактеризована ниже и на рис.фигура 2А).
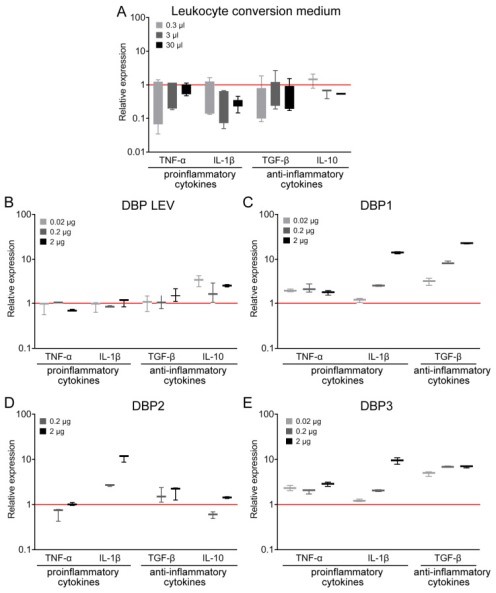
Количественная оценка экспрессии мРНК генов цитокинов в перитонеальных макрофагах мышей, обработанных средой для конверсии лейкоцитов и DBP, полученным от разных доноров. ( А ) На диаграмме показана экспрессия мРНК генов цитокинов в перитонеальных макрофагах мышей, обработанных средой для конверсии лейкоцитов. Дозы соответствуют 0,3 мкл, 3 мкл и 30 мкл среды для конверсии лейкоцитов, полученной в аналогичных условиях культивирования лейкоцитов, но без GcMAF (более подробную информацию см. в разделе «Материалы и методы»). В качестве контроля здесь используются необработанные перитонеальные макрофаги, уровень экспрессии которых считается 1 (красная сплошная линия). ( B – E ) Экспрессия мРНК генов цитокинов в перитонеальных макрофагах мышей, получавших DBP, полученный от разных доноров в дозах 0,02 мкг, 0,2 мкг и 2 мкг (0,2 мкг и 2 мкг для D ) по сравнению с контролем (необработанным), уровень экспрессии которого считается 1 (красная сплошная линия). ( B ) ДАД ЛЕВ. ( С ) ДАД1. ( Д ) ДАД2. ( Е ) ДАД3. Приводятся медианные значения, межквартильный размах, а также минимальные и максимальные значения. IL-10 не показан на ( C , E ) из-за неопределяемого уровня соответствующей мРНК в этих образцах.
Было принято дискреционное решение использовать продукт, полученный на колонке 25-OH-D 3 /Сефароза ® , для дальнейших исследований на следующих основаниях: (1) это стабильная химически модифицированная матрица, позволяющая проводить множество хроматографических циклов. ; и (2) полученный продукт хроматографии является гомогенным и всегда состоит из двух белков, описанных ниже, и, следовательно, можно проводить дальнейшие молекулярные исследования с использованием фактора активации макрофагов с помощью стандартизированной процедуры выделения.
Хроматографическое разделение компонентов полос проводили методом ВЭЖХ на системе Thermo Fisher Scientific Ultimate 3000 Series с последующей идентификацией соединений на тандемном масс-спектрометре Orbitrap Fusion Lumos.
Ионизация электронным распылением позволила получить многозарядные ионы, преимуществом которых была возможность регистрации масс-спектров вторичных ионов при фрагментации ионов-предшественников с различным зарядом, что повышает уровень идентификации аминокислотных последовательностей. Программное обеспечение Proteome Discoverer 2.4 выявило 63,66% идентичность между верхней полосой (58 кДа) и витамином D3 — связывающим белком, что было достаточно для идентификации продукта, полученного на колонке 25-OH-D3 / Sepharose® , как DBP.
Этот результат позволил нам в дальнейших исследованиях использовать термин, традиционно используемый для обозначения фактора активации макрофагов, как GcMAF, без добавления слова «родственный фактор» (РФ). Короткий белок (28 кДа) на 74,54% идентичен аполипопротеину А1 (АроА1) (Рисунок 1С), что достаточно для идентификации этого белка как ApoA1.
Для оценки возможности прямого взаимодействия предшественника с АроА1 мы провели дот-блот-анализ сэндвич-типа, при котором продукт аффинной хроматографии на колонке 25-OH-D 3 /Sepharose ® фракционировали в геле и переносили на мембрану. обрабатывали DBP или GcMAF, а затем комплекс визуализировали с использованием антител против Gc. В выбранных условиях ДАД не взаимодействовал напрямую с АпоА1. Однако GcMAF связан с ApoA1 (Рисунок 1(E1), показано стрелкой).
Таким образом, оказалось, что на матрице аффинной хроматографии можно выделить варианты белков с разными молекулярными характеристиками. Дополнительно было установлено, что ApoA1 как отдельный фактор не влияет на синтез анализируемых цитокинов ПМ ( Приложение А ).
2.2. Разработка элементов стандартизации продукции DBP и GcMAF и оценка удельной активности ПМ, обработанных препаратами GcMAF, полученными различными методами конверсии DBP
Этот вывод и дальнейшие исследования позволили нам наметить элементы стандартизации DBP и GcMAF:
(1) Выделение фактора на исходной колонке 25-OH-D 3 / Sepharose® ;
(2) Использовали клеточную систему PM, полученную от мышей C57BL/6, выбранную для анализа. Это генетически однородная линия мышей, что позволяет использовать таких животных в качестве стандартного источника ПМ;
(3) Использование способности DBP и GcMAF индуцировать синтез мРНК четырех цитокинов (провоспалительных медиаторов TNF-α и IL-1β, а также основных противовоспалительных цитокинов TGF-β и IL-10) в ПМ, которые были выбраны для анализа.
В данном исследовании мы оценили четыре варианта обработки лейкоцитов, используемых для конвертации ДАД в GcMAF.
Первый вариант называется традиционным режимом. DBP выделяют на колонке, элюируют и превращают в GcMAF, используя обработку суспензией лейкоцитов в PBS с добавлением 10% FBS. Далее, в зависимости от поставленных задач, либо фактор активации макрофагов используют в экспериментах без какой-либо обработки, либо из него удаляют сывороточные белки и побочные продукты метаболизма лейкоцитов посредством повторной хроматографии [ 27 ]. В этом исследовании был разработан быстрый и эффективный метод преобразования DBP в GcMAF непосредственно на смоле, получивший название быстрой изоляции. В этом случае все методы лечения ДАД проводятся, когда белок связан с матриксом.
Во втором варианте иммобилизованный на смоле ДБФ обрабатывают суспензией лейкоцитов в нативной плазме при температуре 37 °С.
В третьем варианте иммобилизованный на смоле ДБФ обрабатывают суспензией лейкоцитов в нативной плазме в присутствии LysoPC [ 47 ].
В четвертом варианте иммобилизованный на смоле ДБФ обрабатывают отмытыми в буфере А лейкоцитами (см. раздел «Методы»), которые активируют в сторону воспаления с помощью LysoPC в течение 3 ч при 37 °С в присутствии 2 мМ Са 2+ . .
Образцы GcMAF, полученные после этих обработок, промывали для удаления конверсионной среды, элюировали 3М гуанидинхлоридом, диализовали против PBS и использовали для активации ПМ.
Сравнительный анализ белка (C GcMAF LEV L pure 37 °C), полученного конверсией в суспензии лейкоцитов и с использованием процедуры быстрого выделения, показал, что оба препарата обладают одинаковой активирующей способностью. Позднее предполагалось и было показано, что в идентичных условиях ДБФ можно превратить в GcMAF при обработке сиалидазой и β-галактозидазой в растворе, что значительно упрощает процедуру выделения фактора активации макрофагов.
(4) Таким образом, четвертым элементом стандартизации процедуры производства GcMAF является преобразование DBP в фактор активации макрофагов непосредственно на 25-OH-D 3 /Сефарозе ® .
Лечение суспензией лейкоцитов подразумевало, что плазма обязательно содержит побочные продукты метаболизма лейкоцитов. В некоторых вариантах конверсионная среда (PBS) также содержала 10% FBS. Ранее было показано, что конверсионная среда (PBS, 10% FBS) сама по себе не влияет на фагоцитарную активность ПМ [ 36 ].
Это означало, что именно DBP, преобразованный в GcMAF, активировал PM. Нам необходимо было дополнительно оценить влияние конверсионной среды на анализируемые в данном исследовании параметры, а именно синтез мРНК как провоспалительных цитокинов TNF-α и IL-1β, так и основных противовоспалительных цитокинов TGF-β и IL. -10 в личку. Обработка ПМ конверсионной средой, не содержащей ДБФ, но содержащей неиндуцированные к воспалению лейкоциты, не влияет на синтез указанных цитокинов в ПМ (фигура 2А). Это позволяет предположить, что лейкоциты сами по себе не способны активировать ПМ.
Поэтому для анализа активирующей способности была выбрана модель оценки синтеза провоспалительных медиаторов TNF-α и IL-1β и основных противовоспалительных цитокинов TGF-β и IL-10 перитонеальными макрофагами, выделенными от мышей C57BL/6. ДАД и GcMAF. Использовали препарат GcMAF, полученный методом аффинной хроматографии на колонке 25-OH-D 3 /Sepharose® , который конвертировали либо в растворе, либо непосредственно на смоле различными конверсионными средами, содержащими донорские лейкоциты.
В этом исследовании были проанализированы различные способы конверсии предшественников с использованием лейкоцитов. Кроме того, для сравнения использовали результаты конверсии ДАД при обработке ферментами сиалидазой и β-галактозидазой. Мы систематизировали эти режимы и использовали соответствующие обозначения. Изоляция в обычных условиях — в; выделены на смоле – Экс (экспресс-метод); лейкоциты – Л; в плазме — плазма; использование LysoPC — LysoPC; очищенные лейкоциты – чистые; лейкоциты обрабатывали при разных температурах: 37°С и 39°С.
2.3. Количественная оценка активации синтеза мРНК как провоспалительных медиаторов TNF-α и IL-1β, так и основных противовоспалительных цитокинов TGF-β и IL-10 в ПМ, выделенных от мышей C57BL/6 с использованием препаратов DBP, полученных от разных доноров
На начальном этапе анализа мы обнаружили, что ДАД, полученный от нескольких (четырех) доноров, активирует ПМ в сторону синтеза мРНК одного или нескольких цитокинов, что в ряде случаев относится к разнонаправленным воспалительным реакциям (фигура 2БЫТЬ).
ДБФ ЛЕВ незначительно активировал ПМ в сторону синтеза ИЛ-1β (еще раз отметим, что именно этот предшественник использовался во всех экспериментах всех наших предыдущих исследований [ 36 , 37 , 50 , 51 ]). Он активировал ПМ в направлении синтеза противовоспалительных цитокинов (фигура 2Б).
DBP1 активировал синтез мРНК TNF-α, IL-1β и TGF-β, что относится к противоположно ориентированным воспалительным реакциям.
ДБФ2 активировал синтез мРНК IL-1β и незначительно влиял на синтез мРНК противовоспалительных цитокинов.
DBP3 дозозависимо активировал синтез мРНК TNF-α и IL-1β. Для всех трех доз активатора уровень синтеза мРНК TGF-β был примерно в шесть раз выше контрольных значений.
2.4. Количественная оценка активации синтеза мРНК обоих провоспалительных медиаторов TNF-α и IL-1β, а также основных противовоспалительных цитокинов TGF-β и IL-10 в ПМ, выделенных из мышей C57BL/6 с использованием препаратов GcMAF, полученных путем конверсии предшественников с использованием Лейкоциты, активированные при различных режимах лечения
Проведен комплексный сравнительный анализ способности препаратов-предшественников и GcMAF на их основе активировать синтез мРНК выбранных цитокинов. Мы сравнили различные дозы, температуры, методы конверсии и суспензии лейкоцитов, приготовленные разными методами.
Во всех экспериментах использовали три дозы (0,02 мкг, 0,2 мкг и 2 мкг); в некоторых экспериментальных сериях мы использовали дозу 10–20 мкг целевого белка на точку (10 6 ПМ в 0,5 мл полной среды для культивирования клеток DMEM).
Результаты представлены на логической диаграмме ниже.Рисунок 3иРисунок 4показать результаты всех экспериментов. Приведены результаты анализа как синтеза мРНК исследуемых цитокинов, так и фагоцитарной активности тех же макрофагов для препаратов C GcMAF LEV L pure 37 °C и GcMAF2. Результаты были классифицированы в соответствии с ДАД, использованным в исследовании.
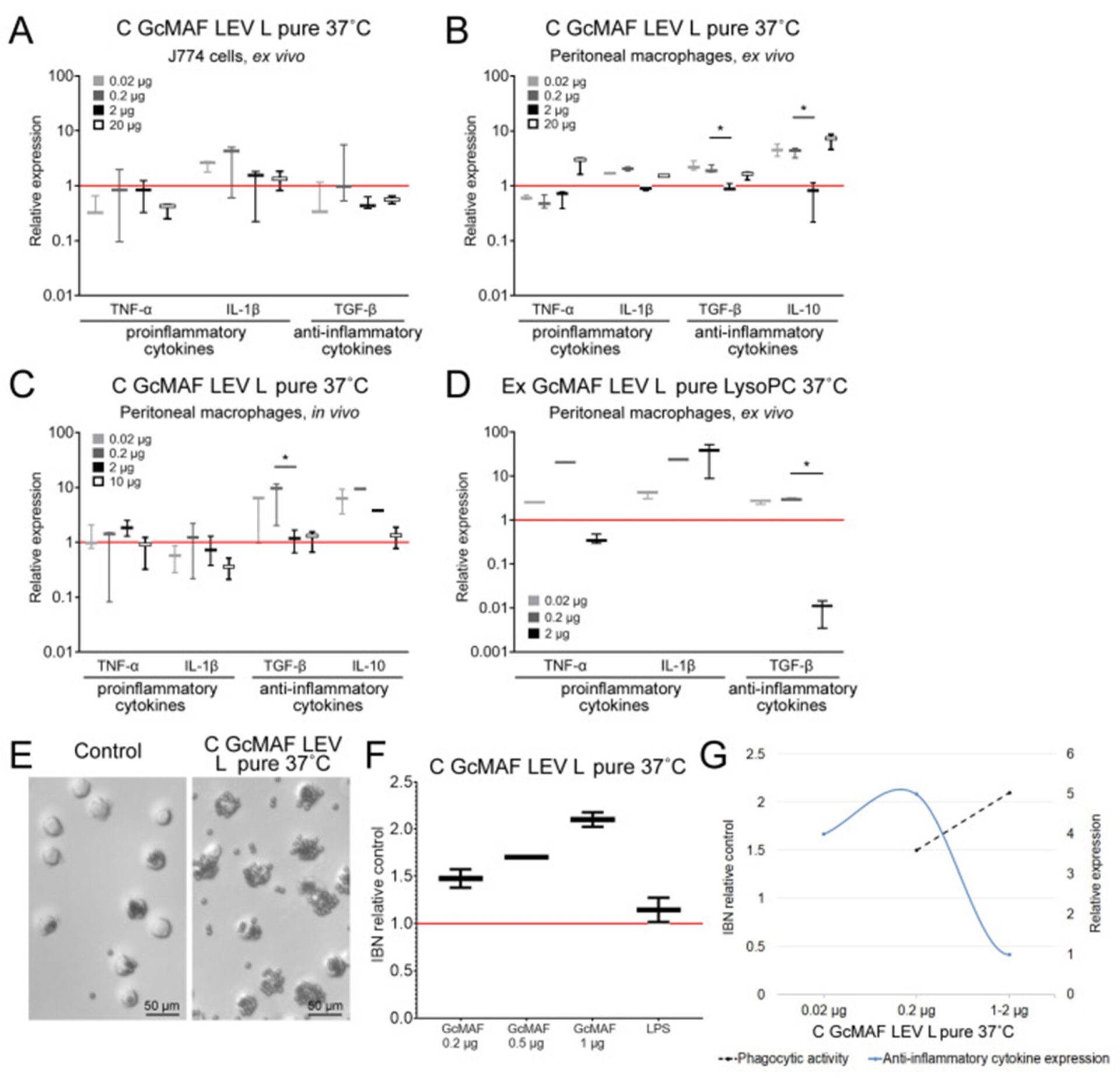
Влияние различных образцов GcMAF, полученных от одного донора (LEV), на экспрессию цитокинов, линию макрофагов J774 и ПМ ex vivo и in vivo, а также фагоцитарную активность мышиных ПМ в дозах 0,02 мкг, 0,2 мкг, 0,5 мкг, 1 мкг, 2 мкг и 10–20 мкг (за исключением ( D ) с 0,02 мкг, 0,2 мкг и 2 мкг) препарата относительно контроля (необработанного), уровень экспрессии которого принимался равным 1 (красная сплошная линия).
( A – C ) Экспрессия мРНК генов цитокинов в клетках J774 и в перитонеальных макрофагах мышей, обработанных C GcMAF LEV L, чистый, 37 °C. ( А ) Клетки J774, ex vivo. ( Б ) Перитонеальные макрофаги, ex vivo.
( C ) Перитонеальные макрофаги, in vivo.
( D ) Экспрессия мРНК генов цитокинов в перитонеальных макрофагах мышей ex vivo, обработанных Ex GcMAF LEV L, чистый LysoPC, 37 °C.
( E , F ) Оценка фагоцитарной активности перитонеальных макрофагов, обработанных C GcMAF LEV L, чистый 37 ° C, по их способности интернализировать металлические шарики.
( E ) Изображения гранул, фагоцитированных наивными макрофагами (контроль) и макрофагами, обработанными C GcMAF LEV L, чистый, 37 °C.
( F ) Количественная оценка фагоцитарной активности ПМ (ИБН), обработанных C GcMAF LEV L, чистый 37 ° C, и ЛПС (10 мкг/мл) в качестве положительного контроля. В качестве контроля использовали наивные макрофаги; их фагоцитарная активность принималась равной 1 (красная сплошная линия).
( G ) Сравнение фагоцитарной активности (пунктирная линия) и экспрессии мРНК генов противовоспалительных цитокинов (немонотонная) в мышиных ПМ, активированных различными дозами C GcMAF LEV L, чистый, 37 °C. IL-10 не показан на ( A , D ) из-за неопределяемого уровня соответствующей мРНК в этих образцах. Мы отметили значимость различий между дозами GcMAF 0,2 и 2 мкг (* p < 0,05; U-критерий Манна-Уитни).
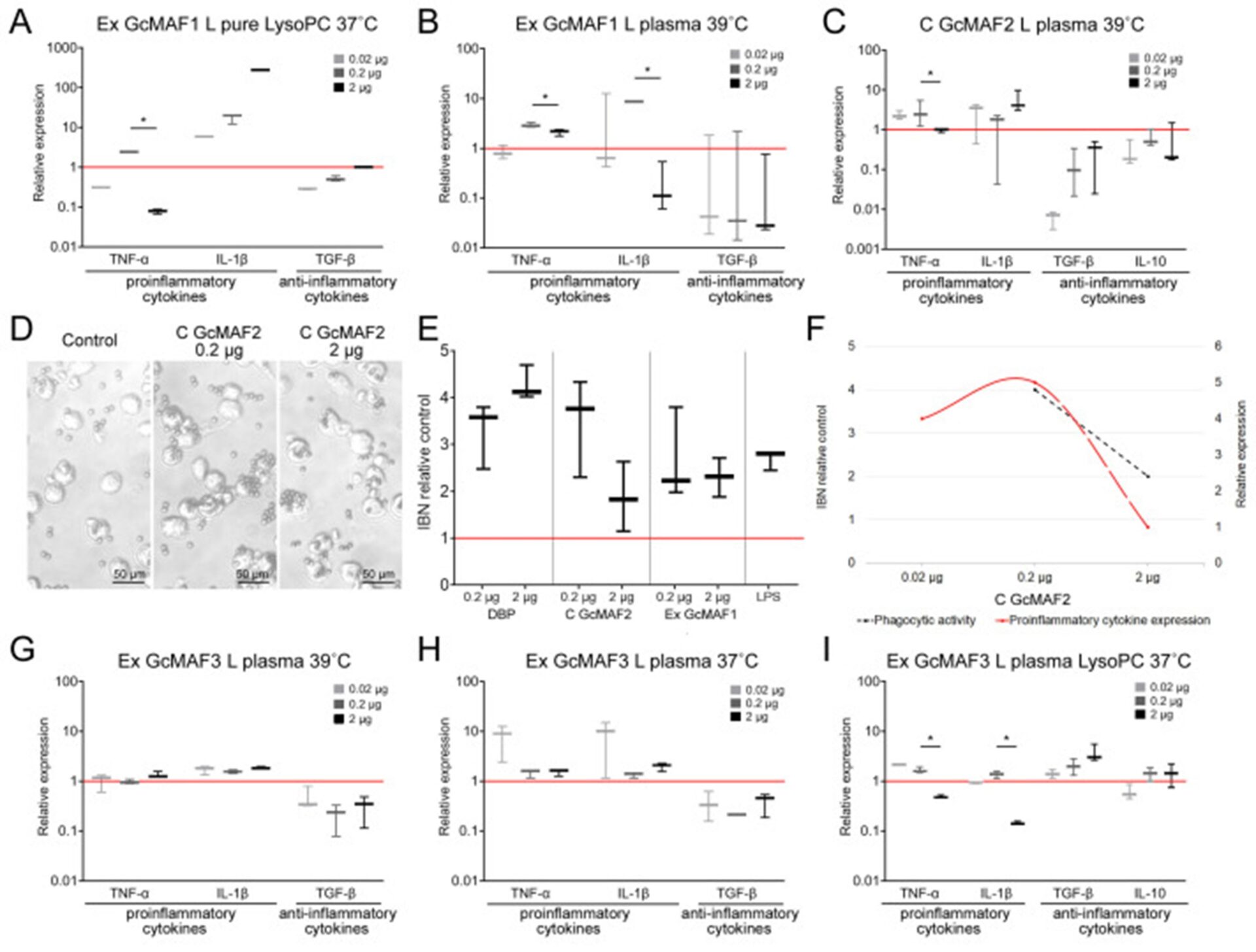
Влияние различных образцов GcMAF, полученных от разных доноров разными методами, на экспрессию мРНК цитокинов и фагоцитарную активность мышиных ПМ с 0,02 мкг, 0,2 мкг и 2 мкг препарата по отношению к контролю (необработанному), уровень экспрессии которого предполагался равным 1 (красная сплошная линия). ( A – C ) Экспрессия мРНК генов цитокинов в перитонеальных макрофагах мышей, обработанных GcMAF, полученных от разных доноров с использованием разных методов. ( A ) Ex GcMAF1 L, чистый LysoPC, 37 °C. ( B ) Плазма Ex GcMAF1 L, 39 °C. ( C ) C GcMAF2 L плазма 39 °C. ( D , E ) Оценка фагоцитарной активности перитонеальных макрофагов, обработанных C GcMAF2, по их способности интернализировать металлические шарики. ( D ) Изображения гранул, фагоцитированных наивными макрофагами (контроль) и макрофагами, обработанными C GcMAF2. ( E ) Количественная оценка фагоцитарной активности ПМ (IBN), обработанных DBP, C GcMAF2, Ex GcMAF1 и LPS (10 мкг/мл) в качестве положительного контроля. Наивные макрофаги, фагоцитарная активность которых была принята равной 1, использовались в качестве контроля (красная сплошная линия). ( F ) Сравнение фагоцитарной активности (пунктирная линия) и экспрессии мРНК провоспалительных цитокинов (немонотонная) в мышиных ПМ, активированных различными дозами C GcMAF2. ( G – I ) Экспрессия мРНК генов цитокинов в ПМ мышей, обработанных GcMAF, полученным от одного и того же донора (GcMAF 3), с использованием разных методов. ( G ) Ex GcMAF3 Lплазма 39 °C. ( H ) Ex GcMAF3 L плазма 37 °C. ( I ) Ex GcMAF3 L плазма LysoPC 37 °C. IL-10 не показан на ( A , B , G , H ) из-за неопределяемого уровня соответствующей мРНК в этих образцах. Мы отметили значимость различий между дозами GcMAF 0,2 и 2 мкг (* p < 0,05; U-критерий Манна-Уитни).
Мы рассматривали C GcMAF LEV L чистым при 37 °C. Анализ проводили с использованием трех модельных систем: линии макрофагов J774, ПМ, обработанных ex vivo, и экспериментальных животных, обработанных in vivo, с последующим анализом ПМ. В культуре клеток было обнаружено, что синтез мРНК IL-1β активируется. Синтез мРНК других цитокинов не активировался.
Обработка ПМ ex vivo активировала синтез всех анализируемых цитокинов. Для системы in vivo синтез мРНК провоспалительных цитокинов был незначительным. При лечении in vivo синтез противовоспалительных TGF-β и IL-10 увеличивался в десять раз по сравнению с контролем. Анализ in vivo показал, что ПМ, подвергнутые активации C GcMAF LEV L pure 37 °C, проявляли противовоспалительную реакцию.
Анализ диаграммы фагоцитарной активности после активации C GcMAF LEV L pure 37 °С в разных дозах показал, что активность последовательно возрастала с увеличением дозы препарата. Синтез мРНК противовоспалительных цитокинов TGF-β и IL-10 достиг максимальных значений при двух минимальных дозах и упал до нуля при следующей максимально подобранной дозе 1–2 мкг (Рисунок 3А-В, Е-Ж).
Таким образом, для противовоспалительных цитокинов TGF-β и IL-10 характерна немонотонная (колокольчатая) диаграмма синтеза мРНК с максимумом при низких дозах (0,02, 0,2 мкг). Для всех анализируемых цитокинов значение, соответствующее дозе 1–2 мкг, упало до нуля.Рисунок 3На Э–Г представлен сравнительный анализ способности ПМ индуцировать синтез мРНК противовоспалительных цитокинов с одновременным фагоцитозом металлических шариков. Эти ПМ, вероятно, имеют фенотип М2.
На графике (Ж) показано, что синтез мРНК противовоспалительных цитокинов не мешает фагоцитарной активности ПМ, которая остается на высоком уровне. После ингибирования ПМ синтеза мРНК противовоспалительных цитокинов, что считается характерным для фенотипа М2, фагоцитарная активность значительно возрастает.
Максимальный провоспалительный ответ фагоцитов достигался при активации ПМ с помощью Ex GcMAF LEV L чистого LysoPC 37 °C, конвертированного чистыми лейкоцитами, полученными путем проведения быстрой обработки LysoPC (Рисунок 3Д).
GcMAF2 вызывает провоспалительную реакцию у ПМ (Рисунок 4С).Рисунок 4D–F представляет сравнительный анализ способности фагоцитов вызывать провоспалительную реакцию при одновременной интернализации металлических шариков. Эти макрофаги, вероятно, имеют фенотип М1.
Из графика видно, что синтез мРНК провоспалительных цитокинов TNFα и IL-1b не препятствует фагоцитарной активности ПМ, которая остается на высоком уровне. В случае избытка лиганда по отношению к ПМ, что считается характерным для фенотипа М1, синтез мРНК этих цитокинов снижается. Помимо снижения экспрессии мРНК TNFα и IL-1b, снижается и фагоцитарная активность ПМ.
Полученный результат сравнительной активации ПМ двумя вариантами активатора GcMAF свидетельствует о следующем. В случае активации фенотипа М2 ПМ фагоцитарная активность проявляется как нормальный фагоцитарный ответ. Когда синтез мРНК TGF-β и IL-10 ингибируется, фагоцитарная активность увеличивается. При активации фенотипа М1 ПМ фагоцитарная активность находится на высоком уровне и снижается вместе со снижением уровня экспрессии мРНК провоспалительных цитокинов.
Таким образом, фагоцитарная активность как нормальная реакция фагоцитов обнаруживается как в ПМ М1, так и в ПМ М2. Различия наблюдаются при ингибировании синтеза мРНК. В случае клеток М2 и ингибировании экспрессии противовоспалительных цитокинов фагоцитоз значительно усиливается. В случае клеток М1 помимо снижения экспрессии провоспалительных цитокинов снижается и фагоцитарная активность ПМ.
GcMAF1 вызывает провоспалительную реакцию у ПМ. Ответ максимальный при использовании LysoPC (Рисунок 4А, Б).
GcMAF3 вызывает колебательный ответ в ПМ в зависимости от обработки лейкоцитами. Один из выбранных режимов ингибирует экспрессию мРНК всех анализируемых цитокинов (Рисунок 4Г). Два других режима демонстрируют разнонаправленные эффекты при активации ПМ (Рисунок 4ПРИВЕТ).
2.5. Анализ флуоресцентной микроскопии распределения меченного Cy5 GcMAF на ПМ
В экспериментах с использованием C GcMAF LEV L pure 37 °C мы наблюдали немонотонную (колокольчатую) кривую эффективности синтеза мРНК и четко выраженный эффект ингибирования синтеза любых цитокинов при использовании GcMAF в дозе 2 мкг. Об этом явлении сообщалось в литературе, и считается, что оно связано с агрегацией рецепторов при высоких дозах лигандов. Это означало, что цитологический анализ образца с большим количеством лиганда может выявить участки агрегации рецепторных молекул на ПМ [ 52 , 53 , 54 , 55 ].
Для проверки этого предположения C GcMAF LEV L pure 37 °C был помечен Cy5 и была проведена обработка ПМ. Были выбраны три рабочие дозы (0,02 мкг, 0,2 мкг и 2,0 мкг). Конфокальная визуализация живых клеток показала, что для двух меньших доз меченый материал располагался в цитоплазме и ядре клетки.Рисунок 5А-В). В случае использования дозы 2,0 мкг были обнаружены (1) метка очень высокой интенсивности, покрывающая всю клетку, (2) внутриклеточная метка и (3) специфические пятна флуоресценции на поверхности макрофагов (Рисунок 5Д). Эти пятна могут представлять собой агрегированные рецепторы, структурированные избыточным лигандом, что согласуется с имеющимся в литературе мнением.
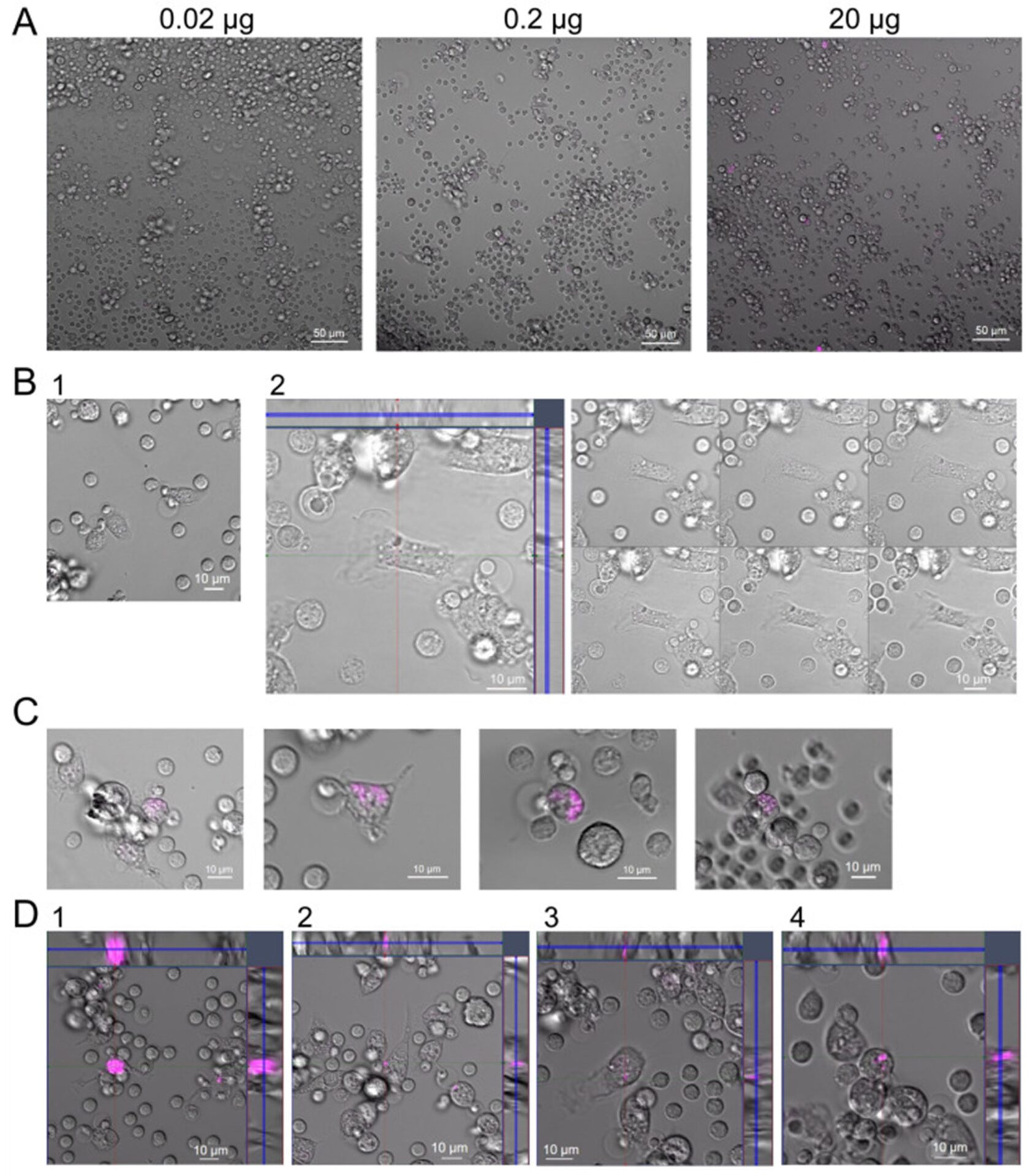
Флуоресцентно-цитологический анализ взаимодействия ПМ и Cy5-GcMAF, содержащихся в инкубационной среде в различных дозах. ( А ) Общий вид ПМ, инкубированных в присутствии трех доз Cy5-GcMAF: 0,02 мкг, 0,2 мкг и 20 мкг. ( Б ) ПМ, инкубированные в присутствии 0,02 мкг лиганда. Очень небольшое количество Cy5-GcMAF распределено в цитоплазме ПМ. ( С ) ПМ, инкубированные в присутствии 0,2 мкг лиганда. Меченый материал Cy5-GcMAF четко обнаруживается в цитоплазме ПМ. ( D ) ПМ, инкубированные в присутствии 2 мкг лиганда. Обнаружено два варианта распределения меченого материала Cy5-GcMAF. Cy5-GcMAF занимает большую часть внутренней части клетки (1); Cy5-GcMAF находится на внешней поверхности клетки в виде четко очерченного пятна (2–4).
Выводы первой части исследования:
Анализ, проведенный в первой части исследования, выявил следующие особенности системы GcMAF/PM.
(1) Анализ тандемной масс-спектрометрии показал, что ДБФ элюируются из аффинной колонки вместе с белком АроА1. Анализ сэндвич-типа предполагает, что GcMAF (но не DBP) может напрямую взаимодействовать с ApoA1. Однако мы полагаем, что совместная элюция двух факторов связана с молекулой-лигандом, одна часть которой действует как матрица сродства для GcMAF, а другая часть служит матрицей для ApoA1;
(2) ДАД от различных доноров без дополнительной обработки активируют ПМ для продукции анализируемых цитокинов;
(3) Фагоцитарная активность как нормальный фагоцитарный ответ наблюдается как в ПМ М1, так и в М2. Различия наблюдаются при ингибировании синтеза мРНК. В случае клеток М2 и ингибировании экспрессии противовоспалительных цитокинов фагоцитоз значительно усиливается. В случае клеток М1 помимо снижения экспрессии провоспалительных цитокинов снижается и фагоцитарная активность ПМ;
(4) Высокие дозы GcMAF (>1 мкг в рабочей системе, см. «Материалы и методы») полностью подавляют экспрессию анализируемых цитокинов. Считается, что это явление связано с агрегацией рецепторов на мембране после связывания лиганда (GcMAF);
(5) Используя подход преобразования DBP в GcMAF с участием лейкоцитов, описанный Ямамото [ 56 ], мы попытались найти режим, который можно было бы воспроизвести во всех последующих экспериментах. Используя этот подход, нам не удалось четко определить причины про- и противовоспалительной реакции у ПМ.
Этот вывод определил необходимость продолжения поисков.
Часть II.
2.6. Возможный механизм активации ПМ GcMAF
Как следует из экспериментальной литературы, GcMAF несет свободный фрагмент GalNAc в положении Thr 420 аминокислотной последовательности [ 6 , 11 , 28 , 29 , 30 , 31 , 42 , 44 , 45 , 46 ] .
Высокоаффинные углеводсвязывающие рецепторы хорошо изучены [ 57 ]. Для GalNAc описаны два специфических рецептора: ASGR1 (CLEC4H1) и CLEC10A (MGL или CD301). При отсутствии патологических проявлений CLEC10A экспрессируется на толерогенных тканерезидентных дендритных клетках, макрофагах кожи и легких, а также ПМ.
Различные индуцирующие события значительно увеличивают экспрессию рецептора C-лектина; при взаимодействии с лигандом толерогенные антигенпрезентирующие клетки индуцируют либо развитие Treg (регуляторных лейкоцитов), либо анергию иммунных клеток и, в частности, Т-клеток посредством MGL (CLEC10A)-зависимого механизма [ 57 , 58 , 59 , 60 ].
Это означает, что CLEC10A является основным кандидатом на взаимодействие с GcMAF. Тот факт, что ДБФ (GalNAc которого, как предполагается, замыкается остатками двух других сахаридов) в определенных случаях индуцирует синтез мРНК различных анализируемых цитокинов либо дозозависимым, либо дозонезависимым образом, может указывать на три возможных варианта: сценарии. (1) Некоторые DBP уже дегликозилированы и несут концевой GalNAc. Однако в этом случае кривые активации должны совпадать с кривыми GcMAF, но они существенно отличаются (фигура 2,Рисунок 3иРисунок 4). (2) Возможно частичное дегликозилирование. (3) синтез мРНК в ПМ активируется ДАД по другому механизму.
Сравнивая кривые синтеза мРНК под действием ДБФ и GcMAF, можно предположить, что обработка ДБФ лейкоцитами изменяет структуру ДБФ настолько, что режим активации полностью меняется. ДАД связывается с определенным фактором активации макрофагов и активирует ПМ. В наших исследованиях конверсия модифицировала молекулу ДБФ и либо отменяла ранее существовавшее связывание ДБФ с ПМ, либо образовывала новое, что изменяло режим активации.
Чтобы пролить свет на эти аспекты, были проведены исследования, характеризующие взаимодействие между DBP, GcMAF и CLEC10A.
2.7. Анализ взаимодействия между GcMAF и коммерчески очищенным CLEC10A
GcMAF содержит аддукт с открытым или частично открытым кольцом N-ацетилгалактозамин (GalNAc), связанный с Thr 420 . Дегликозилирование трисахарида и удаление сиаловой кислоты и(или) галактозы (например) в месте воспаления является принципиальным этапом превращения витамина D3-связывающего белка (DBP) в фактор активации макрофагов (GcMAF) [ 27 , 56] . , 61 ].
Свойства специфических углеводсвязывающих рецепторов (лектинов) интенсивно изучаются в течение длительного времени; одним из них является член, принадлежащий к большому семейству Са 2+ -зависимых лектиновых рецепторов С-типа, а именно CLEC10A (лектин галактозного типа макрофагов, MGL, CD301). CLEC10A несет домен распознавания лектина, который связывает концевой или свободный GalNAc [ 60 , 62 , 63 , 64 , 65 ]. Он в изобилии присутствует на плазматической мембране дендритных клеток и активирует макрофаги М2 в тримерной форме [ 52 , 66 , 67 , 68 , 69 , 70 ]; согласно всем современным представлениям, предполагается, что он связывается с GalNAc по остатку треонина 420(418) в GcMAF, конвертируемом в месте воспаления. Это означает, что CLEC10A является ключевым кандидатом на роль фактора, опосредующего активирующую активность GcMAF [ 37 ].
Была разработана методика сэндвич-анализа и проведена серия экспериментов, характеризующих взаимодействие GcMAF и CLEC10A.Рисунок 6показаны результаты анализа взаимодействия этих факторов.
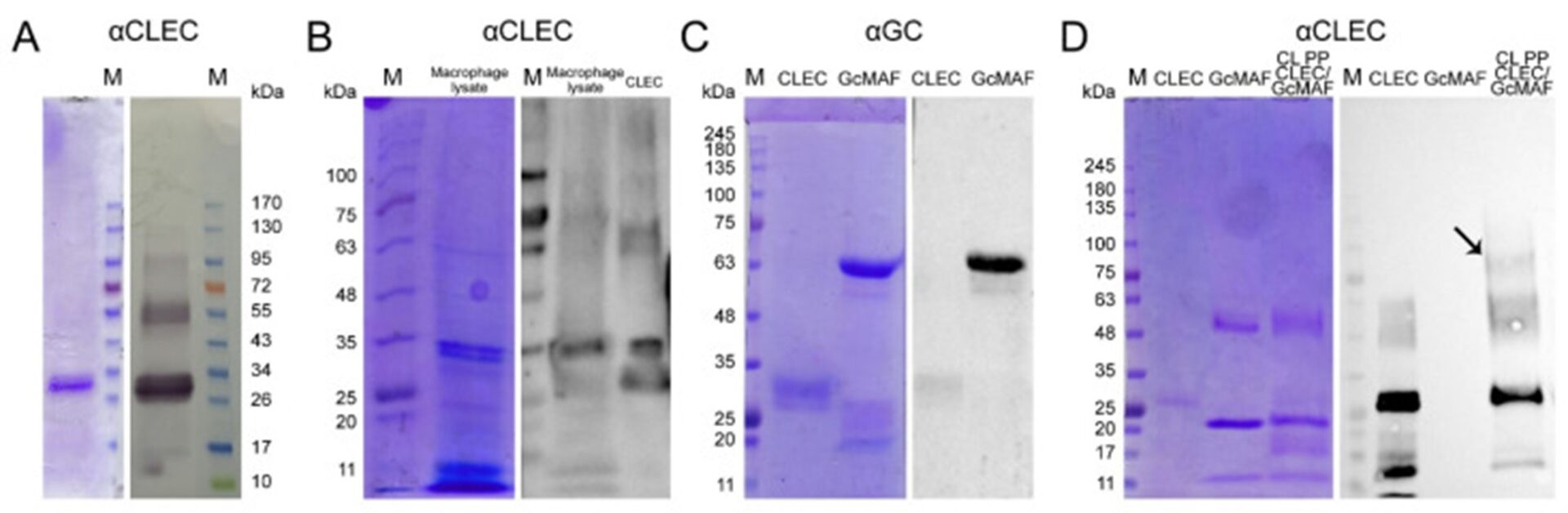
Анализ взаимодействия GcMAF и CLEC10A. ( A ) Взаимодействие между белком CLEC10A и антителами против CLEC10A при вестерн-блоттинге. Отчетливо визуализируются высокомолекулярные производные белка CLEC10A. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). ( B ) Вестерн-блоттинг взаимодействия белков лизата PM и белка CLEC10A с антителами против CLEC10A. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). ( C ) Вестерн-блоттинг перекрестной реактивности антител против GcMAF и белка CLEC10A. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). ( D ) Анализ прямого взаимодействия между GcMAF и CLEC10A в эксперименте по перекрестному сшиванию с использованием параформальдегида в качестве сшивающего агента и антител против CLEC10A. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). На изображении вестерн-блоттинга ясно видно, что между GcMAF и антителами против CLEC10A нет перекрестной гомологии. Стрелкой показан сшитый продукт, молекулярная масса которого соответствует массе комплекса GcMAF/CLEC10A (дорожка 3).
Показано, что ПМ мышей C57BL/6 содержат CLEC10A и что рецептор специфически взаимодействует с фактором активации макрофагов. В ходе блота было обнаружено несколько фракций, взаимодействующих с антителами против CLEC10A (Рисунок 6А, Б).
Анализ перекрестной реактивности антител анти-GC и анти-CLEC10A не выявил значимого перекрестного сродства (Рисунок 6C,D), поэтому можно было провести эксперименты, направленные на прямое взаимодействие между белками GcMAF и CLEC10A (Рисунок 6Переулок D 3).
В ранних экспериментах, направленных на оценку прямого взаимодействия между CLEC10A и GcMAF, проявляющего более сильную провоспалительную активность, мы проанализировали потенциальное взаимодействие между анализируемыми факторами посредством сшивания формальдегидом.
Технически анализ проводился с использованием следующей процедуры.
Проводили сшивку белков в растворе с последующим электрофорезом и переносом на мембрану. Мембрану обрабатывали антителами против CLEC10A. Обнаружено появление высокомолекулярной фракции, подвижность которой предположительно соответствует подвижности комплекса GcMAF/CLEC10A (показана стрелкой) (Рисунок 6Д).
Затем были проведены эксперименты, характеризующие прямое взаимодействие между двумя факторами с помощью сэндвич-анализа.
После электрофореза либо CLEC10A, либо GcMAF переносили на мембрану и обрабатывали противоагентом. Полученный комплекс детектировали с использованием соответствующих антител, конъюгированных с HRP.Рисунок 7A–C,E,H представляют результаты эксперимента.
Выявлены специфические белок-белковые взаимодействия в обоих направлениях. В экспериментах использовали препараты GcMAF, полученные конверсией в различных режимах. GcMAF3, полученный в режиме Ex GcMAF3 L в плазме при 39 °C, был выбран в качестве основного анализируемого препарата, для которого наблюдалась почти нулевая экспрессия мРНК всех анализируемых цитокинов (Рисунок 3Г). В ряде других экспериментов использовались и другие препараты GcMAF, которые были прямо указаны при описании результатов эксперимента.
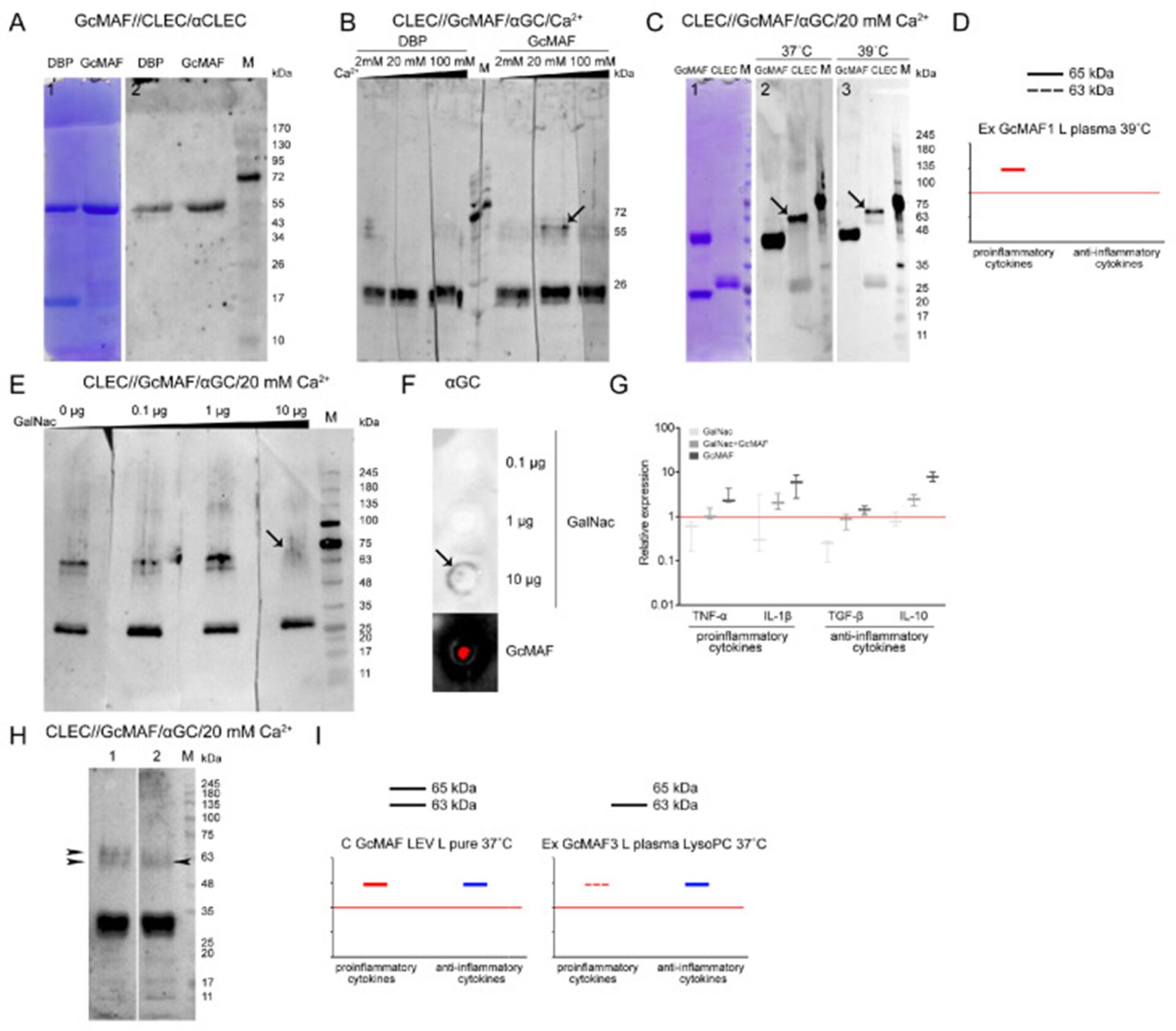
Анализ прямого взаимодействия между GcMAF и CLEC10A. ( А ) Сэндвич-анализ прямого взаимодействия между фракциями белков, выделенных из 25-OH-D 3 /сефарозы ® : DBP и ApoA1, а также взаимодействия между GcMAF в том же образце и белком CLEC10A. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). Для анализа использовали образец GcMAF3. Результат показывает, что и DBP, и GcMAF3 напрямую связываются с CLEC10A. ApoA1 напрямую не взаимодействует с CLEC10A. ( B ) Анализ сэндвич-типа, демонстрирующий, что ионы Ca 2+ необходимы для прямого взаимодействия между высокомолекулярными производными CLEC10A и GcMAF. Результаты показывают, что высокомолекулярное производное CLEC10A (~65 кДа) связывается непосредственно с белком GcMAF, когда инкубационная система вестерн-блоттинга содержит 20 мМ Ca 2+ . Белок CLEC10A не связывается с предшественником DBP при выбранных концентрациях Ca 2+ . Стрелка показывает конкретный сигнал. ( C ) Анализ влияния температуры на прямое взаимодействие между белками CLEC10A и GcMAF. Анализ сэндвич-типа. Окрашивание Кумасси (слева) и вестерн-блоттинг (справа). Стрелки показывают конкретный сигнал. Для анализа используется образец GcMAF3. ( D ) Аватар диаграммы экспрессии мРНК анализируемых генов цитокинов в ПМ, обработанных GcMAF1 (Рисунок 4А) демонстрация того, что провоспалительный ответ ПМ зависит от связывания GcMAF и производного CLEC10A массой 65 кДа. Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, был обозначен красной сплошной линией. ( E ) Дот-блот-анализ сэндвич-типа взаимодействия между CLEC10A и GcMAF в условиях конкурентного присутствия свободного GalNAc. Результаты показывают, что когда инкубационная система вестерн-блоттинга содержит 10 мкг свободного GalNAc, связь между производным CLEC10A массой 65 кДа и GcMAF разрывается. Стрелка показывает ухудшение конкретного сигнала. Для анализа используется образец GcMAF3. ( F ) Анализ перекрестного взаимодействия между свободным GalNAc и антителами против Gc. Стрелкой показан специфический сигнал перекрестного взаимодействия; ( Ж ) in vivo анализ экспрессии мРНК анализируемых генов цитокинов в ПМ в условиях конкурентного взаимодействия между GcMAF и свободным GalNAc. Для анализа используется образец GcMAF3. Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, был обозначен красной сплошной линией. ( H ) Сэндвич-анализ прямого взаимодействия между CLEC10A и двумя вариантами GcMAF (дорожка 1 — C GcMAF LEV L pure, 37 °C; дорожка 2 — GcMAF3 L, плазма LysoPC, 37 °C), характеризующиеся противоположными способностями активировать ПМ по отношению к мРНК. экспрессия про- и противовоспалительных цитокинов. Стрелками показаны изменения во взаимодействии высокомолекулярных производных CLEC10A (63 кДа и 65 кДа) с GcMAF. В варианте, где GcMAF проявляет более выраженные противовоспалительные свойства (GcMAF3 L плазма LysoPC 37 °C), специфически взаимодействует с GcMAF преимущественно высокомолекулярное (63 кДа) производное CLEC10A. ( I ) Аватары диаграмм экспрессии мРНК анализируемых генов цитокинов в ПМ, обработанных C GcMAF LEV L pure 37 °C и GcMAF3 L в плазме LysoPC 37 °C (Рисунок 3ГруппаРисунок 4А соответственно). Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, был обозначен красной сплошной линией. На графиках (D,I) схематически показано: красная линия указывает направление провоспалительной реакции, синяя линия указывает направление противовоспалительной реакции. Черные линии обозначают производные CLEC10A. Сплошные линии указывают на сильное взаимодействие GcMAF с производными CLEC10A и сильную воспалительную реакцию. Пунктирные линии указывают на слабое взаимодействие GcMAF с производными CLEC10A и слабую воспалительную реакцию. Отсутствие линии на графике означает, что GcMAF не взаимодействует с производными CLEC10A. Основная идея графика — показать, что взаимодействие GcMAF с производным CLEC10A массой 65 кДа индуцирует провоспалительную реакцию, а с производным массой 63 кДа — противовоспалительную реакцию.
Один из ключевых вопросов был связан с влиянием ионов Ca 2+ на взаимодействие концевого карбоксигидрата DBP и GcMAF с CLEC10A. Считается, что ионы Ca 2+ ответственны за направление фагоцитарного ответа [ 64 , 65 , 71 ].
Предшественник DBP3 и GcMAF3 конвертируются экспресс-методом лейкоцитами в нативной плазме, активированной нагреванием (39 °С) с нейтральными или почти нейтральными характеристиками (режим Ex GcMAF3 L плазма 39 °С,Рисунок 4G) были использованы для анализа. Полоски с выделенными CLEC10A обрабатывали фактором активации макрофагов в присутствии Ca 2+ в различных концентрациях (2 мМ, 20 мМ и 100 мМ). После инкубации комплексы детектировали с помощью антител против Gc. Было обнаружено , что фракция CLEC10A, соответствующая общеизвестной форме белка массой 29 кДа [ 72 , 73 ], реагирует как с DBP, так и с GcMAF, без видимой разницы в условиях вестерн-блоттинга. Специфическое взаимодействие обнаружено только с высокомолекулярными фракциями препарата.
Два белка (высокомолекулярные производные CLEC10A, ~63 и ~65 кДа), специфически связывающиеся с GcMAF, появились в образце CLEC10A, обработанном GcMAF3 (режим Ex GcMAF3 L в плазме при 39 °C) в присутствии 20 мМ Ca2 . + ионы. В этом эксперименте наиболее сильное взаимодействие наблюдалось для белка ~65 кДа. После очередного повышения концентрации Ca 2+ связывания практически не было. Результаты показали, что в условиях вестерн-блот-анализа 20 мМ ионы Ca 2+ открывают рецепторный сайт, связывающийся с концевым углеводом в GalNAc GcMAF3 (режим Ex GcMAF3 L в плазме при 39 °C), что типично для CLEC10A (показано как Стрелка) (Рисунок 7Б).
Мы дополнительно проанализировали эффективность связывания CLEC10A с GcMAF (режим Ex GcMAF1 L pure LysoPC 37 °C); Наблюдалась значительная провоспалительная активность при двух температурах (37°C и 39°C) в присутствии оптимальной концентрации Ca 2+ . Температура не влияла на специфичность взаимодействия (Рисунок 7С). Белок массой 65 кДа был основным реагирующим белком. Эффективность взаимодействия белка массой 63 кДа была в несколько раз ниже.
Чтобы проверить гипотезу о том, что GcMAF связывается через концевой GalNAc, мы провели эксперименты, включающие конкурентное ингибирование связывания GalNAc-GcMAF свободным GalNAc. Результаты анализа представлены вРисунок 7НАПРИМЕР. Показано, что свободный GalNAc конкурирует с концевым GalNAc в GcMAF за связывание со специфическим высокомолекулярным производным CLEC10A, не позволяя ему образовывать четко выраженный комплекс с белком, что проявляется в появлении нечеткого мазка, выявляемого антителами. (Рисунок 7Е; полоса 4).
Чтобы выяснить, что размытый мазок принадлежит комплексу GalNAc/рецептор, а не комплексу GcMAF/рецептор, мы проанализировали способность анти-Gc-антител взаимодействовать с чистым GalNAc. Было показано, что антитела против Gc специфически связывают GalNAc, что указывает на то, что углеводсодержащий сайт белка GcMAF является антигеном и индуцирует антитела против GalNAc, и это самое взаимодействие предположительно выявляется в виде мазка, когда GcMAF конкурентно заменяется из своего комплекс с высокомолекулярной фракцией CLEC10A массой 65 кДа в присутствии 20 мМ Ca 2+ и 10 мкг свободного GalNAc (Рисунок 7Э, Ф).
Были проведены эксперименты ex vivo, характеризующие конкурентные взаимодействия между свободными и терминальными углеводами в составе GcMAF. ПМ обрабатывали GalNAc, GcMAF и GalNAc + GcMAF и проводили ПЦР в реальном времени. Показано, что оба соединения конкурируют за связывание с рецептором, ответственным за активацию экспрессии мРНК анализируемых цитокиновых генов (Рисунок 7Г). В этом эксперименте выбранный GcMAF (режим Ex GcMAF3 L в плазме при 39 °C) активировал ПМ для экспрессии как про-, так и противовоспалительных цитокинов. Кроме того, результаты, полученные ex vivo, демонстрируют, что свободный GalNAc не активирует ПМ для экспрессии мРНК анализируемых цитокинов.
Дополнительно был проведен сравнительный анализ взаимодействия CLEC10A с двумя препаратами GcMAF, полученными разными методами конверсии: C GcMAF LEV L pure 37° и Ex GcMAF3 Plasma LysoPC 37°C. Первый препарат GcMAF активирует разнонаправленные реакции в ПМ (Рисунок 3Б), тогда как второй активирует ПМ преимущественно в сторону противовоспалительного ответа, хотя при определенных дозах наблюдается незначительная экспрессия мРНК генов TNF-α и IL-1β ((Рисунок 4Я). Оказалось, что два типа ответов (т.е. два типа GcMAF) характеризуются разными паттернами связывания с двумя высокомолекулярными производными CLEC10A.
Препарат C GcMAF LEV L pure 37 °C, активирующий оба направления воспалительного ответа в ПМ, характеризуется тем, что обе фракции имеют более сильную интенсивность полосы 65 кДа, тогда как плазменный препарат Ex GcMAF3 LysoPC 37 °C, который в основном активирует противовоспалительный ответ в ПМ, преимущественно характеризуется полосой 63 кДа (Рисунок 7ЧАС).
Этот факт может указывать на то, что взаимодействие GcMAF в основном (или только) с производным CLEC10A 63 кДа отвечает за активацию противовоспалительного ответа как единственное направление, тогда как связывание только с полосой 65 кДа отвечает за активацию провоспалительного ответа. ответ, как это следует из активации PM с помощью Ex GcMAF1 L, чистого LysoPC, 37 °C (Рисунок 4А иРисунок 7Д).
Одновременное взаимодействие с двумя производными активирует оба направления воспалительного ответа в ПМ. Этот результат также дает основание предположить, что два высокомолекулярных производных CLEC10A (63 кДа и 65 кДа) представляют собой близкие «аллельные» формы одного и того же белкового фактора, специфически связывающие GcMAF.
2.8. Анализ взаимодействия GcMAF и CLEC10A в мышиных ПМ
В заключительной части экспериментального исследования мы проанализировали несколько вариантов взаимодействия GcMAF с белками лизата ПМ в системе вестерн-блоттинга сэндвич-типа в присутствии и в отсутствие ионов Са 2+ (как в культуральной среде, так и в аналитической системе). решения). Ex GcMAF3 L плазма LysoPC 37 °C (Рисунок 4I) взаимодействует с тремя основными фракциями лизата ПМ, подвижность которых соответствует подвижности CLEC10A 29 кДа, ~63 кДа и ~65 кДа. В присутствии ионов Ca 2+ специфическое взаимодействие со всеми фракциями CLEC10A усиливается (Рисунок 8А, Б).
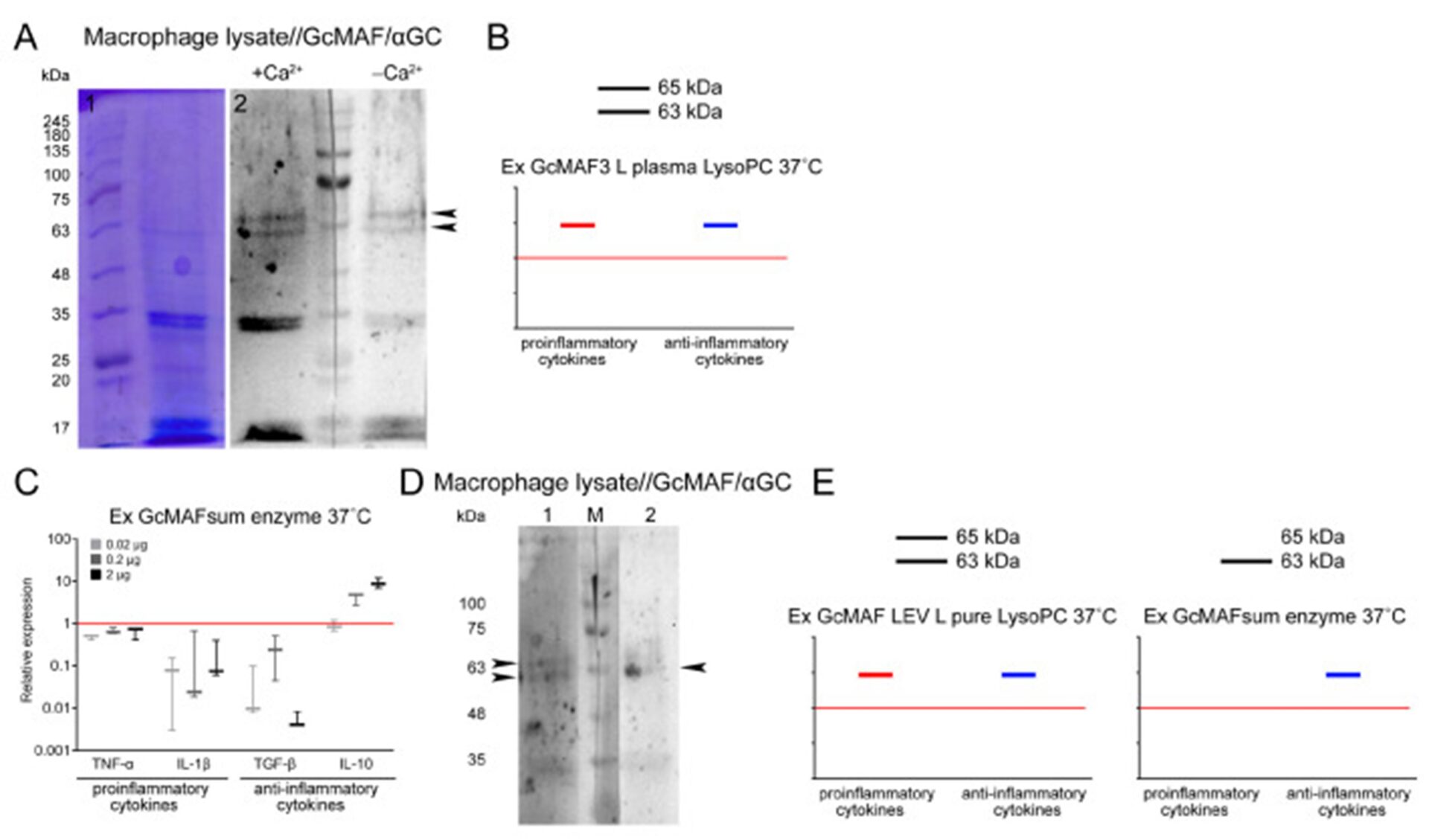
Анализ прямого взаимодействия между GcMAF и белками лизата ПМ. ( А ) Сэндвич-анализ прямого взаимодействия между лизатом PM и белком GcMAF в присутствии и в отсутствие ионов Ca 2+ .
Окрашивание Кумасси (слева) и вестерн-блоттинг сэндвич-типа (справа). Обнаружено, что блот содержит специфически реагирующие белковые фракции, соответствующие обычному CLEC10A массой 29 кДа, и две высокомолекулярные фракции, подвижность которых соответствует подвижности высокомолекулярных производных CLEC10A.
Отсутствие ионов Са 2+ в инкубационной системе вестерн-блоттинга сэндвич-типа существенно снижает интенсивность специфического сигнала, характеризующего прямое взаимодействие между двумя белками. В отсутствие ионов Ca 2+ полоса 63 кДа реагирует с GcMAF в меньшей степени, чем с белком 65 кДа.
Обе фракции с высокой эффективностью взаимодействуют с GcMAF в присутствии ионов Ca 2+ . ( Б ) Аватары диаграмм синтеза мРНК анализируемых цитокинов в ПМ, обработанных Ex GcMAF3 L в плазме LysoPC 37 °C (Рисунок 4Я). Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, обозначен красной сплошной линией ( С ). Схема синтеза мРНК анализируемых цитокинов в ПМ, обработанных препаратом GcMAF, полученным путем конверсии с использованием очищенных ферментов.
Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, был обозначен красной сплошной линией. ( D ) Сэндвич-анализ прямого взаимодействия лизата PM с Ex GcMAF LEV L чистым LysoPC 37 °C (синтез мРНК разноориентированных цитокинов) (дорожка 1) и ферментом Ex GcMAFsum 37 °C (выраженный противовоспалительный вектор Синтез мРНК анализируемых цитокинов) (дорожка 2). В первом случае оба высокомолекулярных производных CLEC10A взаимодействуют с GcMAF.
В последнем случае производное массой 63 кДа преимущественно связывается с GcMAF. ( E ) Аватары диаграмм синтеза мРНК анализируемых цитокинов в ПМ, обработанных Ex GcMAF LEV L pure LysoPC 37 °C и ферментом Ex GcMAFsum 37 °C. Контроль (необработанные ПМ), уровень экспрессии которого принимался равным 1, был обозначен красной сплошной линией. На графиках ( Б , Е ) схематически показано: красная линия указывает направление провоспалительной реакции, синяя линия указывает направление противовоспалительной реакции.
Черные линии обозначают производные CLEC10A. Сплошные линии указывают на сильное взаимодействие GcMAF с производными CLEC10A и сильную воспалительную реакцию. Отсутствие линии на графике означает, что GcMAF не взаимодействует с производными CLEC10A.
Основная идея графика – показать, что взаимодействие GcMAF с производным CLEC10A массой 65 кДа индуцирует провоспалительную реакцию, а с производным массой 63 кДа – противовоспалительную реакцию.
Можно отметить, что в случае лизатов макрофагов при появлении в растворе ионов Са 2+ GcMAF более активно связывается с белком массой 63 кДа по сравнению с чистым препаратом CLEC10A, что коррелирует с более выраженным противовоспалительным ответом ПМФ, показанным для этого препарата GcMAF (Рисунок 8С–Е).
Это различие можно объяснить различиями в структуре подлинного и коммерчески доступного CLEC10A. Также справедливо предположить, что два варианта GcMAF, различающиеся расположением остатков сахаров на треонине 420(418) или степенью дегликозилирования, взаимодействуют с двумя белковыми фракциями и существует стохастическая конкуренция по интернализации между аллельными аллелями CLEC10A. привязка форм к конкретной форме GcMAF в каждом конкретном случае.
Такой режим взаимодействия позволяет предположить, что существует определенная вероятность возникновения про- или противовоспалительного ответа у ПМ, причем противовоспалительный ответ является преобладающим для анализируемого препарата GcMAF. Следует отметить, что в этом эксперименте появление ионов кальция в инкубационной среде значительно усиливало связи между GcMAF и каноническим CLEC10A 29 кДа.
В дополнение к результатам, изложенным выше, было обнаружено, что общий GcMAF, конвертированный из смеси DBP, полученных от разных доноров с использованием очищенных ферментов сиалидазы и β-галактозидазы экспресс-методом, взаимодействовал преимущественно с фракцией CLEC10A ~63 кДа и активировал ПМ синтезируют только противовоспалительный IL-10.
В то же время в том же эксперименте другой препарат, Ex GcMAF LEV L pure LysoPC 37 °C, проявляющий сильное провоспалительное и одновременно противовоспалительное активирующее действие на ПМ, взаимодействовал как с фракциями ~63 кДа, так и ~65 кДа CLEC10A в блот-анализ сэндвич-типа (показан стрелками) (Рисунок 8С–Е).
Выводы второй части исследования:
Справедливо сказать, что ПМ несут на своей поверхности несколько производных рецептора CLEC10A.
Связывание GcMAF с низкомолекулярным производным CLEC10A (29 кДа) необходимо для фиксации лиганда. Взаимодействие GcMAF с двумя высокомолекулярными производными CLEC10A (63 кДа и 65 кДа) определяет направление воспалительного ответа.
Провоспалительный ответ возникает только в случае связывания лиганда с производным массой 65 кДа; противовоспалительный ответ возникает только в случае связывания лиганда с производным массой 63 кДа; оба направления воспалительного ответа в ПМ активируются при связывании обоих производных.
- Обсуждение
3.1. Различия в DBP, выделенных с использованием аффинных сорбентов актин/хитин и 25-OH-D 3 /Sepharose ® , тандемный масс-спектрометрический анализ двух фракций, выделенных с использованием 25-OH-D 3 /Sepharose ®
В этом исследовании была предпринята попытка охарактеризовать активирующее влияние фактора активации макрофагов GcMAF на ПМ у мышей C57BL/6. Полученные результаты свидетельствуют о комплексном воздействии фактора активации макрофагов на ПМ, что, по-видимому, связано как с состоянием макрофагов, так и со структурными особенностями молекулы-активатора макрофагов.
Для выделения предшественника из крови мы синтезировали аффинный сорбент со сшитым 25-гидроксивитамином D 3 и разработали методику хроматографии, полностью отличающуюся от методики, описанной ранее в работе. [ 35 ].
25-OH-D 3 /Сефароза ® оказалась стабильным субстратом, позволяющим проводить до девяти и более циклов хроматографии на порцию смолы. По сути, количество циклов хроматографического выделения ограничивается только стабильностью смолы. Это исследование выявило неожиданные свойства ДАД, полученного из крови.
Проведенная аффинная хроматография перекрестного взаимодействия ДБФ, полученного от одного и того же донора (ЛЕВ), показала, что при использовании двух разных доменов во время аффинной хроматографии выделяются две разные формы ДБФ.
Если колонка 25-ОН является основной, то на колонке с Актином связывается только 10% фактора активации макрофагов, полученного из исходного количества ДБФ, элюированного с 25-ОН-Д 3 /Сефарозы ® . Если колонка с актином является основной, с матрицей 25-OH-D 3 /Сефароза ® связывается менее 1% исходного белка.
Поскольку молекулярная масса и наличие антигенной детерминанты Gc у белков, полученных с двух колонок, идентичны, справедливо предположить, что два типа DBP различаются третичной структурой полипептидной цепи, которая и определяет аффинность MAF [ 30 ].
Альтернативное объяснение связано с ингибированием детерминант специфического сродства в белковой молекуле низкомолекулярными производными целевых лигандов (актином или деградантами 25-OH-D 3 ), что не изменяет кажущуюся электрофоретическую подвижность белков.
Вероятно, это может быть лабильный комплекс GcMAF-AlpI, подвергающийся диссоциации в системе Лэммли. Тем не менее, оба варианта активируют ПМ одинаковым образом (данные не представлены), что указывает на то, что сайт гликозилирования функционально активен.
Полученный результат означает, что при разработке терапевтического варианта препарата GcMAF необходимо выбрать надежно стандартизируемый метод выделения фактора активации макрофагов. Для всех наших дальнейших исследований был выбран метод получения ДБФ с использованием 25-OH-D 3 /Сефарозы ® , который позволил последовательно выделить две белковые фракции 58 кДа и 29 кДа.
Тандемный масс-спектрометрический анализ определил семейства белков, к которым принадлежали оба MAF. Как и ожидалось, белок с молекулярной массой 58 кДа оказался белком, связывающим витамин D3; белок с молекулярной массой 28 кДа представлял собой ApoA1. Поэтому в дальнейших исследованиях мы изменили терминологию для белка 58 кДа и стали использовать название «GcMAF» (ранее оно было известно как GcMAF-RF).
Эксперименты по прямому взаимодействию двух белков в ходе сэндвич-блот-анализа DBP/GcMAF и ApoA1 показали, что DBP не связывался с ApoA1, тогда как для GcMAF наблюдалось прямое молекулярное связывание (Рисунок 1(E2), показано стрелкой).
Это свойство еще не интерпретировано и нуждается в дальнейшем изучении. Одновременное выделение двух белков на колонке 25-OH-D 3 /Sepharose ® в составе одного комплекса можно объяснить известным функциональным связыванием ДБФ (GcMAF) и АпоА1 через молекулу витамина D 3 .
Оба белка встречаются в составе хиломикронов, которые одновременно содержат ApoA1 и витамин D3 . Витамин D3 всасывается из желудочно-кишечного тракта, как и другие жирорастворимые соединения.
Он всасывается через энтероциты и высвобождается в лимфатическую систему, встраиваясь в хиломикроны. В хиломикронах витамин D3 может связываться с DBP через аффинный сайт и одновременно ассоциироваться с ApoA1 через остаток холестерина [ 30 , 74 , 75 , 76 ].
Именно эти комплексы предположительно присутствуют в плазме. Два белка можно выделить на колонке как в комплексе, так и по отдельности. В системе Леммли белки мигрируют в соответствии со своей молекулярной массой.
АпоА1 не гликозилирован. Таким образом, результаты ПМ, активирующих дегликозилирование, относятся только к GcMAF, тогда как ApoA1 либо вообще не участвует в активации фагоцитов, либо его участие минимально.
Как уже говорилось выше, по нашему мнению, более вероятным сценарием является связывание двух факторов плазмы крови с двумя частями аффинной матрицы: связывание ApoA1 и DBP с частью циклического холестерина и 25-OH-D 3 соответственно; кроме того, эти факторы, скорее всего, не являются частью единого комплекса.
Препарат, полученный аффинной очисткой на колонке 25-OH-D 3 /Сефароза ® , стабильно состоял из двух описанных выше фракций, обладал воспроизводимыми активирующими свойствами и использовался без разделения двух факторов.
3.2. Анализ направления воспалительной реакции, вызванной ПМ, активированными GcMAF
Для анализа направленности воспалительного ответа в ПМ, активированных GcMAF, мы разработали процедуру активации фагоцитов индуктором макрофагов и выбрали четыре основных цитокина, определяющих направление воспалительного ответа.
Были выбраны провоспалительные медиаторы TNF-α и IL-1β, а также противовоспалительные цитокины, индуцирующие иммунную анергию или развитие Т-регуляторных клеток (TGF-β и IL-10). В данном исследовании для конверсии использовали лейкоциты, активированные различными способами, и очищенные ферменты.
Использовались режимы преобразования, описанные ранее и в разделе «Материалы и методы». Сильный акцент на конверсию воспалительными лейкоцитами можно объяснить тем, что именно воспалительные лейкоциты участвуют в превращении ДБФ в GcMAF в организме [ 27 , 47 ].
Мы оценили эффективность синтеза мРНК указанных цитокинов с использованием нескольких препаратов GcMAF в зависимости от дозы и способа активации лейкоцитов, которые использовались в качестве фактора превращения предшественника ДБФ в фактор активации макрофагов GcMAF.
Установлено, что непреобразованный предшественник индуцирует синтез мРНК указанных цитокинов в ПМ с различной эффективностью. Более того, ДАД, полученный от разных доноров, активирует ПМ в направлении синтеза различных цитокинов.
Результаты различались для разных способов конверсии лейкоцитов. После превращения лейкоцитами ДБФ в GcMAF режим синтеза отдельных цитокинов принципиально различается: могут синтезироваться либо про- или противовоспалительные цитокины, либо одновременно как про-, так и противовоспалительные. Установлено, что практически во всех случаях в ПМ запускаются оба механизма воспалительной реакции.
Полученный результат не позволил выявить тот элемент взаимодействия, который дает четкое представление о том, в каком направлении будет индуцироваться воспалительная реакция в фагоцитарной системе.
Сравнительный анализ фагоцитарной активности ПМ и синтеза мРНК анализируемых цитокинов в ПМ при использовании различных доз фактора активации макрофагов показал, что фагоцитарная активность как нормальный ответ фагоцитов обнаруживается как у М1 (провоспалительная), так и у М2. (противовоспалительные) ПМ.
3.3. Анализ прямого взаимодействия между GcMAF и CLEC10A
Был разработан подход, который мы назвали блот-анализом сэндвич-типа; это позволило нам выявить некоторые аспекты взаимодействия GcMAF-PM. Оказалось, что известный рецептор CLEC10A, расположенный на плазматической мембране ПМ, напрямую связывается с GcMAF в различных условиях взаимодействия. Выявлено взаимодействие как с очищенным белком CLEC10A, так и с лизатом ПМ.
Было обнаружено, что специфическое взаимодействие рецептора/лиганда возможно только в присутствии 20 мМ ионов Ca 2+ в буферной системе Вестерн-блоттинга и по меньшей мере 2 мМ ионов Ca 2+ в культуральной среде ПМ. С GcMAF взаимодействуют три фракции CLEC10A: белок 29 кДа и два высокомолекулярных производных (63 кДа и 65 кДа) [ 77 , 78 , 79 ].
Присутствие ионов Са 2+ влияет на вовлечение только высокомолекулярных производных. Такой подход позволил выявить некоторые детали взаимосвязей в системе GcMAF/CLEC10A. Оказалось, что взаимодействие фактора активации макрофагов и производного 65 кДа сопровождается активацией синтеза мРНК провоспалительных цитокинов.
Если эффективность взаимодействия смещается в сторону взаимодействия рецептора/лиганда с производным массой 63 кДа, синтез мРНК в ПМ переключается на синтез противовоспалительных цитокинов.
В проведенных экспериментах взаимодействие с двумя производными носило модулирующий, а не абсолютный характер, что всегда вызывает определенную неоднозначность относительно эффекта активации. Тем не менее, полученные данные свидетельствуют об участии двух высокомолекулярных производных CLEC10A в активации синтеза мРНК как про-, так и противовоспалительных цитокинов в ПМ.
С использованием GcMAF, полученного путем конверсии чистыми ферментами в условиях быстрой конверсии, было показано, что (1) производное, преимущественно взаимодействующее с GcMAF, представляет собой производное массой 63 кДа и (2) это взаимодействие ингибирует синтез провоспалительных цитокинов и активирует синтез противовоспалительного IL-10 (Рисунок 8Е).
Как можно объяснить такие различия в синтезе цитокинов, активируемых препаратами GcMAF, полученными с использованием разных режимов конверсии, зная, что эта белковая молекула действует как индуктор?
В событиях активации участвуют следующие факторы: индуктор (DBP, GcMAF), рецептор CLEC10A и, в частности, канонический белок массой 29 кДа, который связывается как с DBP, так и с GcMAF независимо от того, присутствует или отсутствует терминальный или частично дегликозилированный GalNAc.
Также присутствуют высокомолекулярные производные (~63 кДа, 65 кДа), концентрация ионов Ca 2+ , которая вызывает открытие эпитопа в высокомолекулярном углеводсвязывающем производном CLEC10A, и клетки PM.
Предполагается, что направленность воспалительной активности ПМ связана со структурными вариантами места гликозилирования, его расположением в факторе активации макрофагов, статус которого определяет, будут ли синтезироваться про- или противовоспалительные цитокины, и, возможно, количество взаимодействия рецептор-лиганд (Рисунок 9).
Наличие нескольких сайтов гликозилирования (Tre 18 /Tre 20 ) и одновременно смеси молекул с разной глубиной дегликозилирования создает неоднозначную картину активации синтеза мРНК ПМФ, что существенно усложняет оценку внутренней логики событий.
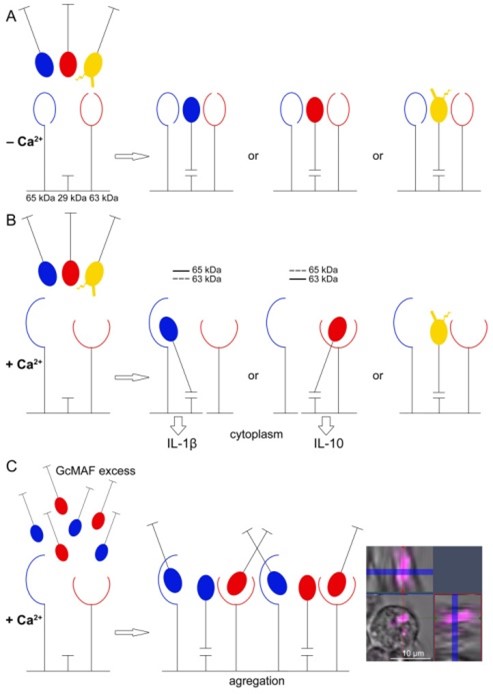
Принципиальная схема предполагаемого взаимодействия CLEC10A–GcMAF и синтеза мРНК анализируемых цитокинов. ( А , Б ) CLEC10A находится на поверхности ПМ у мышей C57BL/6 в виде трех производных, взаимодействующих с антителами против CLEC10A: канонического белка массой 29 кДа и двух высокомолекулярных производных (~63 кДа и ~65 кДа). Три производных рецептора, по-видимому, образуют единый кофункциональный комплекс. Такой вывод был сделан на основании данных, показывающих, что в последовательных экспериментах с одним и тем же препаратом C GcMAF LEV L pure 37 °C может синтезироваться мРНК преимущественно про- или противовоспалительных цитокинов, или их обоих одновременно.
Производное CLEC10A массой 29 кДа является первичным «якорем», фиксирующим молекулу DBP/GcMAF на цитоплазматической мембране независимо от присутствия или отсутствия молекул Ca 2+ . CLEC10A 29 кДа может связывать только одну молекулу DBP/GcMAF. В связи с этим возникает конкуренция за привязку к первичному «якорю».
В отсутствие Са 2+ этот контакт, по-видимому, приводит к неспецифическому стохастическому синтезу мРНК анализируемых цитокинов.
При достаточной концентрации Са 2+ «открываются» эпитопы специфических Са 2+ -зависимых высокомолекулярных производных рецептора CLEC10A 63/65 кДа. В зависимости от того, какая молекула GcMAF связывается с первичным «якорем», вторичное ее связывание модифицированным остатком сахара происходит с производным либо 63 кДа, либо 65 кДа.
В обоих случаях активированный комплекс интернализуется цитоплазмой. Синтез мРНК противовоспалительных и провоспалительных цитокинов индуцируется в первом и втором случаях соответственно. ( В ) Конкурентные взаимодействия между «заякоривающим» производным массой 29 кДа и высокомолекулярными производными массой 63/65 кДа происходят в присутствии избытка лиганда и ионов Са 2+ .
Предполагается, что комплексы агрегируются, когда комплекс между «заякоривающим» производным 29 кДа и производными 63 кДа/65 кДа не может образоваться и происходит вовлечение высокомолекулярных Ca 2+ -зависимых производных рецептора CLEC10A и GcMAF. . Отсутствие условий, необходимых для образования функционального комплекса и его интернализации в цитоплазме, ингибирует синтез как про-, так и противовоспалительных цитокинов. ДАД указано желтым цветом; синий и красный — два варианта производных GcMAF-связывающих молекулы 65 кДа и 63 кДа CLEC10A соответственно.
Экспериментально обнаружено два типа связывания GcMAF (DBP)/CLEC10A. ДБФ связывается с каноническим рецептором CLEC10A массой 29 кДа по связи, не требующей активации GalNAc-специфического эпитопа ионами Са 2+ . При этом связывании рецептор индуцирует незначительный хаотический синтез анализируемых цитокинов по неизвестному механизму. Якобы сигнальный путь индукции синтеза мРНК в этом случае не зависит от внутриклеточной концентрации ионов кальция.
Появление ионов Са 2+ индуцирует различное специфическое связывание между GcMAF и CLEC10A через два высокомолекулярных производных рецептора, которые присутствуют в очищенном коммерческом препарате белка (и предположительно в лизате ПМ) и отвечают за направление мРНК синтез.
Эти результаты объясняют различия в синтезе мРНК в ПМ, активированных разными препаратами GcMAF, следующим образом. За направленность воспалительного ответа в ПМ отвечают два высокомолекулярных производных CLEC10A: производное массой 65 кДа отвечает за провоспалительный ответ, а производное массой 63 кДа — за противовоспалительный. Оба эпитопа являются кальций-зависимыми. Эпитоп CLEC10A массой 29 кДа, по-видимому, действует как первичный «якорь» для GcMAF и отвечает за его ориентацию в покрытой клатрином кавеоле [ 80 , 81 , 82 ].
Важным результатом этого исследования является обнаружение того, что взаимодействие только с производным Ca 2+ -зависимого рецептора недостаточно для индукции ответа в ПМ, как это следует из отсутствия эффекта активации ПМ чистым GalNAc. Предположительно, необходимо первичное ориентирующее взаимодействие молекулы GcMAF с CLEC10A массой 29 кДа.
Стабилизация этого связывания в присутствии ионов Са 2+ сопровождается вовлечением сайта гликозилирования молекулы GcMAF с высокомолекулярными производными CLEC10A, расположенными в непосредственной близости от CLEC10A массой 29 кДа. Предполагается, что выбор аллельной формы белка массой 65 кДа или 63 кДа зависит от глубины дегликозилирования GcMAF в сайте(ах) гликозилирования.
Если все три аллельные формы рецептора CLEC10A взаимодействуют с GcMAF различной степени дегликозилирования, то возможно одновременное взаимодействие с обеими аллельными формами белка, которое будет сопровождаться активацией синтеза как про-, так и противовоспалительных цитокинов следующим образом: из выводов.
3.4. Агрегация молекул рецептора CLEC10A как механизм ингибирования синтеза мРНК TNF-α, IL-1β, TGF-β и IL-10 в ПМ
В некоторых вариантах синтез мРНК противовоспалительных цитокинов как в экспериментах ex vivo, так и in vivo имеет четко выраженный немонотонный (колокообразный) характер. Эффективность синтеза мРНК незначительна, но четко зависит от дозы фактора активации макрофагов GcMAF: она увеличивается в дозах 0,02 или 0,2 мкг и полностью ингибируется в дозе 2,0 мкг. Синтез мРНК провоспалительных цитокинов одновременно протекает идентичным или почти идентичным образом.
Механизм немонотонного (колокольчатого) ответа на дозу тщательно изучен при индуцировании TCR-опосредованного воспалительного ответа и связан с интернализацией клеткой ионов Са 2+ , связанных со специфическими рецепторами. Для изучаемой системы рецептор может быть интернализован только при образовании следующего комплекса (для CLEC10A): рецептор + три молекулы Ca 2+ + лиганд на любом субстрате [ 83 , 84 ].
Клатриновый везикула (кавеола) с активным рецептором погружается в цитоплазму и сливается с эндосомой, где высвобождается Са 2+ ; впоследствии он высвобождается в цитозоль благодаря активированной накачке IP3/IP3R. Количество (локальная концентрация) цитозольных ионов Ca 2+ является ключевым аспектом, ответственным за направление клеточного ответа.
При очень низкой концентрации ионов Са 2+ кальциневринфосфатаза активируется и создает условия для возникновения специфического комплекса NAFT-AP-1, от которого зависит активация провоспалительных генов. Когда концентрации лиганда и рецептора эквимолярны, избыточное количество ионов Са 2+ проникает в эндосомы и цитозоль, вызывая тем самым гиперактивацию кальциневрина и функциональную деградацию протеинкинансы II и Pyk2, от которых зависит активация AP-1.
Когда AP-1 неактивен, NAFT активирует гены противовоспалительных цитокинов и, в частности, IL-10 [ 85 , 86 , 87 , 88 , 89 , 90 ].
Другими словами, в случае CLEC10A все доступные рецепторы CLEC10A будут активированы, цитозоль насытится ионами Са 2+ и супрессивный клеточный фенотип будет формироваться при эквимолярном количестве лиганда, несущего свободный концевой фрагмент GalNAc. [ 60 , 83 , 91 ].
Вероятно, именно такую форму ответа мы обнаружили после обработки ПМ препаратом GcMAF, полученным путем ферментативной конверсии в растворе. Мы обнаружили, что в этом варианте полностью ингибируется синтез мРНК провоспалительных цитокинов TNF-α и IL-1β, тогда как синтез IL-10 активируется. Четко обнаруживается специфическое взаимодействие рецептора/лиганда с полосой 63 кДа.
Тем не менее, данное исследование предлагает примеры другого типа ответа (когда про- и противовоспалительные цитокины синтезируются одновременно). Для понимания механизма активации ПМ необходимы экспериментальные исследования.
Как упоминалось выше, на направление синтеза мРНК в ПМ влияет доза лиганд-переносящего углевода, который связывается с рецептором CLEC10A, акцептируя три молекулы Са 2+ . Предположительно, при увеличении дозы происходит агрегация рецепторов и ингибируется синтез мРНК цитокинов. В анализируемой литературе предложен следующий механизм такого взаимодействия. При стохастическом образовании агрегата в него интегрируется фосфатаза CD45, которая повсеместно экспрессируется в антигенпрезентирующих клетках и обладает сродством к CLEC10A [ 91 , 92 , 93 ].
Этот фактор дефосфорилирует цитоплазматические домены «связанных» молекул рецепторов, блокируя тем самым их интернализацию и полностью прекращая поступление ионов Са 2+ в клетку. Поэтому любые процессы синтеза тормозятся. Именно такая ситуация наблюдается в экспериментах по активации синтеза мРНК цитокинов 2 мкг «C GcMAF LEV L pure 37 °C».
Кроме того, проведенные цитологические эксперименты показали, что при дозе 2 мкг на плазматической мембране выявляются многочисленные клетки с крупными флуоресцентными агрегатами. Между тем, при более низких дозах метка обнаруживается в разных клеточных компартментах. Эти данные согласуются с литературными данными [ 53 ], показывающими, что рецепторы клеточной поверхности могут агрегироваться, что сопровождается потерей их специфических функций.
- Материалы и методы.
4.1. Экспериментальные животные
В работе использовали мышей-самцов и самок линии C57BL/6 в возрасте 2-6 мес (вес 18-24 г), выращенных в ЦКП «Виварий конвенциональных животных» Института цитологии и генетики Сибирского отделения РАН. наук (Новосибирск, Россия).
Животных содержали группами по 6–10 мышей в клетке при свободном доступе к пище и воде. Животных забивали методом шейной дислокации. Все эксперименты на животных проводились в строгом соответствии с принципами гуманности в соответствии с Директивами Совета Европейского Сообщества (86/609/EEC) и получили одобрение Комитета по уходу и использованию животных Института цитологии и генетики СО РАН.
4.2. Подготовка GcMAF
Витамин D3 — связывающий белок (DBP) выделяли из плазмы человека, собранной от индивидуальных доноров, с помощью либо аффинной хроматографии на 25-OH-D3 / сефарозе ® , либо, в отдельных случаях, с помощью актин-сефарозной или актин-хитиновой аффинной хроматографии [ 36 , 37 ]. ДАД, полученный от индивидуального донора, обозначался соответствующими буквами или цифрами (например, ДАД ЛЕВ означает, что ДАД был получен от донорского ЛЕВ).
Плазму, полученную от других доноров, обозначали цифрами 1–3. В нашем исследовании полученный DBP конвертировали в GcMAF несколькими методами.
4.2.1. Первый способ производства GcMAF обозначен как традиционный (C).
Для получения GcMAF иммобилизованный на 25-OH-D 3 /сефарозе ® ДБФ элюировали 3М гуанидинхлоридом, диализовали против PBS и инкубировали в присутствии предварительно очищенных от эритроцитов лейкоцитов (L pure). Лизис эритроцитов осуществляли с использованием буфера (0,15 М NH 4 Cl, 0,01 М KHCO 3 и 0,1 мМ ЭДТА). ДБФ инкубировали с очищенными лейкоцитами в растворе с добавлением 10% ФБС и CaCl 2 в конечной концентрации 1,5 мМ в атмосфере CO 2 при 37 °С в течение 24 ч.
После конверсии в обычных условиях препарат GcMAF стерилизовали фильтрованием. Препараты GcMAF, полученные в обычных условиях, обозначаются следующим образом: «C GcMAF L pure 37 °C» означает, что препарат был получен в обычных условиях с использованием очищенных активированных лейкоцитов; инкубацию проводили при 37°С. «C GcMAF L плазма 39 °C» означает, что препарат был получен в обычных условиях с использованием лейкоцитов, предварительно активированных в нативной плазме при 39 °C (L плазма 39 °C) в течение 2 часов.
4.2.2. Второй метод получения GcMAF обозначается как быстрый (экспресс) метод (Ex).
Конверсию осуществляли, когда предшественник был связан с подложкой на смоле.
Лейкоциты, обработанные различными методами: очищенные неактивированные лейкоциты (L pure), лейкоциты, предварительно активированные лизофосфатидилхолином (LysoPC, Sigma, Сент-Луис, Миссури, США) (L LysoPC), лейкоциты, предварительно активированные в нативной плазме при повышенной температуре. 39 °C (L плазма 39 °C) и лейкоциты, предварительно активированные в плазме при 37 °C (L плазма 37 °C) — добавляли в конверсионную среду, содержащую смолу, связанную с DBP.
Активацию лейкоцитов, очищенных с помощью LysoPC или температуры 39°С, проводили в буфере А (2 мМ Трис-HCl, рН = 8,0, 0,5 мМ β-меркаптоэтанол, 0,2 мМ CaCl 2 ).
Препараты GcMAF, полученные этим быстрым (экспрессным) методом, были обозначены следующим образом. Обозначение «Ex GcMAF L плазма 37 °С» указывает на то, что препарат получен экспресс-методом (а именно, добавлением лейкоцитов, активированных в плазме при 37 °С, в течение 3 ч к иммобилизованному в колонке ДБФ); обозначение «Ex GcMAF L плазма 39 °С» означает, что препарат получен экспресс-методом путем добавления лейкоцитов, предварительно активированных в нативной плазме при 39 °С, в течение 3 ч к иммобилизованному в колонке ДБФ и их совместной инкубации при 37 °С. °С в течение 20 ч в присутствии 1,5 мМ CaCl 2 ; «Ex GcMAF L плазма LysoPC 37 °C» означает, что препарат был получен экспресс-методом путем добавления лейкоцитов, предварительно активированных LysoPC в нативной плазме при 37 °C, в течение 3 ч к иммобилизованному в колонке ДБФ и их совместной инкубации при 37°С в течение 20 ч в присутствии 1,5 мМ CaCl 2 .
«Ex GcMAF L чистый LysoPC 37 °C» означает, что препарат был получен экспресс-методом путем добавления предварительно очищенных лейкоцитов и затем активирован путем добавления LysoPC при 37 °C в течение 3 часов к иммобилизованному в колонке DBP и их со- происходила инкубация при 37°С в течение 20 ч в присутствии 1,5 мМ CaCl 2 .
Препараты GcMAF, полученные вышеупомянутыми обработками, промывали для удаления конверсионной среды после инкубации в течение 20 часов, элюировали 3М гуанидинхлоридом, диализовали против PBS и использовали для активации перитонеальных макрофагов (ПМ). Цифры и буквы, указывающие происхождение GcMAF, указывают на доноров плазмы, использованных для получения DBP, предшественника GcMAF. Данные препараты принадлежат Открытому акционерному обществу «АКТИВАТОР МАФ».
Анализ влияния лейкоцитарных продуктов, используемых для продукции GcMAF, на способность ПМ экспрессировать анализируемые цитокины.
Для оценки влияния лейкоцитарной продукции, использованной для получения GcMAF, мы модифицировали условия получения последней (лейкоцитарно-кондиционированной среды), исключив ДАД. Для проверки возможности активации ПМФ кондиционированной лейкоцитарной средой в лунки добавляли только лейкоцитарную среду в количествах, аналогичных полученным при получении GcMAF, и в том же объеме, что и при разведении дозы активатора.
Мы добавили 2 мкг «C GcMAF L pure» в 30 мкл конверсионной лейкоцитарной среды на лунку для активации PM и 30 мкл конверсионной среды без активатора GcMAF, полученной в аналогичных условиях культивирования, для оценки эффекта чистой лейкоцитарной среды. Для сравнения среду титровали в 10 и 100 раз до 3 и 0,3 мкл на лунку соответственно (фигура 2А).
4.3. Активация ПМ ex vivo с помощью DBP, GcMAF и ApoA1
ПМ выделяли из интактных мышей C57BL/6 и осаждали центрифугированием при 400× g в течение 7 мин. Клетки ресуспендировали в RPMI; Концентрацию подсчитывали в камере Горяева. ПМ (1 × 10 6 клеток/лунку) культивировали в среде RPMI-1640 (БиолоТ, Санкт-Петербург, Россия) с добавлением 10% FBS (HyClone, Logan, Юта, США) и 40 мкг/мл гентамицина в 24-луночных условиях. тарелки на 12 часов.
Затем среду меняли на RPMI-1640 в отсутствие (контроль) или в присутствии DBP, GcMAF или ApoA1. В каждую лунку добавляли факторы активации макрофагов (четыре повтора на дозу): 0,02 мкг, 0,2 мкг, 2 мкг и 20 мкг. Клетки инкубировали в атмосфере CO 2 (Memmert, USA LLC, Eagle, WI, США) при 37°C в течение 3 часов.
Через 3 часа клетки промывали для удаления MAF. Активированные и контрольные ПМ лизировали реагентом TRIzol (Thermo Fisher Scientific, Уолтем, Массачусетс, США) для получения тотальной РНК. Кроме того, для оценки влияния АроА1 на синтез мРНК, выделенной из ПМ, исходный препарат ДБФ подвергали ультрафракционированию на концентраторе MWCO 30 000 (Amicon, Берлингтон, Массачусетс, США).
Очищенный АроА1 использовали для активации ПМ в дозе 2 мкг ( Приложение А ). Активацию ПМ с помощью GcMAF проводили в среде RPMI-1640 без добавок. Результаты ПЦР в реальном времени были нормализованы по уровню мРНК, выделенной из ПМ, обработанных только RPMI-1640 без добавок. После активации все образцы инкубировались в абсолютно идентичных условиях, и наблюдаемый эффект был обусловлен исключительно GcMAF.
4.4. Активация клеток J774 ex vivo с помощью GcMAF
Линия клеток макрофага J774 была получена из клеточной коллекции Института цитологии и генетики СО РАН. Для активации клеток J774 с помощью GcMAF клетки культивировали в среде DMEM (БиолоТ, Санкт-Петербург, Россия) с добавлением 10% FBS (HyClone, Logan, Юта, США) и 40 мкг/мл гентамицина в 24-луночных планшетах ( 1 × 10 6 клеток/лунку) при 37°C в инкубаторе с 5% CO 2 (Memmert, USA LLC, Eagle, WI, США) до 70–80% слияния в течение 12 часов. Далее процедуру активации проводили по схеме, идентичной таковой для активации ex vivo ПМ с помощью GcMAF.
4.5. Активация перитонеальных макрофагов in vivo с помощью GcMAF
Для активации ПМ in vivo с помощью GcMAF мы взяли по три мыши C57BL/6 в каждой из четырех исследуемых групп и одной контрольной группы. Мышам вводили внутривенно однократную дозу GcMAF (0,02 мкг, 0,2 мкг, 2 мкг и 10 мкг) в 200 мкл физиологического раствора. Мышам контрольной группы вводили только физиологический раствор.
Через пять часов после инъекции ПМ выделяли в среде RPMI-1640 индивидуально для каждой мыши, осаждали и лизировали реагентом TRIzol (Thermo Fisher Scientific, Уолтем, Массачусетс, США) для получения тотальной РНК.
4.6. Анализ активации фагоцитарной активности перитонеальных макрофагов у мышей
В наших исследованиях мы использовали шарики, покрытые стрептавидином. Возможны два механизма детерминации мишени и фагоцитоза. В первом случае клетки обнаруживают стрептавидин как PAMP, который является триггером поглощения. Возможна первичная «опсонизация» частиц факторами межклеточного матрикса, секретируемыми фагоцитами, с последующим рецептор-опосредованным фагоцитозом.
Известно, что в тех случаях, когда объектом фагоцитоза являются не живые клетки, а куски угля, асбеста, стекла, металла и т. д., фагоциты сначала делают объект поглощения приемлемым для реакции, обволакивая его собственными продуктами, в том числе образующимися компонентами межклеточного матрикса. ими [ 94 , 95 ].
Фагоцитарную функцию макрофагов оценивали по методике, представленной в [ 37 , 94 ].
4.7. Масс-спектрофотометрический анализ витамина D3-связывающего белка
Данные о структуре пептидов были получены с помощью тандемного масс-спектрометрического анализа, который включал разделение ионов-предшественников, фрагментацию этих ионов с образованием вторичных ионов и анализ фрагментных ионов.
Для проведения масс-спектрометрического анализа образцов, предварительно разделенных с помощью 1D-электрофореза, компоненты образца ферментативно расщеплялись трипсином; примеси удаляли, а полученные смеси пептидов впоследствии анализировали индивидуально.
Для этого из геля вырезали выбранные полосы, помещали в полипропиленовые пробирки объемом 1,5 мл, промывали водой (дважды) и 50% ацетонитрилом (Merck, Дармштадт, Германия) в 0,2 М бикарбонате аммония (Sigma-Aldrich, Берлингтон, Массачусетс). , США) и сушили в 100% ацетонитриле (Merck, Дармштадт, Германия). Для восстановления мы добавляли 2 мкл 20 мМ дитиотреитола (BioRad, Геркулес, Калифорния, США) в буфер, содержащий 0,2 М бикарбоната аммония (Sigma-Aldrich, Берлингтон, Массачусетс, США), и пробирки инкубировали в TS-100. термошейкер (Biosan, Рига, Латвия) в течение 30 мин при 600 об/мин и 57 °С.
Для алкилирования мы добавляли 2 мкл 50 мМ йодацетамида (BioRad, Геркулес, Калифорния, США) в буфер, содержащий 0,2 М бикарбоната аммония (Sigma-Aldrich, Берлингтон, Массачусетс, США), и пробирки инкубировали в темноте в течение 30 минут. в термошейкере TS-100 (Biosan, Рига, Латвия) при 600 об/мин.
Содержимое пробирки промывали и сушили в 100% ацетонитриле (Merck, Дармштадт, Германия). Для проведения триптического гидролиза белка мы добавили 0,02 мМ трипсина (Trypsin Gold, Mass Spectrometry Grade, Promega, Мэдисон, Висконсин, США) в 50 мМ карбоната аммония (Sigma-Aldrich, Берлингтон, Массачусетс, США) и провели инкубацию в Термошейкер TS-100 (Biosan, Рига, Латвия) в течение 14 ч при 600 об/мин и 37 °С.
Экстракцию пептидов проводили с использованием 1% трифторуксусной кислоты (Sigma-Aldrich, Берлингтон, Массачусетс, США). Пептиды очищали на колонке Millipore ZIPTIP C18 (Merck, Дармштадт, Германия) согласно протоколу производителя.
Пептидные смеси сушили и повторно растворяли в 20 мкл 0,1% раствора трифторуксусной кислоты (Sigma-Aldrich, Берлингтон, Массачусетс, США) в смеси ацетонитрил (Merck, Дармштадт, Германия)/вода (W6-1, Fisher Chemical, Уолтем, Массачусетс, США). США) смесь (2/98% об / об ).
Для хроматографического фракционирования использовали систему ВЭЖХ Thermo Fisher Scientific Ultimate 3000 Series (Nano/Cap System NCS-3500RS), автосамплер WPS-3000 TPL RS (с петлей для проб 20 мкм) и систему охлаждения проб.
Фракционирование соединений проводили на колонке Acclaim PepMap RSLC C18 (75 мкм × 150 мм, 2 мкм, 100 Å) в градиентном режиме. Состав подвижной фазы (элюента) был следующим. Компонент А: 0,1% раствор муравьиной кислоты (Thermo Scientific, Уолтем, Массачусетс, США) в воде (W6-1, Fisher Chemical, Уолтем, Массачусетс, США). Компонент B: 0,1% раствор муравьиной кислоты (Thermo Scientific, Уолтем, Массачусетс, США) в смеси ацетонитрила (Merck, Дармштадт, Германия)/воды (W6-1, Fisher Chemical) (80:20% об.) ./ в ). Подвижная фаза загрузочного насоса: 0,1% трифторуксусная кислота (Sigma-Aldrich, Берлингтон, Массачусетс, США) в ацетонитриле (Merk, Дармштадт, Германия)/воде (W6-1, Fisher Chemical, Уолтем, Массачусетс, США) (2%/98). % об / об ).
Идентификацию соединений проводили на масс-спектрометре Orbitrap Fusion Lumos при следующих условиях: электростатическую ионизацию распылением проводили при атмосферном давлении, в качестве сенсора использовали орбитальную ловушку (режимы сканирования: MS OT, ddMS 2 OT HCD; разрешение 60 000; высокое). -энергетическая ячейка диссоциации, активируемая столкновением; энергия диссоциации 30%; детектируемое зарядовое состояние 2–7; квадрупольный масс-фильтр, используемый для выделения прекурсора; ширина окна масс-выделения 1,6 m/z; диапазон детектируемых масс 300–1500 m/ z; обнаружение положительно заряженных ионов; порог интенсивности 5 × 104; время накопления ионов 60 мс; количество полученных сканирований 1; продолжительность динамического исключения 60 с; напряжение распылителя 2,0 кВ; температура капилляра 305 °С; и температура распылителя 270 °С). Для сбора и обработки данных масс-спектрометрии использовали программу Xcalibur v.2.4.
Данные масс-спектрометрии были загружены в виде необработанных файлов в программное обеспечение Proteome Discoverer (2.4.0). Данные обрабатывались с использованием стандартного этапа обработки, включающего следующие элементы: файлы спектра, селектор спектра, SequestHT, Percolator и IMP-ptmRS; этап консенсуса включал элементы MSF Files, PSM Grouper, Peptide Validator, Peptide and Protein Filter со ссылкой на аннотацию белка, Protein Score со ссылкой на Protein FDR Validator и Protein Grouping. Данные аминокислотной последовательности, полученные при анализе масс-спектров MS1 и MS2, сравнивали с аминокислотной последовательностью генов человека из протеома UP000005640.
4.8. Получение кДНК
Тотальную РНК из перитонеальных макрофагов выделяли с использованием реагента TRIzol (Thermo Fisher Scientific, Уолтем, Массачусетс, США) в соответствии с инструкциями производителя. Количество РНК измеряли на флуориметре Qubit 4 (Thermo Fisher Scientific, Уолтем, Массачусетс, США). ПЦР с обратной транскрипцией проводили на матрице поли-А мРНК с использованием амплификатора T100 Thermal Cycler (Bio-Rad Laboratories, Inc., Геркулес, Калифорния, США) и набора MMLV RT («Евроген», Москва, Россия) по методике протокол производителя.
4.9. ПЦР-анализ
ПЦР-праймеры для кодирующих областей каждого гена провоспалительных и противовоспалительных цитокинов были сконструированы с использованием программного обеспечения Vector NTI v.9 (Life Technologies, Уилмингтон, Делавэр, США) и синтезированы ООО «БИОСЕТ» (БИОССЕТ, Новосибирск, Россия). Последовательности праймеров, использованных в этом исследовании, перечислены вТаблица 1.
Таблица 1
Последовательности праймеров, использованных в работе (for – прямой праймер; rev – обратный праймер).
| Праймеры | Олигонуклеотидные последовательности |
| TNF-α-для | 5′-AAGCCTGTAGCCCACGTCGTA-3′ |
| ФНО-α-рев. | 5′-GGCACCACTAGTTGGTTGTCTTTG-3′ |
| IL-1β-для | 5′-TCCAGGATGAGGACATGAGCAC-3′ |
| IL-1β-рев. | 5′-GAACGTCACACACCAGCAGGTTA-3′ |
| TGF-β-для | 5′-GTGTGGAGCAACATGTGGAACTCTA-3′ |
| TGF-β-рев. | 5′-TTGGTTCAGCCACTGCCGTA-3′ |
| Ил-10-для | 5′-GACCAGCTGGACAACATACTGCTAA-3′ |
| Ил-10-рев. | 5′-GATAAGGCTTGGCAACCCAAGTAA-3′ |
| GAPDH-для | 5′-AAATGGTGAAGGTCGGTGTG-3′ |
| GAPDH-ред. | 5′-TGAAGGGGTCGTTGATGG-3′ |
ПЦР проводили в общем объеме 50 мкл; Реакционная смесь содержала Taq-буфер, 2 мМ MgCl 2 , 0,2 мМ dNTP, 0,2 пмоль прямого и обратного праймеров, 1 нг матрицы и 5 ед. Taq-полимеразы (реагенты для ПЦР предоставлены фирмой «Медиген», Новосибирск, г. Россия). Схема ПЦР была следующей: цикл 1 (×1): 95 °С – 3 мин; цикл 2 (×33): 95 °С – 30 с; 59 °С – 30 с; 72 °С – 40 с; цикл 3 (×1): 72 °С – 5 мин; хранение при температуре 10°С.
4.10. ПЦР в реальном времени
ПЦР в реальном времени проводили в 96-луночных планшетах с использованием BioMaster HS-qPCR SYBR (2x) (ООО «БИОЛАБМИКС», Новосибирск, Россия) по протоколу производителя на ПЦР-системе QuantStudio5 (Thermo Fisher Scientific, Уолтем, Массачусетс, США). . Анализ qPCR в реальном времени каждого образца проводился в трех повторностях. Относительный уровень экспрессии определяли методом 2 –ΔΔCt .
Интактные необработанные ПМ использовали в качестве контрольной группы; уровень экспрессии целевого гена в них принимали равным 1. В качестве эталонного использовали ген GAPDH. Параметры циклирования были следующими: 95 °С в течение 10 мин, 40 циклов по 95 °С в течение 30 с, 59 °С в течение 30 с и 72 °С в течение 30 с, с заключительным этапом плавления, включающим медленный нагрев от 6 до 95 °С.
4.11. Взаимодействие GcMAF и чистого GalNAc с антителами против Gc
Для сравнения взаимодействия GcMAF и чистого галактозамина (GalNAc) с анти-Gc-антителами на нитроцеллюлозную мембрану наносили образцы соединений: GalNAc (Sigma-Aldrich) в эквимолярном количестве, а также в 10-кратном и 100-кратном избыток по отношению к количеству GcMAF. GalNAc (в количествах, указанных выше) в 110 мкл 0,01 М PBS с добавлением 0,02% Твина 20 помещали в лунки системы вакуумного дот-блоттинга. GcMAF (20 мкл, 4,5 мкг) помещали в четвертую лунку системы.
Установка была подключена к вакуумному насосу; После прохождения содержимого лунок через мембрану проводили последовательную серию фиксационных обработок (вакуумной инфильтрации) мембраны метанолом (по 100 мкл на обработку) и три процедуры промывки с использованием 50 мкл буфера для переноса на одну промывку. После завершения откачки мембрану разрезали на две части: первая часть содержала GalNAc, нанесенный трижды, а другая часть содержала GcMAF.
Мембраны обрабатывали блокирующим буфером (0,01 М PBS с добавлением 0,02% Твина 20) в течение 1,5 часов. Затем добавляли антитела против Gc (Cloud-Clone-Corp, Хьюстон, Техас, США) и проводили инкубацию в течение ночи на качалке при +9°C.
4.12. Вестерн-блот-анализ лизата макрофагов с антителами против CLEC10A
Вестерн-блоттинг был проведен для подтверждения того, что поверхность макрофагов содержит CLEC10A. Свежеизолированные ПМ (107 ) лизировали в 100 мкл физиологического раствора, содержащего 15 мкл 0,1 М PMFS и 40 мкл буфера для образца (0,066 М трис-HCl, pH = 6,8; 26,3% глицерина; 2,1% SDS; и 0,011% бромфенолового синего). ) в течение 10 мин, кипятили 10 мин и центрифугировали. Лизат (2 × 10 6 клеток ПМ на дорожку) применяли для проведения электрофореза.
В качестве контроля использовали коммерчески доступный CLEC10A (Cloud-Clone-Corp, Хьюстон, Техас, США) (2 мкг на дорожку). Вестерн-блот-анализ с антителами проводили после электрофореза с последующим электроблоттингом на мембране NC.
Неспецифическое связывание блокировали инкубацией в 0,01 М фосфатно-солевом буфере (PBS), содержащем 0,02% Твин 20, в течение ночи при 4 °С. Для вестерн-блоттинга блоты исследовали антителами против CLEC10A (Cloud-Clone-Corp, Хьюстон, Техас, США). Блоты были разработаны с использованием системы обнаружения вестерн-блоттинга ECL (Abcam, Кембридж, Великобритания) и визуализированы на имидж-сканере iBright (Thermo Fisher Scientific, Уолтем, Массачусетс, США).
4.13. Анализ белок-белковых взаимодействий между GcMAF и CLEC10A (сэндвич-анализ)
Прямое взаимодействие GcMAF–CLEC10A изучали с помощью сэндвич-анализа; после электрофореза CLEC10A (Cloud-Clone-Corp, Хьюстон, Техас, США) или GcMAF переносили из полиакриламидного геля на мембрану NC по описанной выше методике и обрабатывали контрагентом. Масса белков, нанесенных на гель, составляла 2 мкг; Для обработки мембраны использовали 15 мкг противоагента в 10 мл 0,01 М PBS с добавлением 0,02% Твин 20 и 20 мМ CaCl 2 .
После инкубации в течение ночи мембраны трижды промывали буфером (0,01 М PBS с добавлением 0,1% Tween 20), причем каждая процедура промывания длилась 5 минут, и инкубировали в присутствии 5 мкг анти-Gc (Cloud-Clone-Corp , Хьюстон, Техас, США) или антитело против CLEC10A (Cloud-Clone-Corp, Хьюстон, Техас, США) в 10 мл буфера, состоящего из 0,01 М PBS с добавлением 0,02% Tween 20, в течение 10 часов. Реакцию антител обнаруживали после промывки с использованием системы обнаружения вестерн-блоттинга ECL (Abcam) и визуализировали на имидж-сканере iBright (Thermo Fisher Scientific, Уолтем, Массачусетс, США).
4.14. Флуоресцентно-цитологический анализ взаимодействия ПМ и Cy5-GcMAF
GcMAF метили с помощью набора для мечения антител сульфо-цианин5 (Cy5) («Lumiprobe», США) согласно протоколу производителя. Свежеизолированные ПМ (1 × 10 6 клеток/лунку) культивировали в 500 мкл RPMI-1640 (БиолоТ, Санкт-Петербург, Россия) с добавлением 10% FBS (HyClone) и 40 мкг/мл гентамицина в 24-луночных планшетах ( Eppendorf SE, Германия) в течение 12 часов. Затем в каждую лунку добавляли 2,5 мкг/мл Cy5-GcMAF. Пластинку анализировали с помощью конфокального микроскопа LSM 780 NLO (Carl Zeiss AG, Германия). Интенсивность флуоресценции зонда внутри клетки анализировали с помощью программного обеспечения ZEN (Carl Zeiss AG, Германия).
4.15. Статистический анализ
Статистический анализ проводился с использованием программного обеспечения Statistica 10 (StatSoft, Талса, Оклахома, США). Графики были созданы с использованием Microsoft Excel 2013 (Microsoft, Редмонд, Вашингтон, округ Колумбия, США), Statistica 10 (StatSoft, Талса, ОК, США) или GraphPad Prism9.3.1 (Graph-Pad Software, Сан-Диего, Калифорния, США). ) программное обеспечение. На графиках показаны средние значения ± стандартные отклонения (SD). Достоверность различий оценивали с помощью U-критерия Манна-Уитни. Выявленные различия считали статистически значимыми при p < 0,05 (U-критерий Манна–Уитни).
- Выводы
DBP связывается с CLEC10A массой 29 кДа, но не связывается с CLEC10A массой 63 или 65 кДа. Подобно DBP, GcMAF связывается с CLEC10A массой 29 кДа, а также с двумя производными CLEC10A (63 кДа и 65 кДа) в присутствии 20 мМ ионов Ca 2+.
GcMAF может иметь разные варианты как гликозилирования, так и расположения сайта гликозилирования. Результаты настоящего исследования не позволяют точно определить, какой именно вариант гликозилирования отвечает за вектор про- или противовоспалительного ответа ПМФ.
Тем не менее, можно сказать, что в результате различных обработок могут образоваться два принципиальных варианта молекулы GcMAF: связывающие 65 кДа и 63 кДа производные CLEC10A. Именно эта форма взаимодействия определяет направленность воспалительной реакции ПМФ. Кроме того, проведенный анализ позволяет увидеть механизм агрегации рецепторов, заякоренных в клатриновых пузырьках (кавеолах), который выглядит следующим образом (Рисунок 9).
При избытке лиганда в присутствии ионов Са 2+ возникают конкурентные взаимодействия между «заякоривающим» производным 29 кДа и высокомолекулярными производными 63 и 65 кДа .
Считается, что агрегация комплексов происходит тогда, когда не может образоваться «заякоренный» комплекс 29 кДа/63 кДа/65 кДа и одновременно происходит взаимодействие рецептор/лиганд высокомолекулярных Ca 2+ -зависимых производных CLEC10A и GcMAF. происходит избыточное присутствие молекул в клеточной среде. Хвосты молекул различных клатриновых везикул (кавеол) могут взаимодействовать друг с другом с образованием клатрин-клатриновых (межкавеолярных) межмолекулярных мостиков, как это сообщалось для коллагена при формировании упорядоченных межклеточных каркасных структур [ 96 , 97 , 98 ].
Клатриновые везикулы (кавеолы) сужаются и образуются агрегаты, что наблюдается при анализе ПМ, обработанных 2 мкг GcMAF. Синтез как про-, так и противовоспалительных цитокинов ингибируется, когда нет условий для образования функционального комплекса и его интернализации цитоплазмой.
Важным замечанием относительно приведенного выше объяснения действия GcMAF является то, что его молекула несет сайт связывания актина/витамина D3 . Эти дополнительные активные компоненты GcMAF могут оказывать существенное влияние на механизм активации ПМ, описанный выше.
Следовательно, направление клеточного ответа определяется направлением передачи сигнала, которое является количественным параметром и зависит от взаимодействия рецептора CLEC10A, находящегося на макрофагах и дендритных клетках, и сайта гликозилирования GcMAF.
- Патенты
Производство препарата GcMAF запатентовано: приоритет № 047390 2023121663 от 17 августа 2023 года.
Благодарности
Работа выполнена на микроскопической базе Центра коллективного пользования микроскопии биологических объектов СО РАН (заведующий лабораторией С.И. Байбородин) и Центра коллективного пользования «Клеточные технологии» ИЦиГ СО РАН (заведующий лабораторией Орищенко К.Е.). , проект госбюджета № ФВНР-2022-0015), Базовый комплекс ИКиГ СО РАН по протеомному и метаболомному профилированию микроорганизмов (проект госбюджета № ФВНР-2022-0022).
Приложение А. Влияние аполипопротеина А1 (АпоА1) на синтез мРНК анализируемых цитокинов перитонеальными макрофагами мыши
Рисунок А1
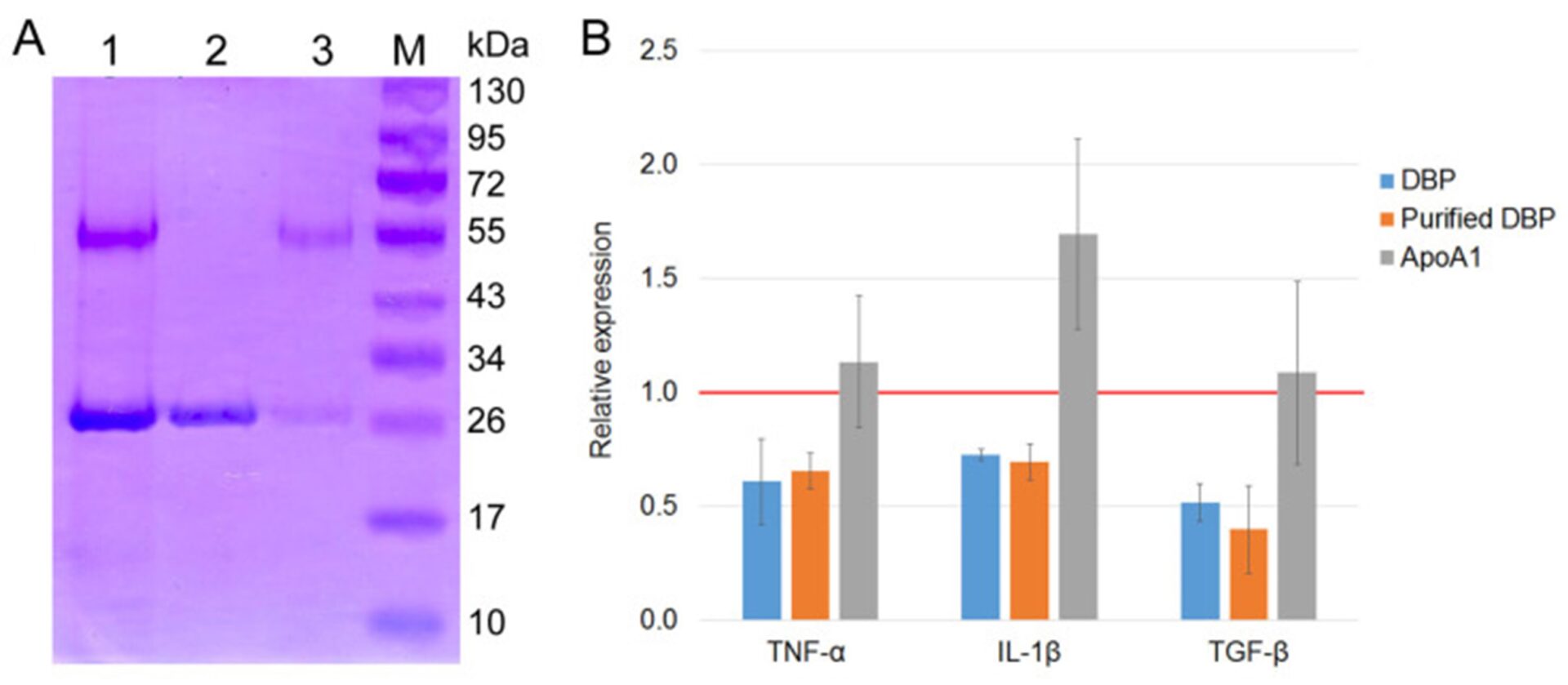
Влияние аполипопротеина А1 (АпоА1) на синтез мРНК анализируемых цитокинов перитонеальными макрофагами мыши. ( A ) Электрофорез в полиакриламидном геле исходных образцов DBP (1), MWCO 30 000 очищенного ApoA1 (2) и MWCO 30 000 очищенного DBP (3), полученных с использованием 25-OH-D3/Sepharose ® . М — молекулярный маркер «The Thermo Scientific™ Page Ruler™ Prestained». ( B ) Количественная оценка экспрессии мРНК генов цитокинов в перитонеальных макрофагах мыши, обработанных исходным DBP (синий), очищенным DBP MWCO 30 000 (коричневый) и очищенным ApoA1 MWCO 30 000 (серый) с дозами 2 мкг. Контроль включает необработанные перитонеальные макрофаги, уровень экспрессии которых считается равным 1,0 (красная сплошная полоса).
Приложение Б. Перечень основных характеристик системы GcMAF/PMs, полученных в ходе исследования—
— Для выделения прекурсора из плазмы крови синтезирован аффинный сорбент 25-OH-D 3 /Сефароза ® и разработана методика валидации прекурсора непосредственно на смоле.
— Аффинная хроматография перекрестного взаимодействия ДБФ от одного и того же донора на двух аффинных сорбентах, а именно актин/сефарозе и 25-OH-D 3 /сефарозе ® , показала, что два разных аффинных домена ответственны за две разные формы молекулы ДБФ.
— Тандемный масс-спектрометрический анализ показал, что на аффинном сорбенте 25-OH-D 3 /Sepharose ® элюируются два белка – GcMAF и ApoA1 .
— Разработан метод анализа прямого взаимодействия GcMAF с другими анализируемыми белками: сэндвич-блот-анализ.
— Анализ сэндвич-блоттинга показал, что DBP не связывается напрямую с ApoA1. GcMAF напрямую связывается с ApoA1.
— Предшественник без превращения в GcMAF индуцирует экспрессию анализируемых цитокинов. ДАД от разных доноров активирует ПМ для продукции различных цитотокинов.
— Различные способы конверсии DBP в GcMAF дают разные, нестандартизированные результаты с точки зрения экспрессии мРНК анализируемых цитокинов.
— После превращения лейкоцитов в GcMAF режим синтеза отдельных цитокинов ПМ принципиально меняется и может иметь как про-, так и противовоспалительный вектор, либо могут иметь место оба направления воспаления одновременно. Практически во всех случаях активируются оба вектора воспалительной реакции ПМ.
— Фагоцитарная активность как нормальный ответ фагоцитов обнаруживается как в ПМ М1, так и в ПМ М2. Различия наблюдаются при ингибировании синтеза мРНК. В случае клеток М2 и ингибировании экспрессии противовоспалительных цитокинов фагоцитоз значительно усиливается. В случае клеток М1 помимо снижения экспрессии провоспалительных цитокинов снижается и фагоцитарная активность ПМ.
— Рецептор C-лектина CLEC10A (расположенный на цитоплазматической мембране ПМ) напрямую связывается с GcMAF.
— С GcMAF взаимодействуют три производных CLEC10A (канонический белок массой 29 кДа и два высокомолекулярных производных массой 63 и 65 кДа).
— Ионы кальция не требуются для связывания с производным массой 29 кДа. И DBP, и GcMAF взаимодействуют с фактором в стандартных условиях вестерн-блоттинга. Присутствие ионов кальция влияет только на взаимодействие с высокомолекулярными производными коммерчески очищенного CLEC10A.
— Взаимодействие GcMAF с производным массой 65 кДа сопровождается активацией синтеза мРНК ПМ в провоспалительных цитокинах.
— Взаимодействие GcMAF с производным массой 63 кДа сопровождается активацией синтеза мРНК ПМ в противовоспалительных цитокинах.
— Активация GcMAF обоими производными рецептора запускает синтез мРНК в обоих направлениях воспалительного ответа.
— Найден подход к обработке ДБФ очищенными ферментами непосредственно на смоле, что позволяет получить GcMAF с заданными противовоспалительными характеристиками.
— Для индукции ответа ПМ необходимо присутствие ионов кальция и взаимодействие GcMAF с двумя производными CLEC10A: фактором 29 кДа и одним из высокомолекулярных производных. При этом взаимодействие с производным массой 29 кДа действует как «якорь» и в выбранных условиях не влияет на направление синтеза мРНК анализируемых цитокинов.
— При избытке лиганда может происходить агрегация поверхностных рецепторов и ингибирование экспрессии анализируемых цитокинов.
Заявление о финансировании
Работа выполнена при финансовой поддержке Минобрнауки России через Институт цитологии и генетики СО РАН (Госбюджетный проект № ФВНР-2022-0016), Курчатовский геномный центр Института цитологии и генетики СО РАН (№ .075-15-2019-1662), а также ООО «АКТИВАТОР МАФ», ООО «БА-фарма», ООО «КАРАНАХАН», ООО «С. ЛАБОРАТОРНАЯ ДИАГНОСТИКА».
Вклад автора
Концептуализация, SSB; формальный анализ, SSK и EVL; приобретение финансирования, SSB; расследование, ССК, ЭВЛ, ВСР, СГО, АРВ, ГСР и ЭВД; методология, SSK, EVL и ASP; администрирование проекта, ERC, NAK, SEP, EDD и SSB; ресурсы, SEP и AAO; надзор, AAO и ERC; валидация, GSR, AVS и DIK; визуализация, ASP и OST; письменная – первоначальный проект, ССК и ЭВЛ; написание — рецензирование и редактирование, SSK и SSB. Все авторы прочитали и согласились с опубликованной версией рукописи.
Заявление Институционального наблюдательного совета
Исследование проведено в соответствии с Хельсинкской декларацией и одобрено Комитетом по уходу и использованию животных ИЦиГ СО РАН (протокол № 8 от 19 марта 2019 г.).
Заявление об информированном согласии
Информированное согласие было получено от всех субъектов, участвовавших в исследовании.
Заявление о доступности данных
Данные, подтверждающие выводы этого исследования, можно получить у соответствующего автора по обоснованному запросу.
Конфликт интересов
Авторы объявили, что нет никаких конфликтов интересов.
Сноски
Отказ от ответственности/Примечание издателя: Заявления, мнения и данные, содержащиеся во всех публикациях, принадлежат исключительно отдельному автору(ам) и соавторам(ам), а не MDPI и/или редактору(ам). MDPI и/или редактор(ы) не несут ответственности за любой вред людям или имуществу, возникший в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте.
Рекомендации
- Редер Д.С., Нельсон Р.В., Борхес К.Р. Статус гликозилирования витамина D-связывающего белка у онкологических больных. Белковая наука. 2009 г.; 18 : 2036–2042. дои: 10.1002/про.214. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Угарте А., Буш Г., Мехеус Л. Несоответствия и сомнительная достоверность публикации «Иммунотерапия метастатического колоректального рака с использованием макрофагов, активирующих витамин D-связывающий белок, GcMAF» Ямамото и др. Рак Иммунол. Иммунотер. 2014 г.; 63 : 1347–1348. doi: 10.1007/s00262-014-1587-y. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Угарте-Хил М.Ф., Асеведо-Васкес Э., Аларкон Г.С., Пастор-Асурса К.А., Альфаро-Лозано Х.Л., Кучо-Венегас Х.М., Сегами М.И., Войдила Д., Сориано Э.Р., Дренкард К. и др. Количество пациентов с обострениями влияет на накопление ущерба при системной красной волчанке: данные многоэтнической латиноамериканской когорты. Анна. Реум. Дис. 2015 г.; 74 : 1019–1023. doi: 10.1136/annrheumdis-2013-204620. [ PubMed] [ CrossRef ] [ Академия Google ]
- Борхес К.Р., Редер Д.С. Гликановая структура фактора активации макрофагов, полученного из белка Gc, по данным масс-спектрометрии. Арх. Биохим. Биофиз. 2016 г.; 606 : 167–179. дои: 10.1016/j.abb.2016.08.006. [ PubMed] [ CrossRef ] [ Академия Google ]
- Руджеро М. Gc Белковый фактор активации макрофагов (GcMAF) и аутизм: требуют ли клинические результаты новой интерпретации? Являюсь. Дж. Иммунол. 2016 г.; 12 :77–82. дои: 10.3844/ajisp.2016.77.82. [ CrossRef] [ Академия Google ]
- Моралес Э. GcMAF: полемика или многообещающая молекула? Мировая наука. Новости. 2017 год; 65 :20–36. [ Google Scholar]
- Мирзаева Д. Применение GcMAF у пациента из Узбекистана с рассеянным склерозом и сопутствующим циррозом печени на фоне гепатита В. Мов. Разлад. 2020; 35 :S138. [ Google Scholar]
- Альбрахт С.П. Возвращение к иммунотерапии с использованием GcMAF — критический обзор исследований Нобуто Ямамото. Лечение рака. Рез. Коммун. 2022 год; 31 :100537. doi: 10.1016/j.ctarc.2022.100537. [ PubMed] [ CrossRef ] [ Академия Google ]
- Сабури Э., Сабури А., Ганей М. Многообещающая роль Gc-MAF в иммунотерапии рака: от скамьи до постели. Касп. Дж. Стажер. Мед. 2017 год; 8 : 228–238. дои: 10.22088/CJIM.8.4.228. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Корбелик М., Нарапараджу В.Р., Ямамото Н. Макрофаг-направленная иммунотерапия как адъювант фотодинамической терапии рака. Бр. Дж. Рак. 1997 год; 75 : 202–207. дои: 10.1038/bjc.1997.34. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Мохамад С.Б., Нагасава Х., Уто Й., Хори Х. Активность альфа-N-ацетилгалактозаминидазы опухолевых клеток и ее участие в GcMAF-связанной активации макрофагов. Комп. Биохим. Физиол. Часть А Мол. Интегр. Физиол. 2002 г.; 132 :1–8. дои: 10.1016/S1095-6433(01)00522-0. [ PubMed] [ CrossRef ] [ Академия Google ]
- Кискер О., Онидзука С., Беккер С.М., Фэннон М., Флинн Э., Д’Амато Р., Зеттер Б., Фолкман Дж., Рэй Р., Свами Н. и др. Фактор активации белка-макрофагов, связывающий витамин D (DBP-Maf), ингибирует ангиогенез и рост опухолей у мышей. Неоплазия. 2003 г.; 5:32 . дои: 10.1016/S1476-5586(03)80015-5. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Грегори К.Дж., Чжао Б., Биленберг Д.Р., Дриди С., Ву Дж., Цзян В., Хуан Б., Пири-Шеперд С., Фэннон М. Фактор активации белка-макрофага, связывающего витамин D, непосредственно ингибирует пролиферацию, миграцию. и экспрессия UPAR в клетках рака простаты. ПЛОС ОДИН. 2010 г.; 5 : е13428. doi: 10.1371/journal.pone.0013428. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Пачини С., Моруччи Г., Пунци Т., Гулисано М., Руджеро М. Gc-белковый фактор активации макрофагов (GcMAF) стимулирует образование CAMP в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоисной мембраны куриного эмбриона. Рак Иммунол. Иммунотер. 2011 г.; 60 : 479–485. дои: 10.1007/s00262-010-0953-7. [ PubMed] [ CrossRef ] [ Академия Google ]
- Пачини С., Моруччи Г., Пунци Т., Гулисано М., Руджеро М., Амато М., Атерини С. Влияние парикальцитола и GcMAF на ангиогенез, пролиферацию и передачу сигналов мононуклеарных клеток периферической крови человека. Дж. Нефрол. 2012 г.; 25 : 577–581. дои: 10.5301/jn.5000035. [ PubMed] [ CrossRef ] [ Академия Google ]
- Тойохара Й., Хашитани С., Кишимото Х., Ногучи К., Ямамото Н., Ураде М. Ингибирующее действие витамина D-связывающего белка, производного макрофагального активирующего фактора, на индуцированный ДМБА канцерогенез щечного мешка хомяка и карциному, полученную из него. Клеточная линия. Онкол. Летт. 2011 г.; 2 :685. дои: 10.3892/ол.2011.306. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Тайер Л., Уорд Э., Смит Р., Фиоре М.Г., Магерини С., Бранка Дж.Дж.В., Моруччи Г., Гулисано М., Руджеро М., Пачини С. Новая роль основного компонента витамина D. Ось: Фактор активации макрофагов, связывающий витамин D, индуцирует апоптоз клеток рака молочной железы человека посредством стимуляции макрофагов. Питательные вещества. 2013; 5 : 2577–2589. дои: 10.3390/nu5072577. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Мойя Р., Чан М., Вонг М., Клокол Д., Чиа Ю.К. Активная специфическая иммунотерапия (АСИ) в лечении рака: пять сообщений о случаях заболевания. Дж. Наука о раке. Там. Журнал открытого доступа2019; 11 : 256–259. [ Google Scholar ]
- Падурару Д.Н., Буариу А., Ион Д., Андроник О., Думитрашку М.К., Болокан А. Соображения относительно лечения GCMAF при раке молочной железы. ПЗУ. Биотехнология. Летт. 2019 год; 24 :851–855. дои: 10.25083/руб./24.5/851.855. [ CrossRef] [ Академия Google ]
- Брэдстрит Дж. Дж., Фогелаар Э., Тайер Л. Первоначальные наблюдения повышенной активности альфа-N-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдаемое снижение от инъекций белка GC — фактора активации макрофагов. Информация об аутизме. 2012 г.; 4:31 . дои: 10.4137/AUI.S10485. [ CrossRef] [ Академия Google ]
- Смит Р., Тайер Л., Уорд Э., Меаччи Э., Бранка Дж.Дж.В., Моруччи Г., Гулисано М., Руджеро М., Пачини А., Патерностро Ф. и др. Эффекты фактора активации Gc-макрофагов в нейронах человека; Последствия для лечения синдрома хронической усталости. Являюсь. Дж. Иммунол. 2013; 9 : 120–129. дои: 10.3844/ajisp.2013.120.129. [ CrossRef] [ Академия Google ]
- Синискалько Д., Джеффри Брэдстрит Дж., Чирилло А., Антонуччи Н. Влияние GcMAF in vitro на транскрипцию эндоканнабиноидной системы, формирование рецепторов и клеточную активность макрофагов, полученных из аутизма. Дж. Нейровоспаление. 2014 г.; 11:78 . дои: 10.1186/1742-2094-11-78. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Инуи Т., Амитани Х., Кубо К., Кучиике Д., Уто Ю., Нишиката Т., Метте М. Отчет о случае: пациент с немелкоклеточным раком легких, получавший лечение с помощью GcMAF, сонодинамической терапии и полей для лечения опухолей. . Противораковый Рез. 2016 г.; 36 : 3767–3770. [ PubMed] [ Академия Google ]
- Ямамото Н., Нарапараджу В.Р. Роль витамина D3-связывающего белка в активации макрофагов мыши. Дж. Иммунол. 1996 год; 157 : 1744–1749. doi: 10.4049/jimmunol.157.4.1744. [ PubMed] [ CrossRef ] [ Академия Google ]
- Тайер Л., Уорд Э., Смит Р., Бранка Дж.Дж.В., Моруччи Г., Гулисано М., Ноукс Д., Эслингер Р., Пачини С. GC Белковый фактор активации макрофагов снижает α-N-ацетилгалактозаминидазу Уровни у больных раком на поздних стадиях. Онкоиммунология. 2013; 2 : e25769. дои: 10.4161/onci.25769. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Сумия Ю., Иноуэ Т., Исикава М., Инуи Т., Кучиике Д., Кубо К., Уто Ю., Нишиката Т. Макрофаги демонстрируют большой набор состояний активации посредством множественных механизмов факторов, активирующих макрофаги. Противорак. Рез. 2016 г.; 36 :3619–3623. [ PubMed] [ Академия Google ]
- Ямамото Н., Кумаширо Р. Преобразование белка, связывающего витамин D3 (группоспецифический компонент), в фактор активации макрофагов путем поэтапного действия бета-галактозидазы В-клеток и сиалидазы Т-клеток. Дж. Иммунол. 1993 год; 151 : 2794–2802. doi: 10.4049/jimmunol.151.5.2794. [ PubMed] [ CrossRef ] [ Академия Google ]
- Осава М., Кимура А., Юкава Н., Сето Й., Сайто Т., Цудзи Т., Такеичи С. Эпитопный анализ моноклональных антител к Gc-глобулину человека (витамин D-связывающий белок) Biochem. Мол. Биол. Межд. 1998 год; 44 : 293–303. дои: 10.1080/15216549800201312. [ PubMed] [ CrossRef ] [ Академия Google ]
- Уто Ю., Каваи Т., Сасаки Т., Хамада К., Ямада Х., Кучиике Д., Кубо К., Инуи Т., Метте М., Токунага К. и др. Дегалактозилированное/десиалилированное бычье молозиво индуцирует фагоцитарную активность макрофагов независимо от продукции воспалительных цитокинов. Противораковый Рез. 2015 г.; 35 : 4487–4492. [ PubMed] [ Академия Google ]
- Бульон Р., Шуит Ф., Антонио Л., Растинежад Ф. Белок, связывающий витамин D: исторический обзор. Передний. Эндокринол. 2020; 10 :910. дои: 10.3389/fendo.2019.00910. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Дельру К., Спикеерт М.М. Витамин D и белок, связывающий витамин D, в здоровье и болезни 2.0. Межд. Дж. Мол. наук. 2023 год; 24 :10316. doi: 10.3390/ijms241210316. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Инуи Т., Кучиике Д., Кубо К., Метте М., Уто Ю., Хори Х., Сакамото Н. Клинический опыт интегративной иммунотерапии рака с помощью GcMAF. Противораковый Рез. 2013; 33 : 2917–2919. [ PubMed] [ Академия Google ]
- Амитани Х., Слоан Р.А., Самешима Н., Йонеда К., Амитани М., Моринага А., Уто Ю., Инуи Т., Инуи А., Асакава А. Разработка молозива MAF и его клиническое применение. Нейропсихиатрия. 2017 год; 7 : 246–253. doi: 10.4172/Нейропсихиатрия.1000206. [ CrossRef] [ Академия Google ]
- Кавакацу К., Исикава М., Машиба Р., Тран Н.К., Акамацу М., Нишиката Т. Характерные морфологические изменения и быстрое накопление актина в макрофагах, обработанных сывороткой-MAF. Противорак. Рез. 2019 год; 39 : 4533–4537. doi: 10.21873/anticanres.13630. [ PubMed] [ CrossRef ] [ Академия Google ]
- Линк Р.П., Перлман К.Л., Пирс Е.А., Шнос Х.К., ДеЛука Х.Ф. Очистка человеческого сывороточного витамина D-связывающего белка с помощью хроматографии на 25-гидроксивитамине D3-сефарозе. Анальный. Биохим. 1986 год; 157 : 262–269. doi: 10.1016/0003-2697(86)90624-X. [ PubMed] [ CrossRef ] [ Академия Google ]
- Левитис Е.В., Кирикович С.С., Долгова Е.В., Проскурина А.С., Риттер Г.С., Останин А.А., Черных Е.Р., Богачев С.С. In vitro анализ биологической активности национального препарата фактора активации макрофагов (GcMAF-RF) Вавиловский журнал генетики . Сел. 2020; 24 :284–291. дои: 10.18699/VJ20.621. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Долгова Е.В., Кирикович С.С., Левитес Е.В., Рузанова В.С., Проскурина А.С., Риттер Г.С., Таранов О.С., Вараксин Н.А., Рябичева Т.Г., Леплина О.Ю. и др. Анализ биологических свойств белков плазмы крови с функциональной активностью GcMAF. Межд. Дж. Мол. наук. 2022 год; 23 :8075. doi: 10.3390/ijms23158075. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Хаддад Дж.Г., Ковальски М.А., Сэнгер Дж.В. Актин-аффинная хроматография в очистке белков плазмы человека, птиц и других млекопитающих, связывающих витамин D и его метаболиты (Gc-глобулины) Biochem. Дж.1984; 218 : 805–810. дои: 10.1042/bj2180805. [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Миллер К.Г., Альбертс Б.М. Аффинная хроматография с F-актином: метод выделения ранее неопознанных актин-связывающих белков. Учеб. Натл. акад. наук. США. 1989 год; 86 : 4808–4812. дои: 10.1073/pnas.86.13.4808. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Де Соуза М.Г., Гросси А.Л., Перейра Э.Л.Б., Да Круз СО, Мендес Ф.М., Кэмерон Л.К., Пайва Иммобилизация актина CLA на хитине для очистки миозина II: лабораторное упражнение, объединяющее концепции молекулярной клеточной биологии и химии белков. Биохим. Мол. Биол. Образование. 2008 г.; 36 :55–60. дои: 10.1002/bmb.122. [ PubMed] [ CrossRef ] [ Академия Google ]
- Трухильо Г., Чжан Дж., Хабиэль Д.М., Ге Л., Рамадасс М., Гебрехивет Б., Кью Р.Р. Кофакторная регуляция хемотаксической активности C5a в физиологических жидкостях. Потребность в белке, связывающем витамин D, тромбоспондине-1 и его рецепторах. Мол. Иммунол. 2011 г.; 49 : 495–503. doi: 10.1016/j.molimm.2011.09.024. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Кук Н.Е., Дэвид Е.В. Сывороточный витамин D-связывающий белок является третьим членом семейства генов альбумина и альфа-фетопротеина. Дж. Клин. Расследование. 1985 год; 76 : 2420–2424. дои: 10.1172/JCI112256. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Осава М., Суинделлс М.Б., Таникава Дж., Танака Т., Масе Т., Фуруя Т., Икура М. Структура раствора комплекса кальмодулин-W-7: основа разнообразия в молекулярном распознавании. Дж. Мол. Биол. 1998 год; 276 : 165–176. дои: 10.1006/jmbi.1997.1524. [ PubMed] [ CrossRef ] [ Академия Google ]
- Нагасава Х., Уто Ю., Сасаки Х., Окамура Н., Мураками А., Кубо С., Кирк К.Л., Хори Х. Белок Gc (белок, связывающий витамин D): генотипирование Gc и активность предшественника GcMAF. Противораковый Рез. 2005 г.; 25 : 3689–3695. [ PubMed] [ Академия Google ]
- Браун А., Бичльмайер Р., Клив Х. Молекулярный анализ гена человеческого витамина-D-связывающего белка (группоспецифический компонент): аллельные различия общих генетических типов GC. Хм. Жене. 1992 год; 89 : 401–406. дои: 10.1007/BF00194311. [ PubMed] [ CrossRef ] [ Академия Google ]
- Останин А.А., Кирикович С.С., Долгова Е.В., Проскурина А.С., Черных Е.Р., Богачев С.С. Тернистый путь фактора активации макрофагов (GcMAF): от скамьи к постели. Вавилов Ж. Жене. Порода. 2019 год; 23 :624–631. дои: 10.18699/VJ19.535. [ CrossRef] [ Академия Google ]
- Ямамото Н., Хомма С. Белок, связывающий витамин D3 (групповой компонент), является предшественником сигнального фактора, активирующего макрофаги, из лимфоцитов, обработанных лизофосфатидилхолином. Учеб. Натл. акад. наук. США. 1991 год; 88 : 8539–8543. дои: 10.1073/pnas.88.19.8539. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ямамото Н., Нарапараджу В.Р., Орчард П.Дж. Дефектные гликозидазы лимфоцитов в каскаде активации макрофагов при ювенильном остеопетрозе. Кровь. 1996 год; 88 : 1473–1478. doi: 10.1182/blood.V88.4.1473.bloodjournal8841473. [ PubMed] [ CrossRef ] [ Академия Google ]
- Кани Ю., Маэгава Ю., Вэй Ю., Кани О. Исследование защитного эффекта GcMAF ингибитора гликозидазы и гликановой структуры белка Gc. Молекулы. 2023 год; 28 :1570. doi: 10.3390/molecules28041570. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Кирикович С.С., Левитис Е.В., Долгова Е.В., Проскурина А.С., Риттер Г.С., Рузанова В.С., Леплина О.Ю., Шевела Е.Ю., Останин А.А., Рябичева Т.Г. и др. Влияние фактора активации макрофагов (GcMAF-RF) на поляризацию макрофагов ex vivo, активацию дендритных клеток и продукцию цитокинов клетками цельной крови человека. Мед. Иммунол. 2021 год; 23 :257–274. doi: 10.15789/1563-0625-EOM-2132. [ CrossRef] [ Академия Google ]
- Рузанова В.С., Проскурина А.С., Риттер Г.С., Ефремов Ю.Р., Николин В.П., Попова Н.А., Напримеров В.А., Долгова Е.В., Поттер Е.А., Кирикович С.С. и др. Экспериментальное сравнение эффективности двух новых противораковых методов лечения in vivo. Противорак. Рез. 2021 год; 41 : 3371–3387. doi: 10.21873/anticanres.15125. [ PubMed] [ CrossRef ] [ Академия Google ]
- Джегозо С.А., Кинтеро-Мартинес А., Оуян Х., Дос Сантос А., Тейлор М.Е., Дрикамер К. Организация внеклеточной части рецептора галактозы макрофага: тримерный кластер простых сайтов связывания для N-ацетилгалактозамина. Гликобиология. 2013; 23 :853–864. doi: 10.1093/гликоб/cwt022. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Мэйс П.А., Ханс К.В., Хоос А. Перспективы и проблемы разработки иммунных агонистических антител при раке. Нат. Преподобный Друг Дисков. 2018 год; 17 : 509–527. дои: 10.1038/номер.2018.75. [ PubMed] [ CrossRef ] [ Академия Google ]
- Мартьянов А.А., Морозова Д.С., Сорокина М.А., Филькова А.А., Федорова Д.В., Узуева С.С., Сунцова Е.В., Новичкова Г.А., Жарков П.А., Пантелеев М.А. и др. Гетерогенность функции интегрина AIIbβ3 при детской иммунной тромбоцитопении, выявленная с помощью анализа непрерывной проточной цитометрии. Межд. Дж. Мол. наук. 2020; 21 :3035. doi: 10.3390/ijms21093035. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Вестерфилд Дж. М., Баррера Ф. Н. Механизмы активации мембранных рецепторов и трансмембранные пептидные инструменты для их объяснения. Ж. Биол. хим. 2020; 295 : 1792–1814. doi: 10.1074/jbc.REV119.009457. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ямамото Н., Суяма Х., Ямамото Н., Ушидзима Н. Иммунотерапия пациентов с метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF), Int. Дж. Рак. 2008 г.; 122 : 461–467. doi: 10.1002/ijc.23107. [ PubMed] [ CrossRef ] [ Академия Google ]
- Кеннет Хубер Дж. Asgr1 и его загадочный родственник, CLEC10A. Межд. Дж. Мол. наук. 2020; 21 :4818. doi: 10.3390/ijms21144818. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Раес Г., Брис Л., Дахал Б.К., Брандт Дж., Гроутен Дж., Бромбахер Ф., Ванхам Г., Ноэль В., Богерт П., Бунефаес Т. и др. Макрофаговые лектины галактозного типа C-типа как новые маркеры альтернативно активированных макрофагов, вызываемых паразитическими инфекциями и аллергическим воспалением дыхательных путей. Дж. Леукок. Биол. 2005 г.; 77 : 321–327. дои: 10.1189/jlb.0304212. [ PubMed] [ CrossRef ] [ Академия Google ]
- Ван Влит С.Дж., Селанд Э., ван Койк Ю. Сладкие предпочтения MGL: углеводная специфичность и функция. Тенденции Иммунол. 2008 г.; 29 :83–90. doi: 10.1016/j.it.2007.10.010. [ PubMed] [ CrossRef ] [ Академия Google ]
- ван Койк Ю., Иларреги Дж. М., ван Влит С. Дж. Новые взгляды на иммуномодулирующую роль дендритных клеток и экспрессируемого макрофагами лектина C-типа MGL. Иммунобиология. 2015 г.; 220 : 185–192. дои: 10.1016/j.imbio.2014.10.002. [ PubMed] [ CrossRef ] [ Академия Google ]
- Ямамото Н., Суяма Х., Накадзато Х., Ямамото Н., Кога Ю. Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF. Рак Иммунол. Иммунотер. 2008 г.; 57 : 1007–1016. doi: 10.1007/s00262-007-0431-z. [ PubMed] [ CrossRef ] [ Академия Google ]
- Иида С.И., Ямамото К., Иримура Т. Взаимодействие лектина макрофага С-типа человека с О-связанными остатками N-ацетилгалактозамина на гликопептидах муцина. Ж. Биол. хим. 1999 год; 274 : 10697–10705. дои: 10.1074/jbc.274.16.10697. [ PubMed] [ CrossRef ] [ Академия Google ]
- Зеленский А.Н., Гриди Дж.Э. Суперсемейство лектиноподобных доменов C-типа. ФЕБС Дж.2005; 272 :6179–6217. doi: 10.1111/j.1742-4658.2005.05031.x. [ PubMed ] [ CrossRef ] [ Академия Google ]
- Дрикамер К., Тейлор М.Е. Недавние исследования структур и функций лектинов C-типа в иммунной системе. Курс. Мнение. Структура. Биол. 2015 г.; 34 :26–34. дои: 10.1016/j.sbi.2015.06.003. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Тейлор М.Е., Дрикамер К. Сахарсвязывающие рецепторы млекопитающих: известные функции и неизученные роли. ФЭБС Дж.2019; 286 : 1800–1814. doi: 10.1111/февраль 14759. [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Оо-путинан С., Маенума К., Сакакура М., Денда-Нагай К., Цуиджи М., Симада И., Накамура-Цурута С., Хирабаяши Дж., Бовин Н.В., Иримура Т. Используемые аминокислоты в различных углеводных специфичностях между лектинами 1 и 2 макрофагального галактозного типа C-типа (CD301a и b) мышей. Биохим. Биофиз. Акта. 2008 г.; 1780 : 89–100. doi: 10.1016/j.bbagen.2007.10.017. [ PubMed] [ CrossRef ] [ Академия Google ]
- Чжан Б., Яо Г., Чжан Ю., Гао Дж., Ян Б., Рао З., Гао Дж. M2-поляризованные опухолеассоциированные макрофаги связаны с плохими прогнозами в результате ускоренного лимфангиогенеза при аденокарциноме легких. Клиники. 2011 г.; 66 :1879. doi: 10.1590/S1807-59322011001100006. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Климмек Д., Ханссон Дж., Раффель С., Вахрушев С.Ю., Трампп А., Крийгсвельд Дж. Протеомные краеугольные камни дифференцировки гемопоэтических стволовых клеток: отличительные признаки мультипотентных предшественников и миелоидных коммитированных клеток. Мол. Клетка. Протеомика. 2012 г.; 11 :286. дои: 10.1074/mcp.M111.016790. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Розер Т. Понимание загадочного макрофага М2 через маркеры активации и эффекторные механизмы. Медиаторы воспаления. 2015 г.; 2015 : 816460. дои: 10.1155/2015/816460. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ван Ю., Смит В., Хао Д., Хэ Б., Конг Л. Поляризация макрофагов M1 и M2 и потенциально терапевтические соединения природного происхождения. Межд. Иммунофармакол. 2019 год; 70 : 459–466. doi: 10.1016/j.intimp.2019.02.050. [ PubMed] [ CrossRef ] [ Академия Google ]
- Санчо Д., Рейс и Соуза К. Передача сигналов миелоидными лектиновыми рецепторами С-типа в иммунитете и гомеостазе. Анну. Преподобный Иммунол. 2012 г.; 30 : 491–529. doi: 10.1146/annurev-immunol-031210-101352. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Валладо Ж., Дювер-Франсис В., Пин Ж.-Ж., Клеймер М.Дж., Айт-Яхия С., Равель О., Винсент К., Вега Ф., Хелмс А., Горман Д. и др. . Незрелые дендритные клетки человека экспрессируют изоформы рецептора асиалогликопротеина для эффективного рецептор-опосредованного эндоцитоза. Дж. Иммунол. 2001 г.; 167 : 5767–5774. doi: 10.4049/jimmunol.167.10.5767. [ PubMed] [ CrossRef ] [ Академия Google ]
- Хигаси Н., Фудзиока К., Денда-Нагай К., Хашимото С.И., Нагай С., Сато Т., Фудзита Ю., Морикава А., Цуйджи М., Мията-Такеучи М. и др. Макрофаговый лектин C-типа, специфичный для галактозы/N-ацетилгалактозамина, представляет собой эндоцитарный рецептор, экспрессируемый на незрелых дендритных клетках, происходящих из моноцитов. Ж. Биол. хим. 2002 г.; 277 : 20686–20693. doi: 10.1074/jbc.M202104200. [ PubMed] [ CrossRef ] [ Академия Google ]
- Дуэлэнд С., Педерсен Дж.И., Хельгеруд П., Древон К.А. Транспорт витамина D3 из кишечника крысы. Доказательства переноса витамина D3 из хиломикронов в α-глобулины. Ж. Биол. хим. 1982 год; 257 : 146–150. дои: 10.1016/S0021-9258(19)68338-9. [ PubMed] [ CrossRef ] [ Академия Google ]
- Ситрин Р.Д., Антелл Л., Грисволд Д.Е., Бендер П.Е., Грейг Р.Г., Посте Г. Высокоэффективный жидкостный хроматографический анализ для быстрого анализа содержания субъединиц конканавалина А. Biochim. Биофиз. Acta Gen. Subj. 1982 год; 717 : 175–178. дои: 10.1016/0304-4165(82)90395-6. [ PubMed] [ CrossRef ] [ Академия Google ]
- Борель П., Кайо Д., Кано, Нью-Джерси. Биодоступность витамина D: современное состояние. Крит. Преподобный Food Sci. Нутр. 2015 г.; 55 : 1193–1205. дои: 10.1080/10408398.2012.688897. [ PubMed] [ CrossRef ] [ Академия Google ]
- Хенис Ю.И., Кацир З., Шиа М.А., Лодиш HF Олигомерная структура человеческого рецептора асиалогликопротеина: природа и стехиометрия взаимных комплексов, содержащих полипептиды H1 и H2, оцененные методом флуоресцентного фотообесцвечивания. Дж. Клеточная Биол. 1990 год; 111 : 1409–1418. дои: 10.1083/jcb.111.4.1409. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Бидер М.Д., Уолберг Дж.М., Каммерер Р.А., Шписс М. Домен олигомеризации рецептора асиалогликопротеина преимущественно образует гетеротетрамеры 2:2 in vitro. Ж. Биол. хим. 1996 год; 271 :31996–32001. дои: 10.1074/jbc.271.50.31996. [ PubMed] [ CrossRef ] [ Академия Google ]
- Руис Н.И., Дрикамер К. Дифференциальное связывание лиганда двумя субъединицами рецептора асиалогликопротеина печени крысы. Гликобиология. 1996 год; 6 :551–559. дои: 10.1093/гликоб/6.5.551. [ PubMed] [ CrossRef ] [ Академия Google ]
- Чехановер А., Шварц А.Л., Лодиш Х.Ф. Сортировка и переработка рецепторов клеточной поверхности и эндоцитозированных лигандов: азиалогликопротеиновые и трансферриновые рецепторы. Дж. Селл. Биохим. 1983 год; 23 : 107–130. дои: 10.1002/jcb.240230111. [ PubMed] [ CrossRef ] [ Академия Google ]
- Мейер М., Бидер М.Д., Малашкевич В.Н., Шписс М., Буркхард П. Кристаллическая структура домена распознавания углеводов субъединицы H1 рецептора асиалогликопротеина. Дж. Мол. Биол. 2000 г.; 300 : 857–865. дои: 10.1006/jmbi.2000.3853. [ PubMed] [ CrossRef ] [ Академия Google ]
- Шварц А.Л., Стир С.Дж., Кемпнер Э.С. Функциональный размер человеческого рецептора асиалогликопротеина, определяемый радиационной инактивацией. Ж. Биол. хим. 1984 год; 259 : 12025–12029. doi: 10.1016/S0021-9258(20)71314-1. [ PubMed] [ CrossRef ] [ Академия Google ]
- Наполетано К., Зиццари И.Г., Ругетти А., Рахими Х., Иримура Т., Клаузен Х., Вэндалл Х.Х., Беллеуди Ф., Беллати Ф., Пиерелли Л. и др. Нацеливание на лектин С-типа галактозного типа макрофагов (MGL) индуцирует передачу сигналов и активацию постоянного тока. Евро. Дж. Иммунол. 2012 г.; 42 : 936–945. дои: 10.1002/eji.201142086. [ PubMed] [ CrossRef ] [ Академия Google ]
- Эггинка Л.Л., Роби К.Ф., Кот Р., Кеннет Хубер Дж. Инновационная иммунотерапевтическая стратегия лечения рака яичников: CLEC10A и гликомиметические пептиды. Дж. Иммунотер. Рак. 2018 год; 6:28 . дои: 10.1186/s40425-018-0339-5. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Хейссмейер В., Макиан Ф., Им Ш., Варма Р., Феске С., Венупрасад К., Гу Х., Лю Ю.К., Дастин М.Л., Рао А. Кальцинеурин вызывает невосприимчивость Т-клеток посредством целевого протеолиза сигнальных белков. Нат. Иммунол. 2004 г.; 5 : 255–265. дои: 10.1038/ni1047. [ PubMed] [ CrossRef ] [ Академия Google ]
- Мюллер М.Р., Рао А. NFAT, Иммунитет и рак: фактор транскрипции достигает зрелости. Нат. Преподобный Иммунол. 2010 г.; 10 : 645–656. дои: 10.1038/nri2818. [ PubMed] [ CrossRef ] [ Академия Google ]
- Хоган П.Г. Транскрипционная передача сигналов кальция-NFAT при активации Т-клеток и истощении Т-клеток. Клеточный кальций. 2017 год; 63 :66–69. doi: 10.1016/j.ceca.2017.01.014. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Хоган К.А., Чо Д.С., Арнесон П.С., Самани А., Пэйлинс П., Ян Ю., Долес Дж.Д. Цитокины, полученные из опухоли, нарушают миогенез и изменяют иммунную микросреду скелетных мышц. Цитокин. 2018 год; 107 :9–17. doi: 10.1016/j.cyto.2017.11.006. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Гу К., Ван Л., Журавски С., О С. Сигнальный каскад через DC-ASGPR индуцирует транскрипционно активный CREB для индукции IL-10 и иммунной регуляции. Дж. Иммунол. 2019 год; 203 : 389–399. doi: 10.4049/jimmunol.1900289. [ PubMed] [ CrossRef ] [ Академия Google ]
- Юкава М., Джаганнатан С., Валлаб С., Карташов А.В., Чен Х., Вейраух М.Т., Барски А. Активность AP-1, индуцированная совместной стимуляцией, необходима для открытия хроматина во время активации Т-клеток. Дж. Эксп. Мед. 2020; 217 :е20182009. doi: 10.1084/jem.20182009. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ван Влит С.Дж., Грингхейс С.И., Гейтенбек ТБХ, ван Койк Ю. Регуляция эффекторных Т-клеток антигенпрезентирующими клетками посредством взаимодействия лектина MGL C-типа с CD45. Нат. Иммунол. 2006 г.; 7 : 12 :00–12:08. дои: 10.1038/ni1390. [ PubMed] [ CrossRef ] [ Академия Google ]
- Хермистон М.Л., Сюй З., Вайс А. CD45: критический регулятор порогов передачи сигналов в иммунных клетках. Анну. Преподобный Иммунол. 2003 г.; 21 : 107–137. doi: 10.1146/annurev.immunol.21.120601.140946. [ PubMed] [ CrossRef ] [ Академия Google ]
- Меттлен М., Чен П.Х., Сринивасан С., Данузер Г., Шмид С.Л. Регуляция клатрин-опосредованного эндоцитоза. Анну. Преподобный Биохим. 2018 год; 87 : 871–896. doi: 10.1146/annurev-biochem-062917-012644. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Исикава М., Иноуэ Т., Инуи Т., Кучиике Д., Кубо К., Уто Ю., Нишиката Т. Новая система анализа активности фактора активации макрофагов с использованием клеточной линии человека U937. Противораковый Рез. 2014 г.; 34 : 4577–4582. [ PubMed] [ Академия Google ]
- Гордон С. Фагоцитоз: иммунобиологический процесс. Иммунитет. 2016 г.; 44 : 463–475. doi: 10.1016/j.immuni.2016.02.026. [ PubMed] [ CrossRef ] [ Академия Google ]
- Сингх П., Каррахер К., Шварцбауэр Дж. Э. Сборка внеклеточного матрикса фибронектина. Анну. Преподобный Cell Dev. Биол. 2010 г.; 26 : 397–419. doi: 10.1146/annurev-cellbio-100109-104020. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Сарразин С., Ламанна В.К., Эско Дж.Д. Гепарансульфат-протеогликаны. Холодный источник Харб. Перспектива. Биол. 2011 г.; 3 : а004952. doi: 10.1101/cshperspect.a004952. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Аренс Т.Д., Банг-Кристенсен С.Р., Йоргенсен А.М., Лёппке К., Сплиид CB, Сэнд НТ, Клаузен Т.М., Саланти А., Агербек М.О. Роль протеогликанов в метастазах рака и анализе циркулирующих опухолевых клеток. Передний. Сотовое развитие. Биол. 2020; 8 :749. doi: 10.3389/fcell.2020.00749. [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
Статьи из Международного журнала молекулярных наук предоставлены Многопрофильным институтом цифровых публикаций (MDPI).
