National Library of Medicine Caspian J Intern Med. 2017 Autumn; 8(4): 228–238.
Ehsan Saburi, PhD, Amin Saburi, MD,and Mostafa Ghanei, MD
Promising role for Gc-MAF in cancer immunotherapy: from bench to bedside
Многообещающая роль Gc-MAF в иммунотерапии рака: от скамьи до постели
Иммунотерапия уже много лет используется во многих видах терапии рака.
В последнее время иммунотерапия рака фокусируется на механизмах, которые могут усилить развитие клеточного иммунитета.
Противоопухолевые препараты назначаются для ингибирования иммуносупрессивных факторов, таких как фермент нагалаза, который вырабатывается опухолевыми клетками и разрушает фактор активации макрофагов (Gc-MAF).
Противоопухолевые препараты также могут усиливать активность иммунных клеток против опухолей. Такие препараты имеют большой потенциал в иммунотерапии рака с использованием естественных механизмов человека против новообразований.
Ключевые слова: рак, иммунотерапия, фактор активации макрофагов, Gc-MAF, витамин D.
Рак является одной из наиболее частых и важных причин смертности и заболеваемости у людей.
В развитых странах рак требует огромных затрат в системе здравоохранения. Несмотря на то, что в последние десятилетия терапия рака значительно продвинулась вперед, уровень смертности от рака продолжает расти (1).
Доступные методы лечения рака варьируются и включают химиотерапию (митомизин, цисплатин), лучевую терапию и биологические препараты (генная терапия, лечение РНК-интерференцией, гормональная терапия и иммунотерапия) (2-4).
В настоящее время основное внимание в разработке лекарств уделяется биологическим препаратам. Эти препараты были разработаны для воздействия на патофизиологию раковых клеток и тканей. Гены ангиогенеза, супрессии опухолей и поверхностные антигены являются одними из мишеней для этих биологических препаратов (5).
Пептидная иммунотерапия и клеточная иммунотерапия являются двумя наиболее интересными направлениями иммунотерапии рака. Т-клетки, дендритные клетки, естественные клетки-киллеры и макрофаги как иммунные клетки находятся в центре внимания иммунотерапии рака (6).
Новые антитела, такие как бевацизумаб (Avastin), который ингибирует фактор роста эндотелия сосудов (VEGF), а также эрлотиниб (Tarceva), который является ингибитором киназы, блокирующим рецептор эпидермального фактора роста (EGFR) (7), были добавлены к химиотерапии и привели к умеренному улучшению показателей выживаемости (6-8).
Эти методы лечения связаны с производными раковых тканей и предотвращают расширение и распространение опухоли, но происхождение опухолевых тканей остается (9, 10). Противоопухолевые препараты не в полной мере эффективны для лечения всех пациентов.
Гистопатология раковой ткани выявляет недостатки защитных механизмов иммунных клеток, таких как макрофаги и нейтрофилы. По-видимому, накопление этих клеток может быть эффективным при лечении этих заболеваний (9). Gc-MAF является многообещающим, новым, неодобренным препаратом в качестве фактора активации макрофагов (MAF) для лечения рака.
Существуют убедительные доказательства его эффективности у онкологических больных, но ряд исследователей остаются под сомнением. В настоящем исследовании были изучены статьи, содержащие достоверные научные основания, чтобы помочь прийти к правильному выводу об этом продукте (Таблица 1).
Таблица 1
исследования эффективности терапии Gc-MAF при конкретных видах рака
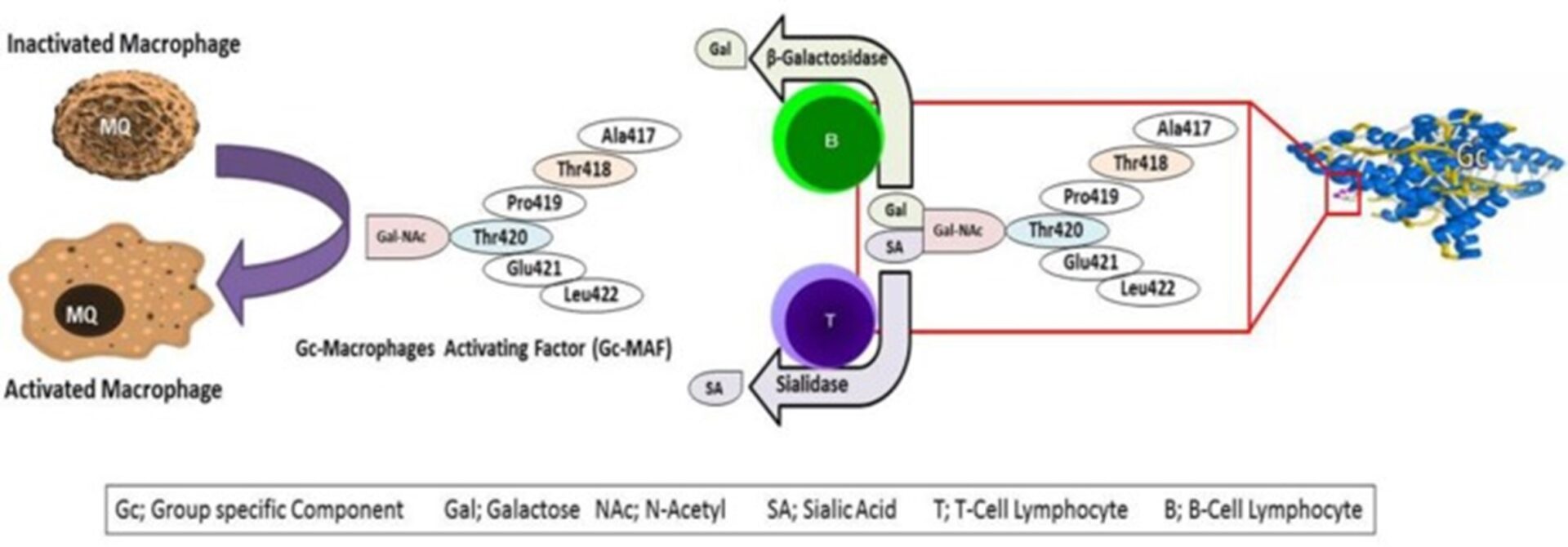
Функция, биологические и фармакологические свойства Gc-глобулина и Gc-MAF: Витамин D-связывающий белок (DBP) Gc-глобулин (компонент, специфичный для группы человека), в дополнение к хранению и транспортировке витамина D, выполняет важную физиологическую функцию в качестве поглотителя внеклеточного G-актина для увеличения хемотаксиса нейтрофилов и активации макрофагов (11).
Исследования показали, что Gc-глобулин представляет собой белок со структурой, сходной с альбумином, который является рецептором активного витамина D3 (12). Gc-глобулин играет роль в регуляции иммунной системы, остеокластической активности и в качестве первичной защиты от инфекционных факторов, таких как вирус иммунодефицита и сепсис.
Gc-глобулин в модифицированном виде способен влиять на активацию и укрепление иммунных клеток, проявляющих противоопухолевую активность. Эти молекулы активируют макрофаги после дегликозилирования через β-галактозидазу и сиалидазу В- и Т-лимфоцитов соответственно. Этот продукт поддерживает фагоцитарную, супероксидазную и иммунопотенциаторную активность Gc-MAF (группоспецифический компонент-фактор активации макрофагов; Рис 1) (11-13).
Каскад генерации Gc-MAF (11, 14)
Макрофаги, активируемые Gc-MAF, обладают различными свойствами, которые эффективны против различных видов рака в моделях человека и животных (14, 15). Кроме того, фенотипы Gc-глобулина влияют на уровень МАФ в сыворотке крови (16) и активируют перитонеальные макрофаги мышей (17).
Предыдущие исследования подтвердили, что Gc в качестве предшественника Gc-MAF значительно неспецифичен или даже полностью дегликозилирован у онкологических больных (Рис 2) (18-20).
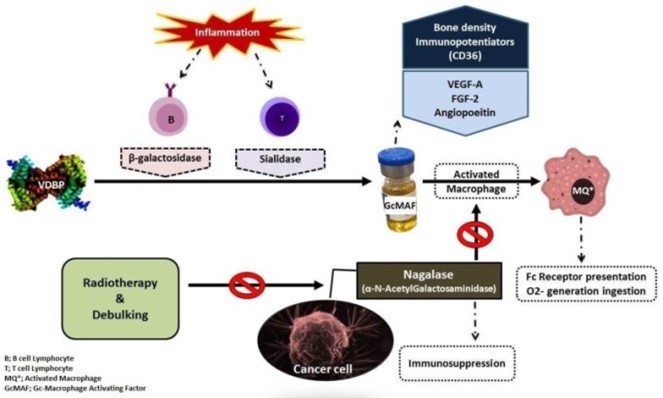
Механизм активности Gc-MAF в отношении новообразований (8, 16).
Активность предшественников MAF также была утрачена или снижена после лечения Gc-глобулином в некоторых линиях раковых клеток. Это, по-видимому, является результатом дегликозилированной ɑ-N-ацетилгалактозаминидазы (нагалазы), секретируемой раковыми клетками (18). Нагалаза была обнаружена у многих больных раком, но не у здоровых людей (19).
Исследования показали, что продукция нагалазы имеет взаимную связь с уровнем Gc-MAF и иммуносупрессией (14, 19, 21). Было продемонстрировано, что сывороточные уровни нагалазы являются хорошими прогностическими показателями некоторых типов рака (22). Уровень нагалазы в сыворотке коррелирует с опухолевой нагрузкой, и было показано, что терапия Gc-MAF прогрессирует, активность нагалазы снижается (21).
Gc-MAF и ангиогенез: Одним из аспектов иммунотерапии рака является ингибирование ангиогенеза. Ангиогенез является агентом в прогрессировании рака, и многие химиотерапевтические агенты или иммунотерапия были предложены для его ингибирования (23-25). Было показано, что Gc-MAF может ингибировать ангиогенез, индуцированный провоспалительным простагландином E1 (26). Он стимулирует образование 3′-5′-циклического аденозинмонофосфата (цАМФ) в мононуклеарных клетках периферической крови человека (PBMC) (27) и опосредует его через рецептор CD36 (28). Влияние Gc-MAF на хемотаксис или активацию опухолевых макрофагов, вероятно, является основным механизмом против ангиогенеза.
Gc-MAF для лечения раковых клеток in vitro: воспаление, индуцированное адъювантом, имеет решающее значение для сокращения времени, необходимого для оптимизации и развития иммунного ответа (29).
Фагоцитоз и антигены присутствуют в макрофагах, прайминированных воспалением, и имеют решающее значение для выработки антител, которым способствует Gc-MAF в качестве адъюванта. Введение Gc-MAF стимулирует прогениторы иммунных клеток для экстенсивного митогенеза, активирует макрофаги и вырабатывает антитела.
«Это указывает на то, что Gc-MAF является мощным адъювантом для иммунизации». Линии раковых клеток не развиваются в опухолевые гены на мышиных моделях после иммунизации с праймом Gc-MAF (29-31), и эффект Gc-MAF был одобрен для стимуляции макрофагов для ангиогенеза, пролиферации, миграции и ингибирования метастазов на опухоли, индуцированные клеточной линией рака молочной железы человека MCF-7 (15, 32).
Предыдущее исследование подтвердило, что лечение Gc-MAF в макрофагах, полученных из аутизма, умеряет дисрегулируемую экспрессию генов (33) и тот же эффект противодействует нейротоксичности оксалиплатина, препарата для химиотерапии рака (34).
Gc-MAFf или лечение рака: Inui et al. сообщили, что Gc-MAF привел к полному исчезновению всех симптомов и осложнений у 55-летней женщины с раком молочной железы, проявляющимся в виде опухоли правой подмышечной впадины, метастазов в позвоночнике, внутриплевральных узловых опухолей и правого плеврального выпота.
Протокол включал: «высокую дозу Gc-MAF второго поколения (0,5 мл), вводимую два раза в неделю внутримышечно, в общей сложности 21 инъекцию». Для достижения наилучших результатов использовались дополнительные методы лечения, такие как сонодинамическая терапия (СДТ).
Менее чем через год наблюдалось значительное увеличение процента моноцитов наряду с быстрым снижением онкомаркеров без серьезных побочных эффектов (35).
Yamamoto et al. показали, что введение Gc-MAF 16 пациентам с раком предстательной железы привело к улучшению у всех пациентов без рецидива (21). Inui et al. сообщили, что у 74-летнего мужчины, у которого был диагностирован рак предстательной железы с множественными метастазами в кости, наблюдалась полная ремиссия через девять месяцев после начала терапии GcMAF одновременно с гипер-T/NK-клетками, высокими дозами витамина С и терапией альфа-липоевой кислотой (36). Thyer et al. сообщили, что у трех мужчин с раком предстательной железы был повышен уровень нагалазы в сыворотке крови.
Примерно через год после начала лечения GcMAF у них наблюдалось значительное снижение активности нагалазы в сыворотке крови (37).
В одном исследовании оценивали снижение активности предшественника Gc-MAF у пациентов с раком полости рта с плоскоклеточной карциномой (ПКК) и пациентов с раком поджелудочной железы и показали усиление иммунной системы (22). Inui et al. изучали иммунотерапию рака с помощью Gc-MAF второго поколения (36).
В дополнение к Gc-MAF они вводили иммунные клетки, альфа-липоевую кислоту, витамин С и витамин D3 поочередно (36). Gc-MAF был проверен для использования при раке толстой кишки, щитовидной железы (38), легких (39), печени, тимуса (36), поджелудочной железы (40), рака мочевого пузыря и яичников, а также плоскоклеточной карциномы языка (37).
Он также был одобрен для лечения неопухолевых заболеваний, таких как аутизм (41), рассеянный склероз (42, 43), синдром хронической усталости (СХУ) (40), ювенильный остеопороз (44) и системная красная волчанка (45).
Выбор пациента: Важно знать, какие пациенты и какие виды рака являются лучшими кандидатами для терапии Gc-MAF. Рак предстательной железы, молочной железы, толстой кишки, печени, желудка, легких (включая мезотелиому), почек, мочевого пузыря, матки, яичников, головы/шеи и головного мозга, фибросаркомы и меланомы являются типами рака, изученными на сегодняшний день (37).
Опухолецидный ответ на Gc-MAF-терапию рака зависит от его типа и текущей стадии. В первую очередь, поскольку антигены клеточных мембран были представлены активированным макрофагам, еженедельное введение 100 нг Gc-MAF раку на разных стадиях и типах показало лечебный эффект в разное время наблюдения (30, 46).
Сообщалось, что терапия Gc-MAF более эффективна и быстра для лечения недифференцированных опухолевых клеток, таких как аденокарцинома клеток рака молочной железы и простаты, чем дифференцированных клеток, таких как клетки плоскоклеточной карциномы.
Эта скорость лечения, по-видимому, зависит как от количества рецепторов к конкретному антигену для макрофагов, так и от количества антигенов, присутствующих в каждой клетке (37).
Анемия и другие гематологические расстройства могут исказить эффективность Gc-MAF; Поэтому это лечение было предложено для пациентов без анемии. Исследования in vitro показали, что клетки рака предстательной железы и молочной железы человека чувствительны к эффектам Gc-MAF независимо от активации макрофагов (15, 47).
В этих исследованиях раковые клетки, обработанные in vitro Gc-MAF, по-видимому, обладали эффектами своего опухолевого фенотипа и метастатического потенциала, таким образом, обеспечивая биологическую основу для объяснения результатов, полученных у пациентов с раком предстательной железы и молочной железы (11, 12).
Дозировка, частота и продолжительность лечения введением Gc-MAF:
Важно определить дозировку Gc-MAF, частоту введения и продолжительность времени, необходимого для ответа на терапию, прежде чем можно будет принять решение о его применении. Исследования показали, что еженедельное введение 100 нг Gc-MAF больным раком оказывает лечебное воздействие на различные виды рака (30, 46).
Поскольку период полувыведения активированных макрофагов составляет примерно одну неделю, его необходимо вводить еженедельно. В исследованиях на животных дозировка для введения Gc-MAF для активации макрофагов считается равной 20-100 пг/мышь (48).
Макрофаги человека, активированные in vitro с помощью Gc-MAF (100 пг/мл), убивали 60% и 86% клеточных линий MCF-7 рака молочной железы при соотношении эффектор/мишень 1,5 через 4 ч и 18 ч инкубации соответственно. Таким образом, активность Gc-MAF в 1000 раз выше, чем у MAF, полученного из лизоалкилглицерина (БЦЖ-опухоль). Для лечения больных раком молочной железы применяли in vivo еженедельное внутримышечное введение Gc-MAF (100 нг) в течение 16-22 недель (21, 35-37, 46, 49).
Вполне вероятно, что частота введения будет зависеть от индивидуальной реакции, связанной с полиморфизмом рецепторов витамина D (VDR). Следует учитывать ассоциацию между полиморфизмами генов, кодирующих VDR. Дифференциальный ответ на Gc-MAF наблюдался в моноцитах человека (26), а также при метастатическом раке молочной железы (50) Эти исследования показали, что люди с разными генотипами VDR имели различную реакцию на Gc-MAF и что некоторые генотипы были более чувствительными, чем другие. Можно было бы предложить, чтобы доза и продолжительность лечения изменялись в соответствии с индивидуальным генотипом VDR. Это наблюдение поднимает вопрос о молекулярном взаимодействии между Gc-MAF и VDR.
Имеются доказательства того, что способность VDR транслоцироваться на внешнюю плазматическую мембрану индуцирует неспецифическую и быструю функцию во взаимодействии с витамином D (51, 52). В качестве сайта взаимодействия предложено молекулярное выравнивание между аминоконцом Gc-MAF и карбоксильным концом VDR (37). Олеиновая кислота представляет собой ненасыщенную жирную кислоту, связанную с Gc-MAF и стабилизирующую и облегчающую транслокацию комплекса в плазматической мембране (53, 54). По-видимому, Gc-MAF и VDR имеют несколько сайтов взаимодействия, которые предполагают прямое взаимодействие без необходимости в витамине D, Gc-глобулин вместе с витамином D может быть интернализован в клетках, и взаимодействие с VDR может происходить более интенсивно и дольше внутриклеточно (11, 55, 56).
Было продемонстрировано, что макрофаги, активированные Gc-MAF, связываются немедленно (менее 30 мин) с опухолевыми клетками предстательной железы, молочной железы, толстой кишки, полости рта и яичников in vitro, но нет клинических доказательств действия активированных макрофагов после введения Gc-MAF в раковые клетки (21) Кроме того, через 48 ч после введения 50 пг Gc-MAF мышам, большое количество клеток, секретирующих антитела, было обнаружено при анализе бляшек Йерне (48).
Сообщалось, что опухолевые клетки асцита Эрлиха, убитые теплом, больше не поддавались трансплантации мышам после шести дней лечения Gc-MAF (29). Кроме того, следует также учитывать, что реакция организма, содержащего рак, должна учитывать важный фактор, когда речь идет об иммунотерапии Gc-MAF. На самом деле, недавно была продемонстрирована роль системного воспаления и полиморфизмов гена VDR в прогнозе пациентов с прогрессирующим раком (57).
Вспомогательные препараты: В некоторых исследованиях для повышения эффективности Gc-MAF использовались дополнительные препараты (INF-α и антитромбин-3) или дополнительная иммунотерапия (NK/T-клеточная терапия) (36, 58). Gc-MAF может быть эффективным в предотвращении прогрессирования поражения с помощью сопутствующих факторов, таких как VEGF-A, FGF-2 и CD36-рецептор-опосредованный ангиопоэтин (27, 28). Необходимо определить роль химиотерапевтических препаратов в сочетании с Gc-MAF терапией.
Введение Gc-MAF онкологическим больным активирует исключительно макрофаги как важную клетку в адаптивном иммунитете. Было продемонстрировано, что Gc-MAF не активирует напрямую другие иммунные клетки, такие как дендритные клетки (35), но что макрофаги, вносящие свой вклад в процессированные антигены через комплексное опосредование MHC-II к Т-клеткам, по-видимому, преимущественно вовлечены в В-клетки (21). Gc-MAF поддерживает гуморальный иммунитет, вырабатывая, вырабатывая и высвобождая большое количество антител против рака. Клинические данные, полученные на человеческой модели пациентов с раком молочной железы, подтверждают эту гипотезу (36, 37). Имеются также данные, подтверждающие опухолецидную роль Gc-MAF через опосредование Fc-рецептора (59).
При изучении роли других видов химиотерапии в сочетании с Gc-MAF нельзя упускать из виду роль питания. Благоприятный показатель PINI связан с более длительной выживаемостью пациентов с прогрессирующим раком, и логично предположить, что онкологические больные, которые могут предотвратить возникновение или наличие кахексии, будут иметь гораздо более сильный ответ на иммунотерапию Gc-MAF (60).
Сложность изменений иммунной системы в ответ на хроническое воспаление, связанное с кахексией, намного больше, чем предполагалось ранее. Вполне вероятно, что наилучшие терапевтические реакции будут наблюдаться, когда питательные и воспалительные аспекты будут рассматриваться вместе со стимуляцией иммунной системы (61).
Побочные эффекты: Побочные эффекты химиотерапии при онкологических заболеваниях являются важным осложнением. Несмотря на то, что оптимизированная противораковая активность Gc-MAF проявляется при дозе 100 нг/человек при 30-кратном увеличении индекса фагоцитарной способности пищеварения и 15-кратном увеличении супероксидгенерирующей способности моноцитов (макрофагов), представляется, что введение более чем в 10 раз большего диапазона доз в течение 3-6 месяцев является безопасным (48, 62).
Естественный механизм активации макрофагов Gc-MAF настолько естественен, что не должен иметь никаких побочных эффектов на людях или животных моделях даже в клеточной культуре (15, 37, 47, 63). В дополнение к этим соображениям, следует отметить, что не было зарегистрировано никаких вредных побочных эффектов лечения Gc-MAF, даже когда оно было успешно назначено детям с аутизмом (64).
Маркеры ответа на лечение: Информация из предыдущих клинических исследований об эффективности Gc-MAF оценивала ответ на лечение с использованием клинических методов (таких как измерение уровня нагалазы).
Для подтверждения утверждения об «отсутствии рака в течение периода наблюдения» требуются другие достоверные методы, такие как гистопатологическое исследование.
Данные свидетельствуют о том, что устойчивые уровни ПСА в сыворотке крови через 24 недели после терапии Gc-MAF могут свидетельствовать об обратном (21). Помимо эффективности Gc-MAF в отношении активности макрофагов, он может быть потенциальным антиангиогенным агентом (28) и ингибитором миграции раковых клеток в отсутствие макрофагов (47).
Будущее использование для лечения рака: Несмотря на то, что многие виды рака находятся в центре внимания терапии Gc-MAF, она не использовалась в качестве клинического лечения рака легких и головного мозга.
В первоначальном исследовании показано противоопухолевое действие дегалактозилированного gc-глобулина на ортотопический трансплантатный рак легкого у мышей (65).
Gc-MAF был оценен на наличие нагалазы аденокарциномы слюнных желез, и исследователи пришли к выводу, что «данные убедительно свидетельствуют о том, что HSG альфа-нагалаза действует как фактор иммунодефицита у онкологических больных» (20).
Новообразования на лице могут стать будущей мишенью для Gc-MAF-терапии.
Статьи об иммунотерапии рака сосредоточены на препаратах, которые могут подавлять распространение новообразований, активируя иммунные клетки, такие как Т-клеточные лимфоциты и естественные клетки-киллеры.
Для иммунотерапии рака были предложены агонисты толл-подобных рецепторов, лечение на основе дендритных клеток и вакцины на основе микроорганизмов, такие как Bacillus Calmette-Guerin (BCG) (5, 66).
Активация или модификация естественных клеток-киллеров, дендритных клеток, DC, CTL, INF и IL-2 были рекомендованы для иммунотерапии рака (67).
Большинство доступных иммунопрепаратов для онкотерапии выполняют специфическую функцию, такую как ингибирование ангиогенеза или индуцирование апоптоза, но цель состоит в том, чтобы найти лекарство, которое может охватить все эти терапевтические аспекты.
Иммунотерапия при раке должна иметь большую эффективность при меньшем количестве побочных эффектов. Этот обзор был посвящен новому препарату, которым часто пренебрегают в проектах и исследованиях иммунотерапии рака.
В настоящее время дискуссии не учитывают активацию иммунных клеток против раковых Gc-глобулина и Gc-MAF. Клинические исследования подтвердили эффективность Gc-MAF у онкологических больных. Несмотря на то, что Gc-MAF не является рутинным препаратом в иммунотерапии рака, механизм действия этого препарата полностью выяснен.
Воспаленные ткани, такие как инфицированные или агрессированные опухолевыми клетками, высвобождают липидные метаболиты клеточной мембраны, такие как лизофосфотидилхолин (лизо-Pc) (67-69). Gc-глобулин в качестве ДАД необходим для активации макрофагов.
При наличии опухолевой ткани Gc-глобулин в качестве предшественника может быть гидролизован и активирован сиалидазой Т-лимфоцитов и β-галактозидазой лизо-Pc-праймированных В-лимфоцитов поэтапно с получением мощного MAF (11).
Это приводит к превращению Gc-глобулина в Gc-MAF, который активирует макрофаги в фагоцитарные опухолевые клетки. Когда макрофаги не могут быть должным образом активированы, инфекция и новообразования могут сформировать агрессивную опухоль (11).
Если внешний источник может обеспечить необходимое количество Gc-MAF для активации макрофагов, запускается фагоцитоз и опухоль уменьшается. Сообщалось, что нагалаза не может дегликозилировать Gc-MAF, поскольку она специфична только для Gc-глобулина (70).
В нескольких докладах было согласовано механизм функционирования Gc-MAF. Показано, что основным механизмом является активация макрофагов воспалительного происхождения с участием В- и Т-лимфоцитов (71). Внутриопухолевое введение БЦЖ или других бактериальных клеток через индуцированное воспаление в раковых тканях может привести к регрессии местных и метастазирующих опухолей (72).
В этих отчетах разъяснялась выработка специфического иммунитета против опухолей и вводился термин «опухоль-ассоциированный антиген» (TAA); однако, было показано, что индуцированное БЦЖ воспаление в доброкачественной нормальной ткани не оказывает влияния на опухолевую ткань (72).
Воспаленная (обработанная БЦЖ) опухолевая ткань способна высвобождать липидные метаболиты мембран опухолевых клеток, такие как алкилглицерины и лизоалкилфосфолипиды, поскольку мембраны опухолевых клеток содержат алкилфосфолипиды (35).
Как алкилглицерины, так и лизоалкилфосфолипиды могут действовать как активирующие макрофаги агенты и по крайней мере в 400 раз сильнее лизофосфолипидов. Это указывает на то, что макрофаги, высоко активированные при добавлении Gc-MAF, могут проявлять опухолецидную активность.
Это может объяснить причину, по которой воспаление оказывает непосредственное влияние на ограничение раковой ткани (35).
Предыдущие клинические исследования подтвердили эффективность Gc-MAF. В дополнение к активации существующих макрофагов, Gc-MAF является мощным митогенным фактором, который может стимулировать миелоидные клетки-предшественники к увеличению количества системных клеток макрофагов в 40 раз за четыре дня (48).
Недавнее появление Gc-MAF на пищевой основе, который образуется во время ферментации молочных продуктов, может обеспечить дальнейшие области исследований и применения этого многообещающего подхода (73).
Несмотря на то, что Gc-MAF был успешно использован для иммунотерапии онкологических больных, их аспект должен быть рассмотрен в будущих исследованиях.
В заключение следует отметить, что активация и вклад клеток (NK- и Т-хелперов, лимфоцитов) и факторов, связанных с иммунотерапией, являются более сложными и дорогостоящими, чем использование терапии Gc-MAF.
Более того, эти клетки и факторы показали примерно в 10 раз меньшую активность, чем естественно активированные (вызванные воспалением) макрофаги. Существует необходимость в разработке дальнейших исследований для прямого сравнения эффективности рутинной иммунотерапии рака с использованием активирующей NK-терапии и Gc-MAF.
Также следует задать вопрос о том, почему этот препарат до сих пор не одобрен FDA. Несмотря на сомнения, высказанные в результате некоторых клинических исследований, эффективность этого препарата была подтверждена в нескольких исследованиях. Похоже, что существуют ненаучные причины, которые препятствуют одобрению FDA.
Подтверждения:
Мы хотели бы поблагодарить д-ра Ашрафа Карбаси и д-ра Марко Руджеро за их ценные комментарии.
Конфликт интересов:
Конфликт интересов отсутствует.
Сокращение
РАС; Расстройства аутистического спектра, БЦЖ; Бацилла Кальметта-Герена, цАМФ; 3′-5′-циклический аденозинмонофосфат, СХУ: синдром хронической усталости, EGFR; рецептор эпидермального фактора роста, FT3; Свободный трийодтиронин, FT4; свободный тироксин, Gc; Групповой компонент, Gc-MAF; Группоспецифический компонент — фактор активации макрофагов, HCT116; клеточная линия колоректального рака, HepG2; клеточная линия гепатомы человека, IM; внутримышечно, INF-α; интерферон-α, лизо-Pc; лизофосфотидилхолин, МАФ; фактор активации макрофагов, MCF-7; клеточная линия рака молочной железы человека, MS; рассеянный склероз, нагалаза; α-N-ацетилгалактозаминидаза, NK-клетка; естественные клетки-киллеры, PBMCs; мононуклеарные клетки периферической крови, РНК-интерференции; РНК-интерференция, СК; подкожно, ПКК; плоскоклеточный рак, СДТ; Сонодинамическая терапия, SRBC; эритроциты овец, ТТГ; тиреотропный гормон, VDBP=DBP; белок, связывающий витамин D, VDR; рецептор витамина D, VEGF; Фактор роста эндотелия сосудов.
Ссылки
- Чхон С., Агарвал А., Попович М. и др. Точность прогнозов клиницистов о выживаемости при прогрессирующем раке: обзор. Энн Паллиат Мед. 2016; 5:22–9. [PubMed] [Google Академия]
- Гербер Х.., Сапра., Логанзо Ф., Мэй С. Сочетание конъюгатов антитело-лекарство и иммуноопосредованной терапии рака: чего ожидать? Биохим Фармакол. 2016; 102:1–6. [PubMed] [Google Академия]
- Ортис Р., Мельгизо С., Прадос Дж. Новые стратегии генной терапии для лечения рака: обзор последних патентов. Недавний противоопухолевый препарат Pat Discov. 2012; 7:297–312. [PubMed] [Google Академия]
- Пергиалиотис В., Пицуни Э., Продромиду А. и др. Гормональная терапия у выживших после рака яичников: систематический обзор и мета-анализ. Менопауза. 2016; 23:335–42. [PubMed] [Google Академия]
- Кирквуд Дж.М., Баттерфилд Л.Х., Тархини А.А. и др. Иммунотерапия рака в 2012 году. К.А. Рак J Clin. 2012; 62:309–35. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Джонсон Б.Е., Каббинавар Ф., Ференбахер Л., и др. ATLAS: рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы IIIB, сравнивающее терапию бевацизумабом с эрлотинибом или без него, после завершения химиотерапии, с бевацизумабом для лечения первой линии распространенного немелкоклеточного рака легкого. J Clin Oncol. 2013; 31:3926–34. [PubMed] [Google Академия]
- Диклер М.Н., Руго Х.С., Эберле К.А. и др. Исследование II фазы эрлотиниба в комбинации с бевацизумабом у пациенток с метастатическим раком молочной железы. Clin Cancer Res. 2008; 14:7878–83. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Накаде Дж., Такеучи С., Накагава Т. и др. Тройное ингибирование EGFR, Met и VEGF подавляет повторный рост HGF-триггерного, эрлотиниб-резистентного рака легкого, содержащего мутацию EGFR. J Thorac Oncol. 2014; 9:775–83. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Худис К.А. Клиническое значение антиангиогенной терапии. Онкология (Уиллистон Парк), 2005; 19:26–31. [PubMed] [Google Академия]
- Туми.Г., Вохра Н.А., Ганса Т., Сарнаик А.А., Пилон-Томас С.А. Иммунотерапия злокачественных новообразований желудочно-кишечного тракта. Борьба с раком. 2013; 20:32–42. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Нагасава Х., Уто Ю., Сасаки Х. и др. Белок Gc (витамин D-связывающий белок): генотипирование Gc и активность предшественника GcMAF. Противоопухолевый Res. 2005; 25:3689–95. [PubMed] [Google Академия]
- Шпиккерт М., Хуан Г., Деланж Дж.Р., Тэс Й.Е. Биологические и клинические аспекты связывающего витамин D белка (Gc-глобулина) и его полиморфизма. Клин Чим Акта. 2006; 372:33–42. [PubMed] [Google Академия]
- Нарапараджу В.Р., Ямамото Н. Роль бета-галактозидазы В-лимфоцитов и сиалидазы Т-лимфоцитов в активации макрофагов, вызванной воспалением. Иммунол Летт. 1994; 43:143–8. [PubMed] [Google Академия]
- Мохамад С.Б., Нагасава Х., Уто Ю., Хори Х. Получение фактора активации макрофагов на основе белка Gc (GcMAF) и его структурная характеристика и биологическая активность. Противоопухолевый Res. 2002; 22:4297–300. [PubMed] [Google Академия]
- Пачини С., Пунци Т., Моруччи Г., Гулисано М., Руджеро М. Влияние фактора, активирующего макрофаги, полученного из белка витамина D, на клетки рака молочной железы человека. Противоопухолевый Res. 2012; 32:45–52. [PubMed] [Google Академия]
- Дебрюн Э., Шпиккерт М., Вейгерде Ю.В., Деланге Ж. Фенотип Gc-глобулина влияет на уровень фактора активации макрофагов (MAF) в сыворотке крови. Clin Chem Lab Med. 2011; 49:1855–60. [PubMed] [Google Академия]
- Уто Ю., Ямамото С., Такеучи Р. и др. Влияние предшественника Gc-активирующего фактора макрофагов (preGcMAF) на фагоцитарную активацию перитонеальных макрофагов мышей. Противоопухолевый Res. 2011; 31:2489–92. [PubMed] [Google Академия]
- Мохамад С.Б., Нагасава Х., Уто Ю., Хори Х. Активность опухолевых клеток альфа-N-ацетилгалактозаминидазы и ее участие в активации макрофагов, связанных с GcMAF. Comp Biochem Physiol A Mol Integr Physiol. 2002; 132:1–8. [PubMed] [Google Академия]
- Редди А.Л., Шанкаранараянан К., Арулрадж Х.С., Деварадж Н., Деварадж Х. Сывороточная альфа-N-ацетилгалактозаминидаза связана с диагностикой/прогнозом пациенток с плоскоклеточным раком шейки матки.Рак Летт. 2000; 158:61–4. [PubMed] [Google Академия]
- Мацуура Т., Уэмацу Т., Ямаока М., Фурусава К. Влияние альфа-N-ацетилгалактозаминидазы клеточного происхождения аденокарциномы слюнных желез на биоактивность фактора активации макрофагов.Int J Oncol. 2004; 24:521–8. [PubMed] [Google Академия]
- Ямамото Н., Суяма Х. Иммунотерапия рака предстательной железы макрофаг-активирующим фактором, полученным из белка Gc, GcMAF. Transl Oncol. 2008; 1:65–72. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Редер Д.С., Нельсон Р.В., Борхес К.Р. Статус гликозилирования белка, связывающего витамин D, у онкологических больных. Протеин наук. 2009; 18:2036–42. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Аллард Б., Теркотт М., Спринг К. и др. Терапия анти-CD73 нарушает опухолевый ангиогенез. Инт Дж Рак. 2014; 134:1466–73. [PubMed] [Google Академия]
- Чоудхари С., Чемберлен М. Бевацизумаб для лечения глиобластомы. Эксперт Rev Neurother. 2013; 13:937–49. [PubMed] [Google Академия]
- Ван К., Ли Т., Ву З. и др. Новый конберцепт синтеза рецепторов-приманок VEGF, нацеленный на несколько изоформ VEGF, обеспечивает замечательный антиангиогенез эффект in vivo. PLoS One. 2013; 8:Э70544. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Пачини С., Моруччи Г., Пунци Т. и др. Влияние парикальцитола и GcMAF на ангиогенез и пролиферацию и передачу сигналов мононуклеарных клеток периферической крови человека. Дж.2012; 25:577–81. [PubMed] [Google Академия]
- Пачини С., Моруччи Г., Пунци Т., Гулисано М., Руджеро М. Макрофагально-активирующий фактор (GcMAF) на основе белка Gc стимулирует образование цАМФ в мононуклеарных клетках человека и ингибирует ангиогенез в анализе хорионаллантоической мембраны куриного эмбриона. Рак Иммунол Иммунотер. 2011; 60:479–85. [PubMed] [Google Академия]
- Канда С., Мотидзуки Ю., Мията Ю., Канетаке Х., Ямамото Н. Влияние фактора активации макрофагов (GcMAF) на витамин D(3)-связывающий белок, полученный из макрофагов (GcMAF), на ангиогенез. J Natl Cancer Inst. 2002; 94:1311–9. [PubMed] [Google Академия]
- Ямамото Н., Нарапараджу В.Р. Структурно хорошо выраженный фактор активации макрофагов, полученный из витамин-D3-связывающего белка, обладает мощной адъювантной активностью для иммунизации. Иммунол Клеточный Биол. 1998; 76:237–44. [PubMed] [Google Академия]
- Ямамото Н., Нарапараджу В.Р. Иммунотерапия мышей BALB/c, несущих асцит Эрлиха, опухолью с активирующим фактором макрофагов на основе витамина D. Cancer Res. 1997; 57:2187–92. [PubMed] [Google Академия]
- Кучиике Д., Уто Ю., Мукай Х. и др. Дегалактозилированная/дезиалированная сыворотка крови человека, содержащая GcMAF, индуцирует фагоцитарную активность макрофагов и противоопухолевую активность in vivo. Противоопухолевый Res. 2013; 33:2881–5. [PubMed] [Google Академия]
- Тайер Л., Уорд Э., Смит Р. и др. Новая роль основного компонента оси витамина D: фактор активации макрофагов, связывающий белок витамина D, индуцирует апоптоз клеток рака молочной железы человека путем стимуляции макрофагов. Питательных веществ. 2013; 5:2577–89. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Синискалько Д., Брэдстрит Дж.Дж., Чирилло А., Антонуччи Н. Влияние in vitro GcMAF на транскрипциономику эндоканнабиноидной системы, образование рецепторов и клеточную активность макрофагов аутистического происхождения. J Нейровоспаление. 2014; 11:78. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Моруччи Г., Бранка Дж.Дж., Гулизано М. и др. Фактор активации макрофагов, полученных из Gc-белка, противодействует повреждению нейронов, индуцированному оксалиплатином. Противоопухолевые препараты. 2015; 26:197–209. [PubMed] [Google Академия]
- Инуи Т., Макита К., Миура Х. и др. Клинический случай: Пациентка с раком молочной железы, получавшая GcMAF, сонодинамическую терапию и гормональную терапию. Противоопухолевый Res. 2014; 34:4589–93. [PubMed] [Google Академия]
- Инуи Т., Кучике Д., Кубо К. и др. Клинический опыт интегративной иммунотерапии рака с помощью GcMAF. Противоопухолевый Res. 2013; 33:2917–9. [PubMed] [Google Академия]
- Тайер Л., Уорд Э., Смит Р. и др. Фактор, активирующий макрофаги на основе белка GC, снижает уровень альфа-ацетилгалактозаминидазы у больных раком на поздних стадиях. Онкоиммунология. 2013; 2:Э25769. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Чайясит К., Тосио И., Виваниткит В. Использование фактора активации макрофагов, полученного из белка Gc, для лечения рака щитовидной железы. J Cancer Res Ther. 2015; 11:1041. [PubMed] [Google Академия]
- Инуи Т., Амитани Х., Кубо К. и др. Клинический случай: пациент с немелкоклеточным раком легкого, получавший GcMAF, сонодинамическую терапию и поля для лечения опухолей. Противоопухолевый Res. 2016; 36:3767–70. [PubMed] [Google Академия]
- Инуи Т., Кубо К., Кучиике Д. и др. Фактор, активирующий макрофаги молозива при серьезной инфекции и синдроме хронической усталости: три клинических случая. Противоопухолевый Res. 2015; 35:4545–9. [PubMed] [Google Академия]
- Брэдстрит Дж.Дж., Вогелаар Э., Тайер Л. Первоначальные наблюдения повышенной активности альфа-N-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдаемым снижением от инъекций Gc-макрофагального активирующего фактора. Аналитика аутизма. 2012; 4:31. [Google Академия]
- Инуи Т., Кацуура Г., Кубо К. и др. Клинический случай: Лечение GcMAF у пациента с рассеянным склерозом. Противоопухолевый Res. 2016; 36:3771–4. [PubMed] [Google Академия]
- Тайер Л., Уорд Э., Смит Р. и др. Терапевтические эффекты высокоочищенного дегликозилированного GcMAF в иммунотерапии пациентов с хроническими заболеваниями. Ам Джей Иммунол. 2013; 9:78–84. [Google Академия]
- Ямамото Н., Нарапараджу В.Р., Орчард.Дж. Дефектные гликозидазы лимфоцитов в каскаде активации макрофагов ювенильного остеопетроза. Кровь. 1996; 88:1473–8. [PubMed] [Google Академия]
- Ямамото Н., Нарапараджу В.Р., Мур М., Брент Л.Х. Дегликозилирование сывороточного витамин-D3-связывающего белка альфа-N-ацетилгалактозаминидазой, выявленное в плазме крови пациентов с системной красной волчанкой. Клин Иммунол Иммунопатол. 1997; 82:290–8. [PubMed] [Google Академия]
- Кога Ю., Нарапараджу В.Р., Ямамото Н. Противоопухолевое действие фактора активации макрофагов витамин-D-связывающего белка на мышей с асцитом Эрлиха. Proc Soc Exp Biol Med. 1999; 220:20–6. [PubMed] [Google Академия]
- Грегори К.Дж., Чжао Б., Биленберг Д.Р. и др. Фактор активации белка-макрофагов витамина D непосредственно ингибирует пролиферацию, миграцию и экспрессию uPAR клеток рака предстательной железы. PLoS One. 2010; 5:Э13428. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Ямамото Н. Структурное определение мощного фактора активации макрофагов, полученного из витамина D3-связывающего белка с адъювантной активностью для продукции антител. Мол Иммунол. 1996; 33:1157–64. [PubMed] [Google Академия]
- Хашимото Ю. Исследование механизма активации макрофагов перитонеального экссудата у мышей MRL/MpJ-lpr/lpr. Хоккайдо Игаку Дзасси. 1988; 63:781–90. [PubMed] [Google Академия]
- Руджеро М., Пачини С., Атерини С. и др. Полиморфизм гена рецептора витамина D связан с метастатическим раком молочной железы. Онкол Рес. 1998; 10:43–6. [PubMed] [Google Академия]
- Капиати Д., Бенасси С., Боланд Р.Л. 1,25(OH)2-витамин D3 индуцирует транслокацию рецептора витамина D (VDR) к плазматической мембране в клетках скелетных мышц. J Cell Biochem. 2002; 86:128–35. [PubMed] [Google Академия]
- Челья Л., Харрис С.С. Витамин D и его роль в скелетной мускулатуре. Кальцифная ткань Int. 2013; 92:151–62. [PubMed] [Google Академия]
- Вильямс М.Х., Ван Алстайн Э.Л., Гэлбрейт Р.М. Доказательства новой ассоциации ненасыщенных жирных кислот с Gc (витамин D-связывающий белок) Biochem Biophys Res Commun. 1988; 153:1019–24. [PubMed] [Google Академия]
- Руджеро М., Уорд Э., Смит Р. и др. Олеиновая кислота, дегликозилированный витамин D-связывающий белок, оксид азота: молекулярная триада, ставшая смертельной для рака. Противоопухолевый Res. 2014; 34:3569–78. [PubMed] [Google Академия]
- Хлон Т.М., Таффани Д.А., Уэлш Дж., Роулинг М.Дж. Ретиноиды модулируют экспрессию эндоцитарных партнеров мегалина, кубилина и инвалида-2 и поглощение витамина D-связывающего белка в клетках молочной железы человека. J Nutr. 2008; 138:1323–8. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Карбаси А., Сабури А. Витамин D и рак молочной железы. Индийский J Эндокринол Метаб. 2012; 16:1047. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Пунци Т., Фабрис А., Моруччи Г. и др. Уровни С-реактивного белка и полиморфизмы рецепторов витамина D как маркеры в прогнозировании кахектического синдрома у онкологических больных. Mol Diagn Ther. 2012; 16:115–24. [PubMed] [Google Академия]
- Онидзука С., Каваками С., Танигучи К., Фудзиока Х., Миясита К. Канцерогенез поджелудочной железы: апоптоз и ангиогенез. Поджелудочная железа. 2004; 28:317–9. [PubMed] [Google Академия]
- Нгвенья Б.З., Ямамото Н. Активация перитонеальных макрофагов лизофосфатидилхолином. Биохим Биофис Акта. 1985; 839:9–15. [PubMed] [Google Академия]
- Фабрис А., Бьяджони., Пунци Т. и др. Роль полиморфизмов генов ангиотензинпревращающего фермента и рецептора витамина D при синдроме анорексии-кахексии рака. Ам Джей Иммунол. 2012; 8:65–70. [Google Академия]
- Хатами М. Неразрешенное воспаление: «иммунное цунами» или эрозия целостности в иммунопривилегированных и иммуночувствительных тканях, а также острые и хронические воспалительные заболевания или рак. Экспертное мнение Биол Тер. 2011; 11:1419–32. [PubMed] [Google Академия]
- Ямамото Н., Нарапараджу В.Р., Асбелл С.О. Дегликозилирование сывороточного витамин-D3-связывающего белка приводит к иммуносупрессии у онкологических больных. Cancer Res. 1996; 56:2827–31. [PubMed] [Google Академия]
- Калкунте С., Брард Л., Гранай К.О., Свами Н. Ингибирование ангиогенеза витамин-D-связывающим белком: характеристика антиэндотелиальной активности DBP-maf. Ангиогенез. 2005; 8:349–60. [PubMed] [Google Академия]
- Брэдстрит Дж., Вогелаар Э., Тайер Л. Первоначальные наблюдения повышенной активности альфа-N-ацетилгалактозаминидазы, связанной с аутизмом, и наблюдаемого снижения от инъекций белка-макрофага GC. Аналитика аутизма. 2012; 4:31–8. [Google Академия]
- Хирота К., Накагава Ю., Такеучи Р. и др. Противоопухолевое действие дегалактозилированного gc-глобулина на ортотопический трансплантатный рак легкого у мышей. Противоопухолевый Res. 2013; 33:2911–5. [PubMed] [Google Академия]
- Томас А., Хассан Р. Иммунотерапия немелкоклеточного рака легкого и мезотелиомы. Ланцет Онкол. 2012; 13:Э301–10. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Ямамото Н., Нгвенья Б.З. Активация перитонеальных макрофагов мышей лизофосфолипидами и эфирными производными нейтральных липидов и фосфолипидов. Cancer Res. 1987; 47:2008–13. [PubMed] [Google Академия]
- Фукс Б., Шиллер Дж., Вагнер У., Хенцшель Х., Арнольд К. Соотношение фосфатидилхолин/лизофосфатидилхолин в плазме крови человека является индикатором тяжести ревматоидного артрита: исследования с помощью 31 P ЯМР и MALDI-TOF MS. Clin Biochem.2005; 38:925–33. [PubMed] [Google Академия]
- Ямамото Н., Кумаширо Р. Превращение белка, связывающего витамин D3 (группоспецифический компонент) в фактор активации макрофагов путем ступенчатого действия бета-галактозидазы В-клеток и сиалидазы Т-клеток. Дж Иммунол. 1993; 151:2794–802. [PubMed] [Google Академия]
- Руджеро М., Пачини С. Ось витамина D при хронической болезни почек — современное состояние и будущие перспективы. Eur Nephrol. 2011; 5:15–9. [Google Академия]
- Хомма С., Ямамото Н. Процесс активации макрофагов после обработки in vitro лимфоцитов мышей додецилглицерином. Клин Эксп Иммунол. 1990; 79:307–13. [Бесплатная статья о PMC] [PubMed] [Google Scholar]
- Збар Б., Танака Т. Иммунотерапия рака: регресс опухолей после внутриочагового введения живой Mycobacterium bovis. Наука. 1971; 172:271–3. [PubMed] [Google Академия]
- Пачини С., Пунци Т., Моруччи Г., Руджеро М. Макрофаги слизисто-ассоциированной лимфоидной ткани (MALT) как ключевые элементы иммунного ответа на витамин-D-связывающий белок-макрофагальный активирующий фактор. Ital J Anat Embryol. 2011; 116:136. [Google Академия]
- Уорд Э., Смит Р., Бранка Дж.В. и др. Клинический опыт иммунотерапии рака в сочетании с олеиновой кислотой в комплексе с дегликозилированным белком, связывающим витамин D. Ам Джей Иммунол. 2014; 10:23–32. [Google Академия
