NCBI Literature Resources Front Immunol. 2019; 10: 2965.
Paula Dobosz and Tomasz Dzieciątkowski
The Intriguing History of Cancer Immunotherapy
Интригующая история иммунотерапии рака
Содержание
Иммунотерапию часто воспринимают как относительно недавнее достижение.
В действительности, однако, зачатки иммунотерапии рака под разными названиями следует искать еще в Античности.
Первые научные попытки модулировать иммунную систему пациентов для лечения рака можно отнести к двум немецким врачам, Фелейзену и Бушу, которые независимо заметили значительную регрессию опухоли после заражения рожей.
Следующие значительные достижения были сделаны Уильямом Брэдли Коли, который сегодня известен как отец иммунотерапии.
Именно Коли впервые попытался использовать иммунную систему для лечения рака костей в 1891 году. иммунитет в 1967 году активизировали исследования в области известной сегодня иммунотерапии рака.
В следующей статье рассматривается иммунотерапия рака от ее известных истоков до недавних событий, включая присуждение Нобелевской премии 2018 года Джеймсу Эллисону и Тасуку Хондзё за их кропотливую работу над молекулами контрольных точек как потенциальными терапевтическими мишенями.
Эта работа привела к успешной разработке новых ингибиторов контрольных точек, CAR Т-клеток и онколитических вирусов, и темпы таких достижений вселяют большие надежды на будущее лечения рака.
Ключевые слова: история иммунотерапии, иммунотерапия, иммунотерапия рака, CAR T, онколитический вирус, ингибиторы контрольных точек.
Введение
Мы склонны думать, что иммунотерапия — это совсем недавнее достижение медицины, появившееся не позднее пары десятилетий назад. На самом деле, самое начало иммунотерапии в широком смысле можно отнести к периоду китайской династии Цинь, примерно в третьем веке до нашей эры ( 1 ).
Хотя это трудно доказать, в скудных письменных источниках упоминается целенаправленная прививка вирусом натуральной оспы для предотвращения заболевания оспой ( 1 , 2 ).
Много столетий спустя, в 1718 году, об этой практике сообщила в Османской империи леди Мэри Уортли Монтегю, жена британского посла, проживающего в Стамбуле ( 1 ).
Вдохновленная местными обычаями и их положительным результатом, она попыталась популяризировать прививку по возвращении в Англию, но безуспешно из-за сопротивления и общего недоверия британских врачей ( 1 ).
Тем не менее, в 1765 году доктор Джон Фьюстер представил аналогичный отчет членам Лондонского медицинского общества ( 1 ).
Вскоре после этого, в 1796 году, Эдвард Дженнер продемонстрировал защитный иммунитет против оспы посредством прививки вирусом обычной коровьей оспы ( 1 ).
Это событие было воспринято многими как начало эры вакцинации, которая, несомненно, изменила современную медицину и спасла миллионы жизней во всем мире.
История прививок, какой бы привлекательной и чудесной она ни была, не будет подробно описана в этой статье.
Вместо этого мы проследим относительно современную часть истории иммунотерапии, иммунотерапию в строгом смысле слова , сосредоточив внимание на лечении рака от самых первых попыток до лауреатов Нобелевской премии 2018 года Джеймса П. Эллисона и Тасуку Хондзё за открытие терапии рака путем ингибирования. негативной иммунной регуляции (Рисунок 1).
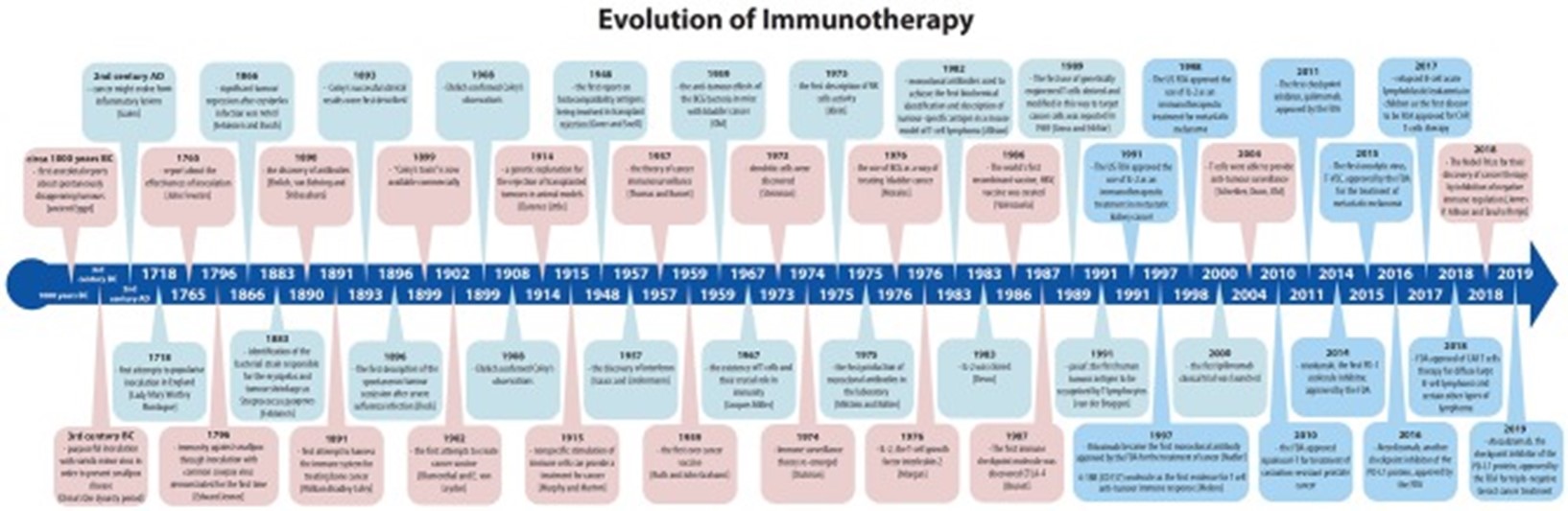
История иммунотерапии; были отмечены крупные прорывы, включая одобрение FDA в этой области.
Начало
От Древнего Египта, около 3000 лет назад, до начала девятнадцатого века поступали многочисленные сообщения об исчезновении опухолей спонтанно или после инфекции с сопутствующей высокой лихорадкой ( 3 , 4 ).
Сходство между раком и воспалением было впервые описано греческим врачом Галеном, который отметил, что рак может развиваться из воспалительных поражений ( 5 ).
Первые научные попытки модулировать иммунную систему пациентов для лечения рака можно отнести к двум немецким врачам, Фелейзену и Бушу, которые независимо заметили значительную регрессию опухоли после заражения рожей ( 4 ).
Они оба описали свои наблюдения и попытались повторить их позже, но без особого успеха ( 4 ).
В конце концов Фелейзену удалось правильно идентифицировать бактериальный штамм, ответственный за рожу и уменьшение опухоли, как Streptococcus pyogenes ( 4 ).
Следующие значительные достижения были сделаны Уильямом Брэдли Коли, который сегодня известен как отец иммунотерапии. Коли впервые попытался использовать иммунную систему для лечения рака костей в 1891 году ( 6 , 7 ).
Он непосредственно наблюдал ряд случаев, когда у онкологических больных наступала спонтанная ремиссия после развития рожи — стрептококковой инфекции кожи ( 7 ).
Он также углубился в медицинские записи, эпикризы и медицинскую литературу, доступную ему в конце девятнадцатого века, включая работы его предшественников, и обнаружил целых 47 историй болезни пациентов с потенциально неизлечимыми раковыми заболеваниями, у которых наступила спонтанная ремиссия после сопутствующей острой бактериальной инфекции. инфекция ( 1 , 4 ).
Спонтанная регрессия опухоли встречается крайне редко и встречается примерно у 1 из 60 000–100 000 онкологических больных во всем мире. Однако это широко распространенное явление: отчеты о случаях заболевания регулярно публикуются во всем мире в современных медицинских журналах ( 4 ).
С 1891 года Коли пошел еще дальше; он начал вводить различные смеси живых и инактивированных Streptococcus pyogenes и Serratia marcescens в опухоли пациентов и, таким образом, можно сказать, что он разработал первое иммунное лечение рака ( 1 , 6 , 7 ).
Хотя его успешные клинические результаты были впервые описаны в мае 1893 года, Коли не пользовался уважением в медицинском обществе ( 1 , 8 ).
Он достиг стойкой и полной ремиссии при нескольких типах злокачественных новообразований, начиная с саркомы, лимфомы и рака яичек, и сообщил о более чем 1000 регрессиях или полностью излеченных пациентах ( 4 , 6 , 7 ).
Несмотря на этот успех, отсутствие известного механизма действия « токсинов Коли » (коммерчески доступных с 1899 года), а также риск заражения онкологических больных высокопатогенными бактериями заставили онкологи в начале двадцатого века отдать предпочтение хирургии и лучевой терапии. ( 1 , 6 , 8 , 9 ).
В результате наследие Коли было широко забыто и даже отрицалось в течение нескольких десятилетий.
Интерес к иммунной системе снова вспыхнул после 1945 года, когда появились многочисленные достижения в области исследований иммунитета и рака, такие как открытие интерферона ( 10 ) или, например псле очень успешной работой Рут и Джона Грэмов над первой в истории вакциной против рака. Работа последних осталась практически незамеченной, несмотря на то, что у 22% пациентов, участвовавших в исследовании, наблюдалась стабильная болезнь или ремиссия рака ( 1 ).
Существование Т-клеток и их решающая роль в иммунитете не было очевидным до 1967 года, когда Жак Миллер охарактеризовал их функцию в своей ключевой публикации « Nature » ( 11 ).
Шесть лет спустя были открыты дендритные клетки (1973, Штейнман), за которым последовало первое описание активности естественных клеток-киллеров (NK-клеток) (1975, Кляйн) ( 1 , 12-14 ) .
Между тем, накопление знаний в области иммунологии позволило исследователям и врачам из Университета Миннесоты стать пионерами трансплантации костного мозга в качестве лечения гематологического рака — метода, который используется до сих пор ( 15 ).
Первые испытания трансплантации как метода лечения рака проводились более столетия, прежде чем они достигли первого успеха, в основном на мышах. Усилия были активизированы после того, как Кларенс Литтл представил генетическое объяснение отторжения трансплантированных опухолей на животных моделях в 1914 году и получил дальнейшее развитие в 1948 году после первого сообщения об антигенах гистосовместимости, участвующих в отторжении трансплантата ( 4 , 16 ).
Наконец, в 1980-х годах, когда первая вакцина, основанная на одном антигене клеточной поверхности, стала доступной в виде вакцины против гепатита В, область иммунотерапии в конечном итоге возродилась ( 1 ).
Вновь появился оптимизм по поводу того, что иммунотерапия может быть использована для лечения многих заболеваний, включая рак, и стимулировал исследования того, где мы находимся в данный момент.
Иммунная система в ответе
Почти пятьдесят лет назад профессор Ллойд Дж. Олд, пионер иммуноонкологии рака, заметил, что «в раковой клетке есть что-то уникальное, что отличает ее от нормальных клеток, и что это отличие может быть распознано иммунной системой организма» ( 17) .
Он правильно предсказал, что в будущем иммунотерапия станет четвертым видом лечения рака, наряду с хирургией, химиотерапией и лучевой терапией, но он ожидал гораздо более быстрого прогресса ( 17 ).
Прошло несколько десятилетий интенсивных исследований и клинических испытаний, прежде чем иммунотерапия рака заняла свое законное место в качестве четвертого столпа лечения рака.
В 1908 году Пол Эрлих подтвердил наблюдения Коли, сообщавшие о спонтанном подавлении нескольких опухолей под действием иммунной системы ( 8 ).
В то же время Мерфи и Мортон из Американского института Рокфеллера проводили эксперименты на мышах, которые привели их к формулировке в 1915 году гипотезы о том, что даже неспецифическая стимуляция иммунных клеток, особенно лимфоцитов, может обеспечить лечение рака ( 18 ).
Однако испытания на людях в последующие годы оказались очень неудачными и привели к отказу от гипотезы и отказу от самой идеи иммунотерапии рака на десятилетия ( 8 ).
Стратегия использования бактерий для лечения рака вновь возникла в 1976 году, когда было проведено исследование по изучению использования бациллы Кальметта-Герена (БЦЖ), противотуберкулезной вакцины, как способа предотвращения рецидива рака мочевого пузыря ( 4 , 6 , 19 ).
Идея возникла в результате исследования 1959 года, проведенного Олдом и его командой и демонстрировавшего противоопухолевое действие бактерий БЦЖ на мышах с раком мочевого пузыря ( 4 , 20 ).
Вакцина БЦЖ состоит из ослабленных живых бактерий, тесно связанных с теми, которые вызывают туберкулез ( 21 ).
Их вводили в растворе в мочевой пузырь раковых больных и оставляли там на несколько часов, чтобы бактерии могли вызвать иммунный ответ пациентов ( 21 , 22 ).
Это пример очень успешной терапии рака с участием активированных макрофагов при отторжении опухоли ( 22 ).
Было доказано, что терапия БЦЖ очень эффективна, и сегодня ее продолжают использовать при неинвазивном раке мочевого пузыря ( 4 , 6 ).
Это также терапевтическое подтверждение первоначальных принципов Коли.
Бактериальные инфекции были не единственным объектом внимания исследователей, работающих над потенциальными триггерами иммунного ответа против опухолей. После открытия вируса на рубеже девятнадцатого века интерес сосредоточился на вирусных заболеваниях. Первая спонтанная ремиссия опухоли была зарегистрирована американским врачом Джорджем Доком в 1896 году после того, как у женщины, больной лейкемией, наступила ремиссия рака после тяжелой инфекции гриппа ( 23 ).
Несмотря на это, только в начале двадцатого века вирусы и вирусные заболевания удалось связать с раком посредством научных исследований.
Следующей вехой в иммунотерапии рака стало то, что Томас и Бернет впервые предложили свою превосходную теорию иммунонадзора за раком ( 6 ).
В 1957 году они впервые предположили, что лимфоциты могут действовать как стражи, чтобы идентифицировать и, возможно, уничтожить соматические клетки, трансформированные мутациями ( 6 , 24 ).
Опять же, отсутствие данных и понимания механизмов действия опухолеспецифических антигенов, а также техническая невозможность выращивания лимфоцитов in vitro отложили дальнейший прогресс на многие годы ( 6 ).
Теория иммунного надзора вновь появилась в 1974 году , когда Статман показал, что у голых мышей с нарушенными функциями иммунной системы рак развивается легче, чем у штаммов дикого типа ( 25–27 ).
Примерно в то же время были идентифицированы естественные клетки-киллеры, обеспечивающие дополнительную поддержку иммунной системы человека ( 8 , 28 , 29 ).
Бернет и Томас описали свою элегантную гипотезу иммунонадзора за раком в середине двадцатого века, но только в конце двадцатого века Шрайбер, Данн, Олд и их команды доказали, что Т-клетки способны обеспечивать противоопухолевый надзор и противоопухолевые иммунные реакции ( 1, 24, 30–32 ).
За этим последовали дальнейшие открытия, включая механизмы иммуноредактирования, доказательства ухода раковых клеток и признание того, что пациенты с иммуносупрессией имеют значительно более высокий риск развития рака ( 4 , 31 , 33 ).
В 1991 году ван дер Брюгген и его коллеги идентифицировали первый опухолевый антиген человека, распознаваемый Т-лимфоцитами ( 34 ).
Позже они впервые идентифицировали реальную молекулярную мишень путем клонирования гена, кодирующего антиген меланомы (MAGE), гена, кодирующего антиген, распознаваемый цитотоксическими Т-клетками ( 34 ).
Терапия на основе антител
Открытие антител около 1890 года по-разному приписывают Паулю Эрлиху, Эмилю фон Берингу и Китасато Сибасабуро, и с тех пор малые белки стали хорошо зарекомендовавшими себя формами лечения широкого спектра заболеваний, включая рак ( 35 , 36 ).
Они действуют несколькими способами, например, предотвращая прикрепление антигена к его рецептору на поверхности клетки или маркируя антиген, подлежащий разрушению ( 21 ).
Обычно используются моноклональные антитела: «моно» означает, что они представляют собой антитела одного типа, нацеленные на конкретный антиген, а «клональные» подразумевают, что их количество умножается в тысячи раз для получения терапевтической, клинически эффективной дозы ( 21 ).
Принцип действия антител заключается в прикреплении к клеточным антигенам и маркировке раковой клетки, подлежащей уничтожению специализированными клетками иммунной системы ( 21 ).
Некоторые антитела действуют, посылая сигнал иммунной системе и побуждая ее продолжить атаку, тогда как другие антитела могут прерывать передачу сигналов, которые сообщают раковым клеткам расти, делиться и распространяться ( 21 ).
Мильштейн и Кёлер стали пионерами производства моноклональных антител в лаборатории в 1970-х годах ( 6 ).
Они использовали так называемые «гибридомы», клеточные линии, секретирующие антитела, полученные путем слияния лимфоцитов и клеточных линий миеломы ( 6 , 37 ).
Исследования в области терапии на основе антител получили широкое распространение в последующие десятилетия и в конечном итоге привели к разработке ритуксимаба, моноклонального антитела, которое связывается с белком CD20, присутствующим на поверхности незрелых В-клеток ( 6 ).
В 1997 году Ритуксимаб стал первым моноклональным антителом, одобренным FDA для лечения рака, неходжкинской лимфомы ( 6 , 38 ).
Препарат нацелен на незрелые B-клетки для уничтожения NK-клетками ( 6 , 38 ).
Еще одна важная молекула, о которой стоит упомянуть, — это 4-1BB (CD137), обнаруженная в конце 80-х годов на поверхности активированных клеток, поэтому первоначально названная молекулой «индуцированной активации лимфоцитов» (ILA) у людей ( 39 ).
Будучи членом суперсемейства рецепторов фактора некроза опухоли, этот гликопротеин связывается со своим лигандом (4-1BBL, также известным как CD137L), экспрессируемым на нескольких типах клеток, включая антигенпрезентирующие клетки, активированные В-клетки, макрофаги и некоторые опухолевые клетки. 39 , 40 ).
Наблюдения, сделанные Мелеро и др. в 1997 году предположили значительную роль этой молекулы в усилении иммунного ответа, опосредованного Т-клетками, а дальнейшие эксперименты с использованием моноклональных антител не только показали его мощную роль в противораковой терапии, но также подтвердили доказательства иммунного ответа, опосредованного Т-клетками, как такой ( 39 – 41 ).
Дальнейшие исследования подтвердили терапевтический потенциал воздействия на путь, включающий молекулу 4-1BB, при лечении рака, что привело к проведению многих текущих клинических испытаний ( 39 ).
Было бы неправильно не упомянуть трастузумаб (Герцептин), хорошо известное моноклональное антитело, которое прикрепляется к антигену фактора роста, присутствующему на определенных типах клеток рака молочной железы, останавливая рост и деление этих клеток и неизбежно приводя к их гибели (21) .
Некоторые моноклональные антитела называются «конъюгированными антителами», поскольку они прикреплены к другому химическому или радиоактивному агенту ( 21 ).
Эта химическая модификация помогает локализовать раковые клетки и/или уничтожить их.
Наиболее многообещающими антителами, которые в настоящее время тестируются в исследованиях рака, являются ингибиторы контрольных точек, причем несколько препаратов уже одобрены FDA для лечения более чем девяти типов рака ( 42 ).
В 1982 году Джеймс Эллисон и его коллеги использовали моноклональные антитела для первой биохимической идентификации и описания опухолеспецифического антигена на мышиной модели Т-клеточной лимфомы ( 43 ).
Всего год спустя они идентифицировали первый рецептор Т-клеточного антигена ( 44 ).
Эра иммунотерапии возродилась, на этот раз успешно. В 2000 году было начато первое клиническое исследование ипилимумаба, положившее начало лавине подобных исследований, которые продолжаются и по сей день. Идея блокады иммунных контрольных точек сегодня изменила всю область и спасла тысячи жизней ( 42 ).
В качестве доказательства успеха этого целевого подхода FDA одобрило по одному препарату для каждой опухоли, обладающей определенным генетическим составом, что является шагом вперед по сравнению с традиционными подходами к терапевтической классификации рака, обусловленного тканевым происхождением ( 42 ).
Первая молекула иммунного контрольного пункта была обнаружена в 1987 году и названа Брюне и его командой цитотоксическим Т-лимфоцитарным антигеном номер 4 (CTLA-4) ( 45 ).
Однако функция этой молекулы оставалась неоднозначной до 1995 г., когда Джим Эллисон и др. определили его как важнейшую молекулу иммунного контрольного пункта с большим потенциалом в качестве будущей мишени противораковой терапии ( 46 , 47 ).
Первое антитело, блокирующее CTLA-4, было немедленно разработано и протестировано на животных год спустя, в 1996 году ( 47 ).
Первым ингибитором контрольной точки, одобренным FDA, был ипилимумаб в 2011 году для терапии распространенной меланомы ( 1 , 42 ).
Сегодня он одобрен для лечения нескольких типов рака, и наиболее многообещающим результатом является то, что более 20% пациентов, участвующих в первых клинических исследованиях ипилимумаба (до одобрения в 2011 году), все еще живы и не имеют признаков заболевания ( 4 , 42 ).
Другой ингибитор контрольной точки, ниволумаб, появился в 2014 году и стал первым ингибитором молекулы PD-1, одобренным FDA ( 42 ).
В 2014 году ниволумаб стал первым ингибитором PD-1, получившим одобрение регулирующих органов для лечения меланомы в Японии ( 6 ).
В следующие 4 года во всем мире были одобрены несколько других ингибиторов рецептора PD-1 или его лигандов, PD-L1 и PD-L2, включая пембролизумаб, атезолизумаб, дурвалумаб и авелумаб, продемонстрировав значительное улучшение при некоторых типах рака ( 42 ).
Атезолизумаб, ранее известный как MPDL3280A, является еще одним ингибитором контрольной точки белка PD-L1, одобренным с 2016 года для лечения меланомы, рака легких, рака мочевого пузыря, а также для лечения тройного негативного рака молочной железы с марта 2019 года ( 6 , 48 – 50 ).
Известно, что все вышеперечисленные молекулы иммунных контрольных точек, включая антиген 4 цитотоксических Т-лимфоцитов (CTLA-4) или запрограммированную клеточную смерть-1 (PD-1) и его лиганды (PD-L1 и PD-L2), экспрессируются на опухолевых клетках. инфильтрирующие лимфоциты (TIL), а также некоторые опухолевые клетки ( 6 ).
При экспрессии на месте опухоли они позволяют раковым клеткам уклоняться от иммунных реакций, поэтому блокирование иммунных контрольных точек стало решающим прорывом в лечении рака ( 6 ).
Ожидается, что при предшествующем традиционном лечении только около 4% пациентов, принявших участие в клинических испытаниях вышеупомянутых препаратов, сегодня будут живы. Благодаря полученным антителам этот процент намного выше: на сегодняшний день выживают от 16 до 30% (а в некоторых отчетах и до 50%) пациентов с меланомой и раком легких ( 4 , 42 ).
ИЛ-2, интерфероны и другие цитокины
Цитокины — это небольшие белки, которые естественным образом вырабатываются и секретируются несколькими клетками иммунной системы. Они играют решающую роль в передаче сигналов между иммунными клетками, а также между иммунными клетками и некоторыми другими типами клеток в организме ( 21 ).
Первым открытым цитокином был интерферон альфа, также известный как тип I, описанный в 1957 году Айзексом и Линденманном ( 10 ).
IL-2, фактор роста Т-клеток интерлейкин 2, был идентифицирован в 1976 году ( 51 ) и впервые позволил исследователям культивировать Т-лимфоциты in vitro ( 6 ).
IL-2 был клонирован в 1983 году и сразу же был использован в клинических испытаниях, что привело к многообещающим результатам, включая уменьшение опухоли ( 52–54 ) .
Он оказался эффективным при введении в больших количествах пациентам с метастатическим раком за счет усиления выработки лимфоцитов Т. Поэтому его обычно называют «иммуностимулирующим цитокином») ( 4 , 6 , 55 ).
FDA США одобрило использование интерлейкина-2 в качестве иммунотерапевтического средства в 1991 году для лечения метастатического рака почки и в 1998 году для метастатической меланомы ( 6 , 56 ).
Лечение, снижающее иммуносупрессию
Иммунотерапия рака меняет парадигмы лечения рака, но уровень ответа на некоторые существующие виды лечения остается низким. Это, по крайней мере частично, можно объяснить отсутствием у хозяина уже существующего противоопухолевого иммунитета ( 57 , 58 ).
Более того, одним из отличительных признаков рака является избегание потенциальной атаки иммунной системы, выход из-под иммунного контроля и оставаться невидимым для иммунных клеток ( 57 ).
Важно помнить, что опухоль состоит из раковых клеток, а также стромальных элементов, таких как фибробласты, кровеносные сосуды и инфильтрирующие иммунные клетки, среди прочего ( 57 ).
Все эти элементы вместе называются микроокружением опухоли (ТМЕ) и по-прежнему имеют первостепенное значение для успеха иммунотерапии ( 57 , 58 ).
Внутренние иммуносупрессивные свойства опухоли также могут ингибировать функцию эффекторных Т-клеток, особенно в областях гипоксии или повышенного уровня лактата в ТМЕ ( 57 , 59 ).
Фактически, ТМЭ сильно варьируется между людьми и самими опухолями, поэтому многие доклинические и клинические исследования нацелены на новые цели, связанные с ТМЭ, особенно на опосредованные ТМЭ иммуносупрессивные пути ( 57 , 58 , 60 ).
Среди этих путей наиболее тщательно исследованы: подавление MHC класса I на поверхности опухолевых клеток (во избежание обнаружения эффекторными клетками CD8+), подавление молекул FAS и/или TRAIL (во избежание обнаружения опухолевыми клетками). уничтожение), а также воздействие на важные ферменты (такие как фермент индоламин-2,3-диоксигеназа, IDO) или несколько цитокинов, таких как VEGF, TGFβ или IL-10 ( 57 , 61 , 62 ).
Также продолжаются исследования, изучающие терапевтические подходы, нацеленные на иммунные медиаторы (такие как легумаин), цитохромы (например , CYP450) или предлагающие использование нанотехнологий для устранения существующего подавляющего влияния ТМЭ ( 63-65 ).
Большинство препаратов, используемых при химиотерапии рака, обладают иммуносупрессивным эффектом ( 66 , 67 ).
Более того, почти 50 лет назад было замечено, что у некоторых пациентов появляются новые опухоли в разных местах, в то время как их исходное новообразование лечилось ( 66 ).
Более того, у пациентов с иммуносупрессией наблюдается повышенная заболеваемость раком, что, по крайней мере частично, было связано с действием Treg в 1995 году ( 57 , 68 ).
Из всех клеток, инфильтрирующих опухоль, регуляторные Т-клетки (Tregs) играют решающую роль в сдерживании иммунного разрушения, способствуя иммуносупрессии несколькими способами, особенно секрецией иммуносупрессивных цитокинов ( 57 , 68 , 69 ).
Другие клетки, присутствующие в TME, такие как миелоидные супрессорные клетки (MDSC), опухолеассоциированные макрофаги (TAM) и тучные клетки, обычно активируются в TME, не позволяя иммунной системе уничтожать опухолевые клетки ( 64 , 67 , 69 ).
Наконец, присутствие опухолеассоциированных макрофагов, особенно типа М2, внутри ТМЭ связано с плохим прогнозом ( 57 , 70 ).
Будучи наиболее распространенными клетками, проникающими в опухоли человека, они способны подавлять иммунные реакции ( 70 ).
Поэтому недавно было изобретено несколько методов лечения, нацеленных на инфильтрирующие опухоль макрофаги, например, уменьшение количества макрофагов с помощью антител против колониестимулирующего фактора 1 ( 71 ).
Вакцины против рака
Вероятно, не существует медицинской инновации, которая оказала бы более существенное влияние на медицину и глобальное здравоохранение, чем изобретение и разработка вакцин.
Точно так же, как наша иммунная система постоянно работает над предотвращением инфекций, защищая нас от потенциально вредных бактерий, вирусов и паразитов, иммунная система также играет ключевую роль в профилактике рака ( 21 ).
Усилить эту функцию можно либо предотвращая инфекцию, либо «обучая» клетки иммунной системы распознавать и уничтожать раковые клетки, как только они возникают в организме.
Несколько одобренных FDA вакцин для профилактики рака использовались в течение последних двух десятилетий. К ним относятся вакцина против гепатита B (HBV) и вакцина против вируса папилломы человека (ВПЧ), которые предотвращают заражение вирусами, вызывающими рак ( 21 , 72 ).
Влияние вирусного канцерогенеза становится все более очевидным, и профилактика посредством вакцинации является наиболее важным и эффективным способом снижения заболеваемости раком.
Помимо профилактической роли вакцин, таких как вакцины против ВПЧ и ВГВ, также продолжаются интенсивные исследования вакцин, нацеленных на существующий рак, что является целью иммуногенетиков и иммуноонкологов рака в течение длительного времени. Возможно, терапевтическую противораковую вакцину можно было бы использовать для лечения уже возникшего рака?
Хорошо известно, что некоторые раковые клетки могут уклоняться от иммунных клеток или даже подавлять их активность и оставаться незамеченными в организме в течение многих лет ( 22 ).
Многие типы раковых клеток могут экспрессировать на своей поверхности специфические лиганды иммуносупрессивных белков контрольных точек, тем самым предотвращая атаку иммунной системы на растущую опухоль ( 22 ).
Позже они начинают беспрепятственно делиться и распространяться, что приводит к повреждению тканей, образованию опухоли и, в конечном итоге, к смерти ( 21 , 73 ).
Существует два основных типа терапевтических противораковых вакцин: аутологичные и аллогенные противораковые вакцины ( 21 ).
Первый тип — это персонализированная противораковая вакцина, изготовленная из собственных клеток пациента, основанных либо на раковых клетках, либо на клетках иммунной системы. Клетки берутся у человека, обрабатываются и размножаются в лаборатории, а затем повторно вводятся в кровоток пациента. Обработанные клетки распознают раковые клетки и запускают иммунный ответ против рака ( 21 ).
Этот тип лечения будет использоваться вместе с другими методами лечения рака, такими как хирургическое вмешательство или лучевая терапия, чтобы уничтожить следовые количества персистирующих раковых клеток. В идеале некоторые клетки памяти должны оставаться в организме пациента с обещанием, что они могут немедленно отреагировать, если раковые клетки появятся снова ( 21 ).
В начале 1990-х годов исследователи впервые клонировали специфический антиген, полученный из меланомы, чтобы вызвать иммунный ответ, запуская цитотоксические Т-клетки ( 6 , 34 , 74 ).
Однако только в 2010 году FDA одобрило самую первую аутологичную противораковую вакцину, известную как сипулейцел-Т, для лечения резистентного к кастрации рака простаты ( 6 , 21 , 75 ).
Эта дендритная клеточная вакцина, по-видимому, увеличивала общую выживаемость пациентов во время клинических испытаний, но, к сожалению, в клинических условиях не оказала влияния на прогрессирование заболевания ( 6 , 75 ).
Другие аутологичные противораковые вакцины изучаются во многих лабораториях по всему миру, включая исследователей из Пенсильванского университета, которые тестируют экспериментальную вакцину против рака молочной железы ( 21 , 76 ).
Широко признано, что семейство онкогенов HER-2/neu (ErbB) играет важную роль в росте, развитии и метастазировании нескольких типов опухолей, включая рак яичников и молочной железы ( 77 ).
Было обнаружено, что HER-2/neu (ErbB) экспрессируется на очень ранних стадиях развития рака молочной железы, и экспрессия этого гена была связана со значительно повышенным риском рецидива рака после лечения ( 77 ).
Есть надежда, что ответ анти-HER-2, обеспечиваемый обработанными в лаборатории иммунными клетками Th1, может быть успешно восстановлен с помощью противораковой вакцины ( 77 ).
Второй тип противораковых вакцин — аллогенные вакцины — основан на клетках, выращенных в лаборатории; чужие клетки ( 21 ). Этот тип вакцины сложнее разработать, но он более привлекателен, поскольку его производство потенциально дешевле ( 42 , 78 ).
Цель состоит в том, чтобы активировать иммунную систему, а не атаковать конкретную раковую клетку, поэтому эта форма лечения имеет потенциал против любого типа рака. ( 42 ).
Несмотря на значительные исследовательские усилия, ни один из них не оказался достаточно эффективным для одобрения FDA ( 21 , 78 ).
Одно из самых первых и наиболее многообещающих клинических испытаний включало электрослияние аллогенных дендритных клеток с аутологичными раковыми клетками пациента из метастатической карциномы почки IV стадии ( 79 ).
Исследование остается на стадии клинических испытаний I и II, несмотря на более чем десятилетие интенсивных исследований.
Все вышеупомянутые противораковые вакцины основаны на цельных клетках, но также был достигнут некоторый успех в разработке противораковых вакцин из компонентов раковых клеток, таких как белки или ДНК ( 21 ).
Эти частицы можно вводить отдельно или в сочетании со специализированными носителями, такими как вирусы, плазмиды или специальные наночастицы ( 4 , 21 ).
Терапевтически их можно использовать отдельно или в качестве дополнения, например, к иммуностимулирующим молекулам ( 21 ).
В настоящее время проводится множество клинических испытаний этого типа вакцины, целью которых является меланома, рак молочной железы и рак простаты ( 21 ).
Также на раннем этапе были достигнуты успехи в клинических испытаниях вакцин с участием нескольких канцер-специфичных неоантигенов, которые обеспечивают высокую специфичность для пациентов ( 80 , 81 ).
Неоантигены — это антигены, кодируемые мутировавшими генами и присутствующие на поверхности опухоли, поэтому в течение нескольких лет они широко изучаются из-за их основополагающей роли в иммунотерапии рака ( 81 , 82 ).
В результате опухолеспецифических соматических мутаций неоантигены не присутствуют на поверхности нормальных клеток ткани ( 82 , 83 ).
Обладая высокой иммуногенностью, они могут активировать иммунный ответ CD4+ и CD8+, обеспечивая идеальную мишень для иммунотерапии рака на основе Т-клеток ( 81 ).
Несколько доклинических исследований уже показали осуществимость и эффективность противораковых вакцин, нацеленных на неоантигены, на мышиных моделях опухолей, например карциномы толстой кишки, меланомы, глиомы и саркомы ( 84 ).
Хотя все еще находятся на очень ранних стадиях, подходы, сочетающие терапию на основе неоантигенов с другими типами иммунотерапии, такими как ингибиторы контрольных точек, а также традиционными методами лечения, уже применяются ( 83 , 84 ).
CAR T-клетки и адоптивная клеточная терапия (ACT)
Эта форма лечения рака является недавним прорывом, хотя первые попытки датируются Берлином 1902 года, когда Блюменталь и Э. фон Лейден попытались вакцинировать своих пациентов против рака, используя опухолевые ткани, полученные от самих пациентов ( 8 , 85 ).
В качестве вакцины они использовали суспензию аутологичных опухолевых клеток и вводили ее нескольким пациентам с поздней стадией рака ( 85 ).
Было отмечено некоторое субъективное улучшение, но без значительного уменьшения опухоли ( 85 ).
Адоптивная клеточная терапия (ACT) включает в себя выделение Т-клеток пациента (в последнее время также называемых NK-клетками), которые являются опухолеспецифичными, модификацию и размножение этих клеток в лаборатории, а затем реинъекцию обратно в кровоток пациента ( 4 , 86 ).
Существует множество различных способов модификации клеток, но одним из наиболее успешных является терапия CAR Т-клетками, которую иногда называют разновидностью ACT. О первом использовании генно-инженерных Т-клеток, полученных и модифицированных таким образом, для воздействия на раковые клетки было сообщено в 1989 году ( 87 , 88 ).
Т-клетки с химерным антигеном (CAR T-клетки) были впервые описаны в середине 1990-х годов, но не прошли доклинические исследования или ранние клинические испытания из-за технических сложностей и пробелов в знаниях, которые были устранены лишь несколько лет спустя ( 89 ).
Терапия CAR Т-клетками имела огромный успех, хотя и не обошлась без проблем, поскольку у нескольких пациентов развился цитокиновый шторм, потенциально смертельный побочный эффект, если его не лечить ( 1 , 4 ).
Тем не менее, рецидив острого В-клеточного лимфобластного лейкоза у детей был первым заболеванием, одобренным FDA для терапии CAR Т-клетками (2017 г.), а в 2018 г. последовало одобрение для диффузной крупноклеточной В-клеточной лимфомы и некоторых других типов лимфомы (2017 г.). 4 , 90–93 ) .
Онколитические вирусы
Онколитическая вирусная терапия — это революционно новый класс методов лечения рака, который сложно однозначно классифицировать. Они находятся между иммунотерапией и биологической терапией рака и используют существующие биологические агенты для лечения рака. Генетически модифицированные вирусы лишены своей первоначальной вирулентности, но они все еще способны проникать и лизировать раковые клетки ( 4 ).
Разрывающиеся, умирающие раковые клетки выделяют множество молекул, которые еще больше привлекают клетки иммунной системы, усугубляя иммунную атаку и общий воспалительный потенциал участка ( 4 , 22 ).
Первый онколитический вирус, T-VEC, был одобрен FDA в 2015 году для лечения метастатической меланомы ( 4 ). T-VEC — это вирус простого герпеса 1, генетически модифицированный таким образом, что он может экспрессировать гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), мощный цитокин, который привлекает многие типы иммунных клеток ( 4 , 22 ).
Инъекции проводятся непосредственно в очаг опухоли, особенно в области метастазов и в те области, которые невозможно удалить хирургическим путем. Другими онколитическим вирусами, показавшими многообещающие результаты в клинических испытаниях, являются Pexa-Vec (против гепатоцеллюлярной карциномы), CG0070 (против рака мочевого пузыря) и G47Δ (против глиобластомы и рака простаты) и другие ( 86 ).
Несмотря на успешные результаты, существует по крайней мере один важный недостаток использования онколитических вирусов: это приобретенный иммунитет, специфичный против используемого вируса. Это может эффективно сорвать любую повторную терапию у того же пациента, если ее использовать снова ( 86 ).
Будущие тенденции
Одна из наиболее важных проблем в понимании иммуноонкологической терапии возникает из-за сложных взаимодействий между иммунной системой пациента и биологией рака. Несмотря ни на что, раковые клетки представляют собой популяции клеток, и все популяции подвержены воздействию эволюционных сил. В настоящее время существует множество новых тенденций в иммуноонкологии, наиболее перспективными из которых являются ингибиторы контрольных точек, химерные антигенные Т-клетки (CAR T-клетки) и адоптивная Т-клеточная терапия (ACT) ( 6 ).
Метод редактирования генов CRISPR/Cas9 используется для разработки CAR Т-клеток с 2017 года ( 4 , 8 , 94 , 95 ).
В конце 2018 года произошел еще один прорыв: прямое перепрограммирование мышей и фибробластов человека в клетки иммунной системы, в частности, в антигенпрезентирующие дендритные клетки, что открыло новую линию терапевтических возможностей ( 96 ).
Наша иммунная система обладает удивительной способностью запоминать болезнетворные антигены, поэтому иммунотерапия обещает уникальную возможность успешно лечить рак и достигать длительной ремиссии.
По оценкам, каждая раковая клетка имеет более 11 000 отличий геномных мутаций от здоровых клеток вокруг опухоли ( 97 ).
Некоторые из них приводят к экспрессии опухолеассоциированных антигенов на поверхности клеток и, таким образом, становятся потенциальной мишенью для новых методов лечения на основе антител. С другой стороны, известно, что некоторые опухоли теряют экспрессию MHC класса I, что остается серьезной проблемой для иммунотерапии ( 86 , 98 , 99 ).
Более того, известно, что все микроокружение опухоли влияет на рост, развитие рака и опосредует потенциальное лечение, включая микробиом ( 100 , 101 ).
Несколько предварительных испытаний трансплантации фекальной микробиоты (ТФМ) уже были проведены с многообещающими результатами ( 101 , 102 ).
Идентификация соответствующих биомаркеров является ключевой частью процесса. Для ингибиторов иммунных контрольных точек уровень экспрессии генов CTLA-4, PD-1 или PD-L1 измеряется перед введением препарата, хотя сообщается о хороших результатах при низком уровне экспрессии ( 42 ).
Также хорошо известно, что опухоли с большей общей мутационной нагрузкой в основном реагируют на терапию ингибиторами контрольных точек ( 42 ).
Более того, известно, что рак с микросателлитной нестабильностью в результате дефицита репарации ошибочного спаривания демонстрирует особенно сильный ответ на блокаду PD-1, независимо от типа рака ( 42 ).
Одна из наиболее важных задач науки — выяснить, почему некоторые пациенты так хорошо реагируют на иммунотерапию, тогда как другие вообще не чувствительны к этой форме лечения. Более того, считается, что у некоторых пациентов после лечения иммунотерапией развивается гиперпрогрессия рака, и причина этого редкого ответа остается неизвестной ( 103 ).
Иммунотерапия в онкологии показала многообещающие результаты у многих пациентов, но приобретенная резистентность также может стать настоящей проблемой. Потенциальные механизмы рецидива включают снижение регуляции презентации опухолевого антигена, поэтому Т-клетки больше не распознают опухолевые клетки, потерю функции Т-клеток хозяина и возможное развитие вариантов ускользающей мутации в раковых клетках-мишенях ( 104 ).
Клинические исследования и поиск новых фармацевтических препаратов опережают наши текущие знания в области передовой иммунотерапии и иммуноонкологии. Если необходимо открыть новые, более эффективные методы лечения рака и улучшить существующие, необходимо срочно расширить финансирование и поддержку фундаментальных научных исследований сложного и увлекательного взаимодействия между иммунной системой и раковыми клетками.
Вклад автора
PD и TD внесли свой вклад в разработку и проведение исследования, а также в написание рукописи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны Войцеху Гурскому за любезную помощь в подготовке рисунка для рукописи, а также доктору Алану Маклинтику за его исправления и предложения в области английского языка.
Рекомендации
- Декер В.К., да Силва Р.Ф., Санабриа М.Х., Анджело Л.С., Гимарайнш Ф., Берт Б.М. и др. Иммунотерапия рака: историческая перспектива клинической революции и новые доклинические модели на животных . Фронт Иммунол. (2017) 8 :829. 10.3389/fimmu.2017.00829 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ломбард М., Пасторет П.П., Мулен А.М. Краткая история вакцин и вакцинации . Преподобный Sci Tech. (2007) 26 :29–48. 10.20506/rst.26.1.1724 [ PubMed] [ CrossRef ] [ Академия Google ]
- Донг Х., Маркович С.Н. Основы иммунотерапии рака (Нью-Йорк, Нью-Йорк: Springer;) (2018). [ Google Scholar]
- Ойсет С.Дж., Азиз М.С. Иммунотерапия рака: краткий обзор истории, возможностей и предстоящих задач . J Лечение метастазов рака. (2017) 3 :250 10.20517/2394-4722.2017.41 [ CrossRef] [ Google Scholar ]
- Институт Пастера, Франция, Вирусы и рак человека . Онлайн-курс (2019). [ Google Scholar]
- Таргетная онкология. Краткая история иммунотерапии . (2014). Доступно онлайн по адресу: https://www.targetedonc.com/publications/special-reports/2014/immunotherapy-issue3/a-brief-history-of-immunotherapy(по состоянию на 8 февраля 2019 г.).
- Маккарти Э.Ф. Токсины Уильяма Б. Коли и лечение сарком костей и мягких тканей . Айова Ортоп. Дж.(2006) 26 : 154–8. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
- Что такое биотехнология? Иммунотерапия: Хронология ключевых событий. (2019). Доступно онлайн по адресу: http://www.whatisbiotechnology.org/index.php/timeline/science/immunotherapy(по состоянию на 29 апреля 2019 г.).
- Декер В.К., Сафдар А. Биоиммуноадъюванты для лечения неопластических и инфекционных заболеваний: новый взгляд на наследие Коли . Cytok Growth Factor Rev.(2009) 20 : 271–81. 10.1016/j.cytogfr.2009.07.004 [ PubMed ] [ CrossRef ] [ Академия Google ]
- Айзекс А., Линденманн Дж. Вирусное вмешательство. I. Интерферон. Proc R Soc Lond Ser B Biol Sci. (1957) 147 :258–67. 10.1098/rspb.1957.0048 [ PubMed ] [ CrossRef ] [ Академия Google ]
- Миллер Дж.Ф., Митчелл Г.Ф., Вайс Н.С. Клеточная основа иммунологических дефектов у мышей, подвергшихся тимэктомии. Природа. (1967) 214 :992–7. 10.1038/214992a0 [ PubMed ] [ CrossRef ] [ Академия Google ]
- Штейнман Р.М., Кон З.А. Идентификация нового типа клеток в периферических лимфоидных органах мышей: I. Морфология, количественный анализ, распределение в тканях . J Exp Med. (1973) 137 :1142–62. 10.1084/jem.137.5.1142 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Академия Google ]
- Кисслинг Р., Кляйн Э., Вигцелл Х. Естественные клетки-киллеры у мышей. I. Цитотоксические клетки, специфичные к клеткам лейкемии Молони мышей. Специфичность и распространение по генотипу . Эур Дж Иммунол. (1975) 5 : 112–7. 10.1002/eji.1830050208 [ PubMed] [ CrossRef ] [ Академия Google ]
- Кисслинг Р., Кляйн Э., Просс Х., Вигцелл Х. Естественные клетки-киллеры у мышей. II. Цитотоксические клетки, специфичные к клеткам лейкемии Молони мышей. Характеристики клетки-киллера . Эур Дж Иммунол. (1975) 5 : 117–21. 10.1002/eji.1830050209 [ PubMed] [ CrossRef ] [ Академия Google ]
- Павлетич С.З., Армитидж Дж.О. Трансплантация костного мозга при раке: обзор . Онколог. (1996) 1 :159–168. [ PubMed] [ Академия Google ]
- Маленький СиСи. Возможное менделевское объяснение типа наследования, по-видимому, неменделевского по своей природе . Наука. (1914) 40 :904–6. 10.1126/science.40.1042.904 [ PubMed] [ CrossRef ] [ Академия Google ]
- Старый ЖЖ. Иммунология рака . Sci Am.(1977) 236 :62–79. [ PubMed ] [ Академия Google ]
- Мерфи Дж.Б., Мортон Дж.Дж. Лимфоцит как фактор естественной и индуцированной устойчивости к трансплантированному раку . Proc Natl Acad Sci США. (1915) 1 :435–7. 10.1073/pnas.1.7.435 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Моралес А., Эйдингер Д., Брюс А.В. Внутриполостная палочка Кальметта-Герена в лечении поверхностных опухолей мочевого пузыря . Дж Урол. (1976) 116 :180–3. 10.1016/S0022-5347(17)58737-6 [ PubMed] [ CrossRef ] [ Академия Google ]
- Олд Л.Дж., Кларк Д.А., Бенасерраф Б. Влияние инфекции Bacillus Calmette-Guérin на трансплантированные опухоли у мышей . Природа. (1957) 184 :291–2. 10.1038/184291a0 [ PubMed] [ CrossRef ] [ Академия Google ]
- История вакцин. Вакцины против рака и иммунотерапия . (2018). Доступно онлайн по адресу: https://www.historyofvaccines.org/content/articles/cancer-vaccines-and-immunotherapy(по состоянию на 22 апреля 2019 г.).
- Сомпайрак Л. Как работает иммунная система (Эймс, Айова: Уайли Блэквелл;) (2016). [ Google Scholar]
- Ларсон С., Оронски Б., Шичински Дж., Фангер Г.Р., Стирн М., Оронски А. и др. Становление вирусным: обзор селективных по репликации онколитических аденовирусов . Онкотаргет. (2015) 6 :19976–89. 10.18632/oncotarget.5116 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Академия Google ]
- Данн Г.П., Брюс А.Т., Икеда Х., Олд Л.Дж., Шрайбер Р.Д. Иммуноредактирование рака: от иммунонадзора к бегству опухоли . Нат. Иммунол. (2002) 3 :991–8. 10.1038/ni1102-991 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Статман О. Развитие опухоли после 3-метилхолантрена у иммунологически дефицитных бестимусных голых мышей . Наука. (1974) 183 :534–6. 10.1126/science.183.4124.534 [ PubMed] [ CrossRef ] [ Академия Google ]
- Статман О. Замедленное появление опухоли и отсутствие регрессии у голых мышей, инфицированных вирусом мышиной саркомы . Природа. (1979) 253 :142–4. 10.1038/253142a0 [ PubMed] [ CrossRef ] [ Академия Google ]
- Статман О. Химический канцерогенез у голых мышей: сравнение голых мышей от гомозиготных и гетерозиготных спариваний и влияние возраста и дозы канцерогена . J Национальный онкологический институт. (1979) 62 :353–8. [ PubMed] [ Академия Google ]
- Маларканнан С. Естественные клетки-киллеры: развитие, созревание и клиническое использование . Фронт Иммунол. (2018) 9 :1869. 10.3389/fimmu.2018.01869 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Просс Х.Ф., Джондал М. Цитотоксические лимфоциты нормальных доноров. Функциональный маркер не-Т-лимфоцитов человека . Клин Эксп Иммунол. (1975) 21 : 226–35. [ Бесплатная статья о PMC] [ PubMed ] [ Google Scholar ]
- Шанкаран В., Икеда Х., Брюс А.Т., Уайт Дж.М., Суонсон П.Е., Олд Л.Дж. и др.. IFNγ и лимфоциты предотвращают развитие первичной опухоли и формируют иммуногенность опухоли . Природа. (2001) 410 :1107–11. 10.1038/35074122 [ PubMed] [ CrossRef ] [ Академия Google ]
- Данн Г.П., Олд Л.Дж., Шрайбер Р.Д. Три Э иммуноредактирования рака . Анну Рев Иммунол. (2004) 22 :329–60. 10.1146/annurev.immunol.22.012703.104803 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Бернет ФМ. Понятие иммунологического надзора . Prog Exp Tumor Res. (1970) 13 :1–27. 10.1159/000386035 [ PubMed] [ CrossRef ] [ Академия Google ]
- Шрайбер Р.Д., Олд Л.Дж., Смит М.Дж. Иммуноредактирование рака: интеграция роли иммунитета в подавлении и развитии рака . Наука. (2011) 331 :1565–70. 10.1126/science.1203486 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Ван дер Брюгген П., Траверсари С., Хомес П., Луркин С., Де Планен Е., Ван ден Эйнде Б. и др. Ген, кодирующий антиген, распознаваемый цитолитическими Т-лимфоцитами меланомы человека . Наука. (1991) 254 :1643–7. 10.1126/science.1840703 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Линденманн Дж. Происхождение терминов «антитело» и «антиген» . Сканд Дж Иммунол. (1984) 19 :281–5. 10.1111/j.1365-3083.1984.tb00931.x [ PubMed] [ CrossRef ] [ Академия Google ]
- Винау Ф, Вестфаль О, Винау Р. Пауль Эрлих — в поисках волшебной пули . Микробы заражают. (2004) 6 :786–9. 10.1016/j.micinf.2004.04.003 [ PubMed] [ CrossRef ] [ Академия Google ]
- Мильштейн К. Гибридомная революция: ответвление фундаментальных исследований . Биоэссе. (1999) 21 :966–973. [ PubMed] [ Академия Google ]
- Рудница Д., Ошмиана А., Финч Д.К., Стрикланд И., Шофилд Д.Д., Лоу Д.С. и др. Ритуксимаб вызывает поляризацию В-клеток, что усиливает его терапевтическую функцию в отношении NK-клеточно-зависимой клеточной цитотоксичности . Кровь. (2019) 121 :4694–703. 10.1182/blood-2013-02-482570 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Винай Д.С., Квон Б.С. 4-1BB (CD137), индуцибельный костимулирующий рецептор, как специфическая мишень для терапии рака . Представитель BMB(2014) 47 : 122–9. 10.5483/BMBRep.2014.47.3.283 [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Мелеро И., Шуфорд В.В., Ньюби С.А., Аруффо А., Ледбеттер Дж.А., Хеллстрем К.Э. и др. Моноклональные антитела против молекулы активации Т-клеток 4-1BB уничтожают уже сформировавшиеся опухоли . Нат Мед. (1997) 3 :682–5. 10.1038/nm0697-682 [ PubMed] [ CrossRef ] [ Академия Google ]
- Винай Д.С., Квон Б.С. Иммунотерапия рака с помощью 4-1BB . Мол Рак Тер. (2012) 11 : 1062–70. 10.1158/1535-7163.MCT-11-0677 [ PubMed] [ CrossRef ] [ Академия Google ]
- ASCO ASCO Daily News: История иммунотерапии солидных опухолей (2018). [ Google Scholar]
- Эллисон Дж.П., Макинтайр Б.В., Блох Д. Опухолеспецифичный антиген мышиной Т-лимфомы, определенный с помощью моноклональных антител. Дж Иммунол . (1982) 129 :2293–300. [ PubMed] [ Академия Google ]
- Капплер Дж., Кубо Р., Хаскинс К., Ханнум С., Маррак П., Голубь М. и др.. Основной антигенный рецептор, ограниченный комплексом гистосовместимости, на Т-клетках у мышей и человека: идентификация постоянных и вариабельных пептидов . Клетка. (1983) 35 : 295–302. 10.1016/0092-8674(83)90232-5 [ PubMed] [ CrossRef ] [ Академия Google ]
- Брюне Ж.Ф., Денизо Ф., Лучани М.Ф., Ру-Доссето М., Сюзан М., Маттей М.Г. и др.. Новый член суперсемейства иммуноглобулинов — CTLA-4 . Природа. (1987) 328 :267–70. 10.1038/328267a0 [ PubMed] [ CrossRef ] [ Академия Google ]
- Краммель М.Ф., Эллисон Дж.П. CD28 и CTLA-4 оказывают противоположные эффекты на ответ Т-клеток на стимуляцию . J Exp Med. (1995) 182 :459–65. 10.1084/jem.182.2.459 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Лич Д.Р., Краммель М.Ф., Эллисон Дж.П. Повышение противоопухолевого иммунитета путем блокады CTLA-4 . Наука. (1996) 271 :1734–6. 10.1126/science.271.5256.1734 [ PubMed] [ CrossRef ] [ Академия Google ]
- Паулс Т., Фогельзанг Н.Дж., Файн Г.Д., Эдер Дж.П., Брайтех Ф.С., Лориот Ю. и др. Ингибирование PD-L1 с помощью MPDL3280A и клиническая активность у пациентов с метастатическим уротелиальным раком мочевого пузыря (UBC) . Дж. Клин Онкол. (2014) 32 :5011 10.1200/jco.2014.32.15_suppl.5011 [ CrossRef] [ Google Scholar ]
- Хербст Р.С., Майкл С. Исследование MPDL3280A, сконструированного антитела PD-L1 у пациентов с местно-распространенными или метастатическими опухолями . Дж. Клин Онкол. (2013) 31 :3000–3000. 10.1200/jco.2013.31.15_suppl.3000 [ CrossRef] [ Академия Google ]
- Бегли С. Рош впервые в США одобрила иммунотерапию рака молочной железы . Статньюс (2019). Доступно онлайн по адресу: https://www.statnews.com/2019/03/08/roche-tecentriq-first-breast-cancer-immunotherapy/(по состоянию на 16 апреля 2019 г.).
- Морган Д.А., Рускетти Ф.В., Галло Р. Селективный рост Т-лимфоцитов in vitroиз нормального костного мозга человека . Наука. (1976) 193 :1007–8. 10.1126/science.181845 [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Танигучи Т., Мацуи Х., Фудзита Т., Такаока С., Касима Н., Ёсимото Р. и др.. Структура и экспрессия клонированной кДНК человеческого интерлейкина-2 . Природа. (1983) 302 :305–10. 10.1038/302305a0 [ PubMed] [ CrossRef ] [ Академия Google ]
- Розенберг С.А., Гримм Э.А., МакГроган М., Дойл М., Кавасаки Э., Котс К. и др.. Биологическая активность рекомбинантного человеческого интерлейкина-2, продуцируемого в Escherichia coli . Наука. (1984) 223 :1412–4. 10.1126/science.6367046 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Розенберг С.А. ИЛ-2: первая эффективная иммунотерапия рака человека . Дж Иммунол. (2014) 192 :5451–8. 10.4049/jimmunol.1490019 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Розенберг С.А., Лотце М.Т., Муул Л.М., Лейтман С., Чанг А.Е., Эттингхаузен С.Е. и др.. Наблюдения за системным введением аутологичных лимфокин-активированных клеток-киллеров и рекомбинантного интерлейкина-2 пациентам с метастатическим раком . N Engl J Med. (1985) 313 :1485–92. 10.1056/NEJM198512053132327 [ PubMed] [ CrosRef ] [ Академия Google ]
- Розенберг С.А., Паккард Б.С., Эберсолд П.М., Соломон Д., Топалян С.Л., Той С.Т. и др.. Использование инфильтрирующих опухоль лимфоцитов и интерлейкина-2 в иммунотерапии пациентов с метастатической меланомой . N Engl J Med. (1988) 319 :1676–80. 10.1056/NEJM198812223192527 [ PubMed] [ CrossRef ] [ Академия Google ]
- Тормоен Г.В., Криттенден М.Р., Гоф М.Дж. Роль иммуносупрессивного микроокружения в иммунотерапии . Адв Радиат Онкол. (2018) 3 :520–6. 10.1016/j.adro.2018.08.018 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Цзоу В. Иммуносупрессивные сети в опухолевой среде и их терапевтическое значение . Нат Преподобный Рак. (2005) 5 : 263–74. 10.1038/nrc1586 [ PubMed] [ CrossRef ] [ Академия Google ]
- Фишер К., Хоффманн П., Фёлкль С., Мейденбауэр Н., Аммер Дж., Эдингер М. и др.. Ингибирующее действие молочной кислоты, полученной из опухолевых клеток, на Т-клетки человека . Кровь. (2007) 109 :3812–9. 10.1182/blood-2006-07-035972 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Вондерхайде Р.Х. Иммунная революция: аргумент в пользу прайминга, а не контрольной точки . Раковая клетка. (2018) 33 :563–9. 10.1016/j.ccell.2018.03.008 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Стейнбринк К., Граулич Э., Кубш С., Кноп Дж., Энк А.Х. Анергические Т-клетки CD4+ и CD8+, индуцированные обработанными интерлейкином-10 дендритными клетками человека, проявляют антигенспецифическую супрессорную активность . Кровь. (2002) 99 : 2468–76. 10.1182/blood.V99.7.2468 [ PubMed] [ CrossRef ] [ Академия Google ]
- Равишанкар Б., Лю Х., Шинде Р., Чандлер П., Бабан Б., Танака М. и др. Толерантность к апоптотическим клеткам регулируется индоламин-2,3-диоксигеназой . Proc Natl Acad Sci США. (2012) 109 :3909–14. 10.1073/pnas.1117736109 [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Чунг Ф.Ф., Май К.В., Нг П.И., Леонг Ко. Цитохром P450 2W1 (CYP2W1) при колоректальном раке . Цели Curr по лечению рака. (2015) 16 :71–8. 10.2174/1568009616888151112095948 [ PubMed] [ CrossRef ] [ Академия Google ]
- Лоой К.К., Чунг ФФ-Л, Леонг К.О., Вонг С.Ф., Росли Р., Май К.В. Терапевтические проблемы и современные иммуномодулирующие стратегии воздействия на микроокружение иммуносупрессивной опухоли поджелудочной железы . J Exp Clin Cancer Res. (2019) 38 :162. 10.1186/s13046-019-1153-8 [ бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Май К.В., Чунг Ф.Ф., Леонг К.О. Нацеливание на легумаин как новую терапевтическую стратегию при раке. Цели Curr по борьбе с наркотиками . (2017) 18 : 1259–68. 10.2174/1389450117666161216125344 [ PubMed ] [ CrossRef ] [ Академия Google ]
- Пенн И. Иммуносупрессия и рак: значение в хирургии головы и шеи . Арка Отоларингол. Хирургия головы и шеи. (1975) 101 :667–70. 10.1001/archotol.1975.00780400025007 [ PubMed] [ CrossRef ] [ Академия Google ]
- Благосклонный М.В. Иммунодепрессанты в профилактике и терапии рака . Онкоиммунология. (2013) 2 :e26961. 10.4161/onci.26961 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Сакагути С., Сакагути Н., Асано М., Ито М., Тода М. Иммунологическая самотолерантность поддерживается активированными Т-клетками, экспрессирующими альфа-цепи рецептора IL-2 (CD25). Нарушение единого механизма аутотолерантности вызывает различные аутоиммунные заболевания . Дж Иммунол. (1995) 155 :1151–64. [ PubMed] [ Академия Google ]
- Гирелли С., Хагеманн Т. Нацеливание на иммуносупрессию для лечения рака . Джей Клин Инвест. (2013) 123 :2355–57. 10.1172/JCI69999 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Chen JJ, Lin YC, Yao PL, Yuan A, Chen HY, Shun CT и др.. Макрофаги, ассоциированные с опухолью: палка о двух концах в прогрессировании рака . Дж. Клин Онкол. (2005) 23 :953–64. 10.1200/JCO.2005.12.172 [ PubMed] [ CrossRef ] [ Академия Google ]
- Сюй Дж., Эскамилла Дж., Мок С., Дэвид Дж., Прайсман С., Вест Б. и др.. Блокада передачи сигналов CSF1R останавливает инфильтрирующие опухоль миелоидные клетки и повышает эффективность лучевой терапии при раке простаты . Рак Рез. (2013) 73 :2782–94. 10.1158/0008-5472.CAN-12-3981 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Академия Google ]
- АСКО. Что такое вакцины против рака? Рак.Нет. (2018). Доступно онлайн по адресу: https://www.cancer.net/navigating-cancer-care/how-cancer-treated/immunotherapy-and-vaccines/what-are-cancer-vaccines(по состоянию на 22 апреля 2019 г.).
- Хоскинг Р. Рак и иммунная система . Клетка. (2012) 149 :5–7. 10.1016/j.cell.2012.03.007 [ CrossRef] [ Академия Google ]
- Финн О.Дж. Иммунология опухолей человека на молекулярном уровне . Дж Иммунол. (2007) 178 :2615–6. 10.4049/jimmunol.178.5.2615 [ PubMed] [ CrossRef ] [ Академия Google ]
- Кантофф П.В., Хигано К.С., Шор Н.Д., Бергер Э.Р., Смолл Э.Дж., Пенсон Д.Ф. и др. Иммунотерапия сипулейцел-Т при кастрированно-резистентном раке простаты . N Engl J Med. (2010) 363 : 411–22. 10.1056/NEJMoa1001294 [ PubMed] [ CrossRef ] [ Академия Google ]
- Шарма А., Колдовский У., Сюй С., Мик Р., Роузс Р., Фитцпатрик Э. и др. Импульсная дендритно-клеточная вакцина HER-2 может устранить экспрессию HER-2 и воздействовать на протоковую карциному in situ . Рак. (2012) 118 :4354–62. 10.1002/cncr.26734 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Носера Н.Ф., Ли М.К., Де Ла Круз Л.М., Роземблит С., Чернецкий Б.Дж. Восстановление утраченного иммунитета против Th1 к HER-2 при раке молочной железы: решающая роль цитокинов Th1 в терапии и профилактике . Фронт Фармакол. (2016) 7 :356. 10.3389/fphar.2016.00356 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- де Грюйл Т.Д., ван ден Эртвег А.Дж., Пинедо Х.М., Шепер Р.Дж. Цельноклеточная вакцинация против рака: от аутологичных к аллогенным вакцинам на основе опухолевых и дендритных клеток . Рак Иммунол Иммунотер. (2008) 57 :1569–77. 10.1007/s00262-008-0536-z [ бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Авиган Д.Э., Васир Б., Джордж Дж., О.К., Аткинс М.Б., МакДермотт Д.Ф. и др. Исследование фазы I/II вакцинации электрослитыми аллогенными дендритными клетками/аутологичными опухолевыми клетками у пациентов с почечно-клеточной карциномой IV стадии. . Дж Иммунотер. (2007) 30 :749–61. 10.1097/CJI.0b013e3180de4ce8 [ PubMed] [ CrosRef ] [ Академия Google ]
- Кайзер Дж. Персонализированные противоопухолевые вакцины держат рак под контролем . Наука. (2017) 356 :122. 10.1126/science.356.6334.122 [ PubMed] [ CrossRef ] [ Академия Google ]
- Пэн М., Мо Ю, Ван Ю, Ву П, Чжан Ю, Сюн Ф и др. Неоантигенная вакцина: новая иммунотерапия опухолей . Мол Рак. (2019) 18 :128. 10.1186/s12943-019-1055-6 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Лу Ю.К., Роббинс П.Ф. Иммунотерапия рака, нацеленная на неоантигены . Семин Иммунол. (2016) 28 :22–7. 10.1016/j.smim.2015.11.002 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Касл Дж.К., Удуман М., Пабла С., Штейн Р.Б., Бьюэлл Дж.С. Мутационные неоантигены для иммунотерапии рака . Фронт Иммунол. (2019) 10 :1856. 10.3389/fimmu.2019.01856 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Цзян Т., Ши Т., Чжан Х., Ху Дж., Сун Ю., Вэй Дж. и др.. Опухолевые неоантигены: от фундаментальных исследований к клиническому применению . Дж Гематол Онкол. (2019) 12:93 . 10.1186/s13045-019-0787-5 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Вагенер Д.Д. История онкологии . (Бон Стафлеу ван Логум;) (2009). [ Google Scholar]
- Фам Т., Рот С., Конг Дж., Герра Г., Нарасимхан В., Перейра Л. и др.. Обновленная информация об иммунотерапии солидных опухолей: обзор . Энн Сург Онкол. (2018) 25 :3404–12. 10.1245/s10434-018-6658-4 [ PubMed] [ CrossRef ] [ Академия Google ]
- Гросс Г., Вакс Т., Эшхар З. Экспрессия химерных молекул иммуноглобулина-Т-клеточного рецептора в качестве функциональных рецепторов со специфичностью типа антитела . Proc Natl Acad Sci США. (1989) 86 :10024–8. 10.1073/pnas.86.24.10024 [ бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Эшхар З. Подход T-Body: перенаправление Т-клеток со специфичностью антител . (2008) 181 :329–42. 10.1007/978-3-540-73259-4_14 [ PubMed] [ CrossRef ] [ Академия Google ]
- Эшхар З., Вакс Т., Гросс Г., Шиндлер Д.Г. Специфическая активация и нацеливание на цитотоксические лимфоциты посредством химерных одиночных цепей, состоящих из антителосвязывающих доменов и гамма- или дзета-субъединиц иммуноглобулина и рецепторов Т-клеток . Proc Natl Acad Sci США. (1993) 90 :720–4. 10.1073/pnas.90.2.720 [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Т-клеточная терапия NIH CAR одобрена для лечения некоторых детей и молодых людей с лейкемией . (2017). Доступно онлайн по адресу: https://www.cancer.gov/news-events/cancer-currents-blog/2017/tisagenlecleucel-fda-childhood-leukemia(по состоянию на 29 апреля 2019 г.).
- NIH FDA одобрило вторую терапию CAR T-клетками для лечения лимфомы . (2018). Доступно онлайн по адресу: https://www.cancer.gov/news-events/cancer-currents-blog/2018/tisagenlecleucel-fda-lymphoma(по состоянию на 29 апреля 2019 г.).
- С одобрением FDA для лечения лимфомы на поздних стадиях НИЗ , вторая терапия CAR T-клетками переносится в клинику . (2018). Доступно онлайн по адресу: https://www.cancer.gov/news-events/cancer-currents-blog/2017/yescarta-fda-lymphoma(по состоянию на 29 апреля 2019 г.).
- Одобрение FDA приносит первую генную терапию в Соединенные Штаты . (2017). Доступно онлайн по адресу: https://www.fda.gov/news-events/press-announcements/fda-approval-brings-first-gene-therapy-united-states(по состоянию на 10 декабря 2019 г.).
- Молланури Х., Шахраки Х., Рахмати Й., Теймурян С. CRISPR/Cas9 и CAR-T-клетка, сотрудничество двух революционных технологий в иммунотерапии рака, инструкция по успешному лечению рака . Хум Иммунол. (2018) 79 :876–82. 10.1016/j.humimm.2018.09.007 [ PubMed] [ CrossRef ] [ Академия Google ]
- Салас-Мки Дж., Конг В., Глэдни В.Л., Ядловски Дж.К., Плеса Г., Дэвис М.М. и др. Редактирование генома на основе CRISPR/Cas9 в эпоху иммунотерапии CAR T-клеток . Хум Вакцина Иммунотер. (2019) 15 :1126–32. 10.1080/21645515.2019.1571893 [ Бесплатная статья PMC] [ PubMed ] [ CrosRef ] [ Академия Google ]
- Роза Ф.Ф., Пирес К.Ф., Курочкин И., Феррейра А.Г., Гомес А.М., Пальма Л.Г. и др.. Прямое репрограммирование фибробластов в антигенпредставляющие дендритные клетки . Научный Иммунол. (2018) 3 :eaau4292. 10.1126/sciimmunol.aau4292 [ PubMed] [ CrossRef ] [ Google Scholar ]
- Столер Д.Л., Чен Н., Басик М., Каленберг М.С., Родригес-Бигас М.А., Петрелли Н.Дж. и др. Начало и степень геномной нестабильности при спорадическом прогрессировании колоректальной опухоли . Proc Natl Acad Sci США. (1999) 96 :15121–6. 10.1073/pnas.96.26.15121 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Гарридо Ф., Кабрера Т., Апциаури Н. «Твердые» и «мягкие» поражения, лежащие в основе изменений HLA класса I в раковых клетках: значение для иммунотерапии . Инт Джей Рак. (2010) 127 : 249–256. 10.1002/ijc.25270 [ PubMed] [ CrossRef ] [ Академия Google ]
- Гарридо Ф., Апциаури Н., Дордуин Э.М., Гарсиа Лора А.М., ван Холл Т. Острая необходимость восстановления MHC класса I при раке для эффективной иммунотерапии . Курр Опин Иммунол. (2016) 39 : 44–51. 10.1016/j.coi.2015.12.007 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Гопалакришнан В., Спенсер К.Н., Нези Л., Рубен А., Эндрюс М.К., Карпинец Т.В. и др. Микробиом кишечника модулирует ответ на иммунотерапию анти-PD-1 у пациентов с меланомой . Наука. (2018) 359 : 97–103. 10.1126/science.aan4236 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Гопалакришнан В., Хелминк Б.А., Спенсер К.Н., Рубен А., Варго Дж.А. Влияние микробиома кишечника на рак, иммунитет и иммунотерапию рака . Раковая клетка. (2018) 33 :570–80. 10.1016/j.ccell.2018.03.015 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Ван Ю, Весноски Д.Х., Хелминк Б.А., Гопалакришнан В., Чой К., Дюпон Х.Л. и др.. Трансплантация фекальной микробиоты при рефрактерном колите, связанном с ингибитором контрольной точки иммунного ответа . Нат Мед. (2018) 24 :1804–8. 10.1038/s41591-018-0238-9 [ бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Google Scholar ]
- Феррара Р., Мескита Л., Тексье М., Ламар Дж., Одижье-Валетт С., Тессонье Л. и др. Гиперпрогрессирующее заболевание у пациентов с распространенным немелкоклеточным раком легких, получающих ингибиторы PD-1/PD-L1 или монохимиотерапию . ДЖАМА Онкол. (2018) 14 :1–10. 10.1001/jamaoncol.2018.3676 [ Бесплатная статья PMC] [ PubMed ] [ CrossRef ] [ Академия Google ]
- Шарма П., Ху-Лиескован С., Варго Дж.А., Рибас А. Первичная, адаптивная и приобретенная устойчивость к иммунотерапии рака . Клетка. (2017) 168 :707–23. 10.1016/j.cell.2017.01.017 [ Бесплатная статья PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ]
