NCBI Literature Resources International Journey of cancer/ Transl Oncol. 2008 Jul; 1(2):65–72
Nobuto Yamamoto, Hirofumi Suyama, and Nobuyuki Yamamoto
Immunotherapy for Prostate Cancer with Gc Protein-Derived Macrophage-Activating Factor, GcMAF1
Иммунотерапия рака простаты с использованием фактора активации макрофагов, полученного из белка Gc, GcMAF 1
Содержание
Сывороточный белок Gc (известный как белок, связывающий витамин D3) является предшественником основного фактора активации макрофагов (MAF).
Активность предшественника MAF сывороточного белка Gc пациентов с раком простаты была потеряна или снижена, поскольку белок Gc дегликозилировался сывороточной á-N-ацетилгалактозаминидазой (нагалазой), секретируемой из раковых клеток.
Следовательно, макрофаги больных раком простаты, имеющие дегликозилированный белок Gc, не могут активироваться, что приводит к иммуносупрессии.
Поэтапная обработка очищенного белка Gc иммобилизованной β-галактозидазой и сиалидазой позволила получить самый мощный из когда-либо обнаруженных MAF (называемый GcMAF), который не оказывает никакого вредного воздействия на людей.
Макрофаги, активированные GcMAF, развивают значительное разнообразие рецепторов, которые распознают аномалии на поверхности злокачественных клеток и обладают высокой онкоцидной активностью.
Шестнадцать пациентов с раком простаты без анемии получали еженедельно 100 нг GcMAF. По мере увеличения активности предшественников MAF активность их сывороточной нагалазы снижалась.
Поскольку активность нагалазы в сыворотке пропорциональна опухолевой нагрузке, весь анализ динамики терапии GcMAF контролировали путем измерения активности нагалазы в сыворотке.
После 14–25 еженедельных введений GcMAF (100 нг/неделю) у всех 16 пациентов наблюдались очень низкие уровни нагалазы в сыворотке крови, эквивалентные уровням здорового контроля, что указывает на отсутствие опухолей у этих пациентов. Рецидивов не было в течение 7 лет.
Рак простаты является наиболее распространенным злокачественным новообразованием среди пожилых мужчин. Лечение метастатического рака гормональной терапией временно контролирует симптомы у 70–80% пациентов [ 1 ]. После периода ремиссии неизменно возникает рецидив.
После прогрессирования эффективное лечение недоступно, а медиана выживаемости составляет примерно 6 месяцев [ 2 ]. Таким образом, прогрессирующее метастатическое, резистентное к гормонам заболевание остается терапевтической проблемой. В свете механизмов, которые, как полагают, участвуют в развитии рецидивирующего заболевания, энергичные усилия сосредоточены на выявлении неэндокринных методов лечения [ 2-5 ].
Однако терапевтические подходы, способные оказывать тумороцидное воздействие на гормонорезистентные раковые клетки и улучшать качество жизни, ограничиваются определенной иммунотерапией, не вызывая побочных эффектов.
Внутриопухолевое введение бациллы Кальметта-Герена (БЦЖ) или других бактериальных клеток может привести к регрессии местных и метастазирующих опухолей, что предполагает развитие специфического иммунитета против опухолей [ 6,7 ].
Однако введение БЦЖ в нераковые нормальные ткани не оказывает существенного влияния на опухоли.
Воспаленные нераковые нормальные ткани выделяют мембранные липидные метаболиты, лизофосфатидилхолин (лизо-Pc) и другие лизофосфолипиды, которые эффективно активируют макрофаги [ 8-10 ].
Воспаленные раковые ткани также выделяют липидные метаболиты, лизоалкилфосфолипиды и алкилглицерины, поскольку мембраны раковых клеток содержат алкилфосфолипиды [ 11–13 ].
И лизоалкилфосфолипиды, и алкилглицерины являются примерно в 400 раз более мощными агентами, активирующими макрофаги, чем лизофосфолипиды, с точки зрения минимальных доз, необходимых для оптимальной активации макрофагов [ 12–16 ].
Это предполагает, что высокоактивированные макрофаги могут убивать раковые клетки, а также объясняет, почему внутриопухолевое воспаление уничтожает раковые клетки [ 14,15 ].
Активация макрофагов, вызванная воспалением, является основным процессом активации макрофагов, который требует сывороточного белка Gc (известного как витамин D3 — связывающий белок) [ 17–19 ] и участия B- и T-лимфоцитов [ 8–10,20–24 ].
Белок Gc несет один трисахарид (Рисунок 1), состоящий из N -ацетилгалактозамина с двухразветвленной галактозой и концами сиаловой кислоты у 420 остатка треонина [ 20–24 ].
Этот олигосахарид гидролизуется индуцибельной мембранной β-галактозидазой ( Bgl i ) В-лимфоцитов, подвергнутых воспалению (или обработанных лизо-Pc), с образованием фактора, проактивирующего макрофаги.
Далее он гидролизуется мембранной сиалидазой Neu-1 Т-лимфоцитов с образованием MAF, белка с N -ацетилгалактозамином в качестве оставшегося сахара [ 20–24 ] (Рисунок 1 а).
Таким образом, белок Gc является предшественником основного MAF [ 20–24 ].
Однако активность предшественника MAF белка Gc пациента с раком простаты теряется или снижается, поскольку их сывороточный белок Gc дегликозилируется сывороточной α- N -ацетилгалактозаминидазой (нагалазой), секретируемой из раковых клеток [ 25,26 ] (25,26) (25,26 ).Рисунок 1 б).
Дегликозилированный белок Gc не может быть преобразован в MAF, что приводит к отсутствию активации макрофагов. Макрофаги являются основными фагоцитирующими и антигенпрезентирующими клетками.
Поскольку активация макрофагов для фагоцитоза и презентации антигена В- и Т-лимфоцитам является первым необходимым шагом в развитии как гуморального, так и клеточного иммунитета, отсутствие активации макрофагов приводит к иммуносупрессии [ 25-30 ].
У больных раком на поздних стадиях наблюдается высокая активность нагалазы в сыворотке, что приводит к отсутствию активации макрофагов и серьезной иммуносупрессии, что объясняет, почему больные раком умирают от подавляющей инфекции (например, пневмонии) [ 25,26 ].
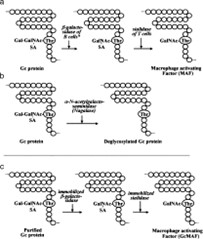
Схематическая иллюстрация образования MAF (а), дегликозилирования белка Gc (b) и поэтапной обработки белка Gc иммобилизованной β-галактозидазой и сиалидазой для получения GcMAF (c). Звездочка (*) указывает на В-клетки, подготовленные к воспалению: В-клетки можно лечить воспаленным мембранным липидным метаболитом, например, лизофосфатидилхолином.
Поэтапная обработка очищенного белка Gc иммобилизованными β-галактозидазой и сиалидазой приводит к образованию наиболее мощного MAF (называемого GcMAF) [ 20–24 ] (Рисунок 1 в), который не оказывает никаких побочных эффектов на человека [ 14,15,23,27 ].
Введение 100 нг GcMAF человеку приводит к максимальной активации макрофагов с 30-кратным увеличением индекса приема внутрь и 15-кратным увеличением способности генерировать супероксид [ 23 ] за 3,5 часа. GcMAF также обладает мощной митогенной способностью действовать на миелоидные клетки-предшественники, что приводит к 40-кратному увеличению количества системных макрофагов за 4 дня [ 23,31 ].
Такие высокоактивированные системные макрофаги хемотаксически рекрутируются в воспаленные очаги путем 180-кратного увеличения количества макрофагальных клеток [ 31 ]. Макрофаги, активированные GcMAF, развивают значительные вариации рецепторов, которые распознают аномалии на поверхности раковых клеток и убивают раковые клетки [ 14,15,32–34 ]. Все злокачественные клетки имеют мембранные аномалии на клеточной поверхности. Ряд гликолипидных, гликопротеиновых и муциновых антигенов был идентифицирован и обозначен как опухолеассоциированные антигены на клеточной поверхности широкого спектра опухолевых клеток человека [ 35 ].
Когда человеческие макрофаги обрабатывали in vitro 100 пг GcMAF/мл в течение 3 часов и добавляли линию клеток рака простаты LNCaP с соотношением эффектор/мишень 1,5, примерно 51% и 82% клеток LNCaP были убиты через 4 и 18 часов. инкубации соответственно [ 14,15 ].
Эта противоопухолевая способность макрофагов, активированных GcMAF in vitro , побудила нас исследовать терапевтическую эффективность GcMAF при раке простаты.
Терапия GcMAF как единственный метод лечения может наиболее эффективно искоренить метастатический рак молочной железы и колоректальный рак [ 34,36 ].
Хотя в последние годы простатспецифический антиген (ПСА) использовался в качестве диагностического и прогностического показателя рака предстательной железы [ 37,38 ], для терапевтической эффективности GcMAF у пациентов с раком простаты желательна более высокая точность прогностического показателя.
Поскольку активность нагалазы в сыворотке больных раком прямо пропорциональна опухолевой нагрузке [ 25,26,32,33 ], активность нагалазы в сыворотке эффективно используется в качестве диагностического показателя для различных видов рака [ 14,15,25,26,32, 33,39 ] и в качестве прогностического индекса для лучевой терапии [ 25 ], хирургической резекции опухолей [ 26 ] и терапии GcMAF для доклинических и клинических моделей аденокарциномы молочной железы [ 32–34 ] и колоректального рака [ 36 ].
Материалы и методы
Химикаты и реагенты
Фосфатно-солевой буфер (PBS) содержал 1 мМ фосфата натрия и 0,15 М NaCl. Когда моноциты периферической крови прикрепляются к субстрату сосуда, они ведут себя как макрофаги, демонстрирующие повышенный синтез гидролаз.
Для манипуляций in vitro и культивирования мононуклеарных клеток периферической крови, содержащих моноциты/макрофаги (сокращенно макрофаги) и лимфоциты (В- и Т-клетки), использовали среду RPMI-1640 с добавлением 0,1% яичного альбумина (среда EA).
Сыворотки для выделения белка Gc1 (основная изоформа Gc) были предоставлены сотрудниками института и регулярно проверялись на отсутствие вирусов с использованием тестов ELISA на наличие антител против иммунодефицита человека и вирусов гепатита B и C (Cambridge Biotechnology, Кембридж, Великобритания, и Abbott Laboratories, Эббот-Парк, Иллинойс).
Белок Gc очищали с помощью аффинной хроматографии с витамином D [ 23,40 ]. β-галактозидаза и сиалидаза были приобретены у Boehringer Mannheim Biochemicals, Индианаполис, Индиана, и иммобилизованы на сефарозе [ 21–23 ].
Лизофосфатидилхолин (лизо-Pc) и п -нитрофенил- N -ацетил-α- d -галактозаминид были приобретены у Sigma Chemical Co. (Сент-Луис, Миссури).
Процедура приготовления GcMAF
Сыворотку инактивировали нагреванием при 60°C в течение 1 часа и смешивали с 30% насыщенным сульфатом аммония, который осаждал фракцию белка Gc [ 41 ].
Осадок растворяли в PBS (рН 7,4), содержащем 0,5% Тритона Х-100 и 0,3% три-н — бутилфосфата, и оставляли на ночь при комнатной температуре для разделения липидсодержащих микробных примесей, включая оболочечные вирусы, если таковые имеются.
Образцы осаждали 30%-ным насыщенным раствором сульфата аммония, растворяли в цитратном буфере при pH 4,0 и оставляли на ночь. Белок Gc очищали с помощью 25-гидроксивитамина D3 — аффинной хроматографии [ 40 ].
Эта хроматографическая специфичность к белку Gc обеспечивает высокую чистоту белка Gc и исключает все возможные загрязнения макромолекул. Электрофоретический анализ подтвердил чистоту белка Gc (MW52 000).
Поэтапная инкубация очищенного белка Gc с иммобилизованными β-галактозидазой и сиалидазой дала, вероятно, самый мощный MAF (GcMAF), когда-либо обнаруженный [ 21–23 ] (Рисунок 1 в). Иммобилизованные ферменты удаляли центрифугированием.
Таким образом, GcMAF является чистым и не содержит примесей ферментов. Конечный продукт, GcMAF, фильтровали через фильтр с низким связыванием белков Millex-HV (Millipore Corp., Бедфорд, Массачусетс) для стерилизации.
Поскольку молекулярная структура GcMAF идентична молекулярной структуре нативного человеческого MAF (Рисунок 1, а и в ) он не должен оказывать вредного воздействия на человека. Фактически, многочисленные введения (более 10 раз в течение периода от 3 до 6 месяцев) GcMAF (100–500 нг/человек) 12 людям не показали никаких признаков побочных эффектов [ 15,23 ].
Было обнаружено, что оптимальная доза GcMAF для человека для достижения фагоцитарной способности за счет 30-кратного увеличения индекса приема внутрь и 15-кратного увеличения способности моноцитов/макрофагов периферической крови к образованию супероксида составляет примерно 100 нг/человека. Контроль качества препарата GcMAF осуществляли на предмет активности, стерильности и безопасности.
GcMAF-терапия для пациентов с раком простаты
Участники. В это исследование была включена группа из 16 пациентов с раком простаты без анемии. Хотя активность нагалазы в сыворотке пациентов после простатэктомии указывает на значительное количество метастазов опухолевых клеток, компьютерная томография не выявила метастазов опухолевых поражений в других органах. Эти пациенты получали исключительно терапию GcMAF, исключая комбинированную терапию с индукцией эритропоэза.
Таким образом, пациенты с анемичным раком простаты не имели права участвовать в программе. Исследование было одобрено институциональными исследовательскими и этическими комитетами Нагасакской группы иммунотерапии, Нагасаки, Япония, а также институциональным наблюдательным советом Хиогоской группы иммунотерапии, Хиого, Япония. Участники дали письменное информированное согласие перед включением в исследование.
Администрация GcMAF. Поскольку период полувыведения активированных макрофагов составляет примерно 6 дней [ 12,13 ], 100 нг GcMAF вводили внутримышечно один раз в неделю.
Процедуры, которые будут использоваться для клинического исследования, и параметры исследования. Образцы сыворотки (>2 мл) собирали еженедельно или раз в две недели непосредственно перед каждым введением GcMAF и использовали для прогностического анализа.
Детальную оценку ответа пациента на каждое введение GcMAF проводили путем определения как активности предшественника MAF сывороточного белка Gc, так и активности сывороточной нагалазы.
Поскольку активность нагалазы в сыворотке пропорциональна опухолевой нагрузке [ 26,32,33 ], кинетическую оценку лечебного ответа на терапию GcMAF проводили путем определения активности нагалазы в сыворотке как прогностического показателя в течение всего терапевтического курса у всех 16 пациентов.
Значения PSA также определяли непосредственно перед данным исследованием.
Анализ активности предшественника MAF сывороточного белка Gc пациента
Образцы крови здоровых людей собирали в пробирки, содержащие ЭДТА для предотвращения коагуляции.
Образец крови объемом 5 мл и 5 мл физиологического раствора (0,9% NaCl) смешивали и осторожно помещали в центрифужную пробирку емкостью 15 мл, содержащую 3 мл лимфопрепа (аналога фиколла; Polysciences, Inc, Уоррингтон, Пенсильвания), и центрифугировали при 800°С. г в течение 15 минут.
Плотную полосу лейкоцитов в виде мононуклеарных клеток периферической крови, содержащих моноциты/макрофаги (сокращенно макрофаги) и лимфоциты (В- и Т-клетки), собирали с помощью пипетки Пастера.
Смесь лейкоцитов дважды промывали PBS, суспендировали в среде EA и помещали в лунки диаметром 16 мм. Инкубация в течение 45 минут в инкубаторе с 5% CO 2 при температуре 37°C позволила прикрепить макрофаги к поверхности пластика. Смесь лимфоцитов и прикрепленных макрофагов здоровых людей обрабатывали 1 мкг лизо-Пц/мл в среде EA в течение 30 минут.
Из-за прилипания макрофагов к пластиковому субстрату лимфоциты и макрофаги отдельно промывали PBS, смешивали и культивировали в среде EA, содержащей 0,1% сыворотку больных раком простаты или здорового человека в качестве источника белка Gc.
После 3 часов культивирования макрофаги анализировали на способность генерировать супероксид [ 25,26 ].
Макрофаги промывали PBS и инкубировали в 1 мл PBS, содержащего 20 мкг цитохрома с, в течение 10 минут. Через тридцать минут после добавления форбол-12-миристата ацетата (5 мкг/мл) спектрофотометрически при 550 нм определяли способность макрофагов генерировать супероксид.
Данные выражали в наномолях супероксида, образующегося в минуту на 10 6 клеток (макрофагов). Эти значения представляют собой активность предшественника MAF белка Gc сыворотки пациента [ 28,29 ].
Утрата или снижение активности предшественника MAF белка Gc сыворотки пациента выражается в уменьшении образования супероксида по сравнению с контрольным белком Gc здорового человека.
Таким образом, активность предшественника MAF измеряет как способность каждого пациента активировать макрофаги, так и иммунный потенциал. Однако потеря активности предшественника MAF приводит к иммуносупрессии.
Культивирование смеси обработанных лизо-Pc лимфоцитов и макрофагов в среде EA без сыворотки приводит к образованию от 0,5 до 0,85 нмоль супероксида/мин на 10 6 клеток [ 41,42 ]. Таким образом, если сыворотка пациента (0,1%) генерирует <0,85 нмоль супероксида/мин на 106 клеток, активность предшественника Gc сыворотки пациента считается утраченной.
Определение активности нагалазы в кровотоке пациента
Сыворотку пациентов (300 мкл) осаждали 70% насыщенным сульфатом аммония. Осадки растворяли в 50 мМ натрий-цитратном буфере (рН 6,0) и диализовали против того же буфера при 4°С в течение 2 часов.
Диализаты доводили до объема 1 мл и анализировали на активность нагалазы [ 25,26 ]. Раствор субстрата (250 мкл) содержал 5 мкмоль п -нитрофенил- N -ацетил-α- d -галактозаминида в 50 мМ цитратном буфере (рН 6,0). Реакцию инициировали добавлением 250 мкл диализированных образцов, выдерживали при 37°С в течение 60 минут и прекращали добавлением 200 мкл 10% ТСА.
После центрифугирования реакционной смеси к надосадочной жидкости добавляли 300 мкл 0,5 М раствора Na 2 CO 3 . Количество высвободившегося п -нитрофенола определяли спектрофотометрически при 420 нм и выражали в наномолях в минуту на миллиграмм белка [ 25,26 ]. Концентрацию белка оценивали методом Брэдфорда [ 43 ].
Период полувыведения активности нагалазы in vivo составляет менее 24 часов, поскольку мы наблюдали внезапное падение активности нагалазы через 24 часа после резекции опухоли [ 26 ]. Однако активность нагалазы в собранной сыворотке чрезвычайно стабильна, вероятно, из-за присутствия ингибитора продукта, и высоко воспроизводима после хранения сыворотки при 4°C в течение более 6 месяцев [26 ] .
Здоровые контрольные сыворотки демонстрируют низкие уровни (0,35–0,65 нмоль/мин на миллиграмм) активности фермента. Это ферментативная активность α-галактозидазы, которая может катаболизировать хромогенный субстрат (т.е. п -нитрофенил -N -ацетил-α- d -галактозаминид) для нагалазы [ 25,26,28 ]. Снижение активности нагалазы в сыворотке крови до 0,65 нмоль/мин на миллиграмм или менее у пациентов во время терапии GcMAF служит демонстрацией того, что опухолевая нагрузка устранена.
Полученные результаты
История терапии и иммунодиагностические параметры больных раком предстательной железы без анемии
Терапевтический анамнез 16 пациентов с раком простаты до начала терапии GcMAF суммирован в Таблица 1. Девять пациентов получили простатэктомию с гормональной терапией или без нее. Всего 12 пациентов получали гормональную терапию. Поскольку судьба и стадия злокачественного заболевания коррелируют с опухолевой нагрузкой и степенью иммуносупрессии [ 25,26 ], иммунная активность и индекс опухолевой нагрузки для каждого пациента должны быть определены перед началом терапии GcMAF, независимо от времени, прошедшего после простатэктомии и /или гормональная терапия (Таблица 1).
Таблица 1
Терапевтический анамнез и диагностические параметры больных раком простаты.
Анализы терапии перед GcMAF на ПСА, активность предшественников (нмоль/мин на 10 6 клеток) и нагалазу (нмоль/мин на миллиграмм). Предшественническая активность <0,9 нмоль/мин на 10 6 клеток не способна развивать фагоцитарную способность макрофагов и расценивается как утрата предшественникской активности.
† Среднее значение для семи здоровых людей из контрольной группы.
‡ Этот уровень активности соответствует активности фермента α-галактозидазы, а не нагалазы.
Поскольку активация макрофагов для фагоцитоза и презентации антигена В- и Т-клеткам является первым необходимым шагом для развития иммунитета, отсутствие активации макрофагов приводит к иммуносупрессии [ 26,27 ].
Поскольку сывороточный белок Gc является предшественником основного MAF, сначала необходимо было определить активность предшественника MAF сывороточного белка Gc пациента. Как показано в Таблица 1 Активность предшественника MAF сывороточного белка Gc у пациентов с раком простаты терялась (<0,85 нмоль супероксида/мин на 10 6 клеток) или снижалась.
Потому что потеря или снижение активности предшественника MAF белка Gc пациента происходит в результате дегликозилирования белка Gc сывороточной нагалазой, секретируемой раковыми клетками [ 25,26 ] (Рисунок 1 б), была определена активность нагалазы в сыворотке этих онкологических больных. Пациенты с более низкой активностью предшественника белка Gc имели более высокую активность нагалазы в сыворотке (Таблица 1).
Поскольку активность нагалазы в сыворотке больных раком прямо пропорциональна опухолевой нагрузке [ 26,32,33 ], активность нагалазы в сыворотке указывает на общее количество первичной опухоли (если она не подверглась простатэктомии) и метастазирующих опухолевых клеток.
Таким образом, активность нагалазы в сыворотке отдельных пациентов следует использовать в качестве исходного контроля для прогностического анализа во время терапии GcMAF. Значения ПСА каждого пациента при первоначальном диагнозе, после простатэктомии и до начала терапии GcMAF также показаны на рисунке.Таблица 1.
Активность предшественника MAF белка Gc и активность нагалазы сыворотки как прогностические параметры во время терапии GcMAF у пациентов с раком простаты
В ходе терапии GcMAF анализировали активность предшественника MAF и активность нагалазы в сыворотке крови пяти пациентов.
По мере прогрессирования терапии GcMAF активность предшественника MAF у всех пяти пациентов увеличивалась, а активность нагалазы в сыворотке снижалась обратно пропорционально, как показано на рис.Таблица 2.
Чтобы проиллюстрировать количественную корреляцию этих параметров, временной ход активности предшественника MAF у отдельного пациента с раком простаты был построен в зависимости от соответствующей активности нагалазы в сыворотке.
По мере прогрессирования терапии GcMAF активность предшественника MAF увеличивалась с сопутствующим снижением активности нагалазы в сыворотке, как показано на рис.фигура 2.
Эти прогностические параметры всех пяти отдельных пациентов находятся в одной и той же линейной обратной корреляции.
Когда активность предшественника MAF увеличивалась до уровня здорового контроля, активность нагалазы в сыворотке этих пациентов снижалась до уровня здорового контроля (фигура 2).
Таким образом, эти параметры злокачественности больных раком предстательной железы служат отличным прогностическим показателем. Поскольку сывороточная нагалаза пропорциональна опухолевой нагрузке [ 26,32,33 ], по мере прогрессирования терапии GcMAF активность сывороточной нагалазы снижалась и, одновременно, уменьшалась опухолевая нагрузка.
Таким образом, весь временной анализ опухолевой нагрузки во время терапии GcMAF у всех 16 пациентов должен проводиться путем измерения активности нагалазы в сыворотке в качестве прогностического показателя. Кинетическое снижение активности нагалазы в сыворотке крови позволяет рассматривать процесс излечения злокачественного новообразования как уменьшение опухолевой нагрузки.
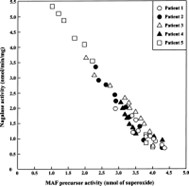
Обратная корреляция между активностью предшественника MAF сывороточного белка Gc и активностью α- N -ацетилгалактозаминидазы (Нагалазы) в сыворотке пациентов с раком простаты во время терапии GcMAF
Таблица 2
Корреляция активности предшественника MAF у отдельных пациентов с раком простаты с активностью их сывороточной нагалазы во время терапии GcMAF.
| Номер пациента. | Анализируемое время (недели) | Активность предшественника Супероксид (нмоль) | Нагалаза (нмоль/мин на миллиграмм) |
| 1 (7) * | 0 | 2,88 | 1,95 |
| 1 | 3.38 | 1,74 | |
| 2 | 3.51 | 1,59 | |
| 4 | 3,61 | 1.32 | |
| 6 | 3.44 | 1.19 | |
| 10 | 3,92 | 1.08 | |
| 12 | 4.05 | 0,96 | |
| 21 | 4.13 | 0,68 | |
| 2 (8) | 0 | 2.29 | 3,45 |
| 1 | 2.40 | 2,89 | |
| 2 | 2,62 | 2,75 | |
| 3 | 2,88 | 2.43 | |
| 4 | 2,92 | 2.21 | |
| 6 | 3.21 | 2.02 | |
| 10 | 3.33 | 1,69 | |
| 14 | 3,62 | 1,38 | |
| 17 | 3,72 | 0,94 | |
| 21 | 4.29 | 0,66 | |
| 3 (6) | 0 | 2.20 | 3,73 |
| 1 | 2.28 | 3.09 | |
| 2 | 2,75 | 2,73 | |
| 4 | 3.18 | 3.34 | |
| 8 | 3.03 | 2.18 | |
| 11 | 3.33 | 2.01 | |
| 15 | 3.50 | 1,89 | |
| 19 | 3,65 | 1,67 | |
| 23 | 3,75 | 1,29 | |
| 26 | 4.24 | 0,67 | |
| 4 (12) | 0 | 2,75 | 2,62 |
| 1 | 3.11 | 3.16 | |
| 2 | 3.16 | 2.01 | |
| 3 | 3.20 | 1,82 | |
| 9 | 3.25 | 1,71 | |
| 16 | 3.35 | 1.43 | |
| 22 | 4.23 | 0,64 | |
| 5 (13) | 0 | 1.02 | 5.34 |
| 1 | 1.22 | 5.11 | |
| 2 | 1,37 | 4,87 | |
| 3 | 1,68 | 4.31 | |
| 4 | 1,97 | 4.12 | |
| 9 | 2.22 | 3.54 | |
| 14 | 3,81 | 1.10 | |
| 18 | 3,79 | 0,83 | |
| 24 | 4.28 | 0,72 | |
| Контроль † | 4.25 | 0,52 |
* Цифры в скобках относятся к номеру пациента. вТаблица 1.
† Среднее значение пяти здоровых людей из контрольной группы.
Исследование динамики сывороточной активности нагалазы у пациентов с раком предстательной железы во время терапии GcMAF
Анализ динамики активности нагалазы в сыворотке пациентов с раком простаты позволяет оценить эффективность GcMAF. У этих пациентов начальная активность нагалазы колебалась от 1,95 до 5,34 нмоль/мин на миллиграмм.Таблица 1). Как показано в Рисунок 3
Активность нагалазы в сыворотке у всех 16 пациентов снижалась по мере прогрессирования терапии GcMAF. Примерно после 14–25 введений (14–25 недель) 100 нг GcMAF у всех 16 пациентов наблюдались очень низкие уровни активности нагалазы в сыворотке крови, эквивалентные уровням здоровых контрольных значений в диапазоне от 0,37 до 0,68 нмоль/мин на миллиграмм.
Эта низкая ферментативная активность характерна для α-галактозидазы, а не для злокачественно-специфической нагалазы [ 25,26 ]. Поскольку активность нагалазы в сыворотке пропорциональна опухолевой нагрузке, результаты позволяют предположить, что у этих пациентов нет раковых клеток.
В течение 7 лет наблюдения после завершения терапии GcMAF у этих пациентов не было выявлено повышения активности нагалазы в сыворотке, что указывает на отсутствие рецидива рака простаты. Кроме того, ежегодные компьютерные томографические исследования этих пациентов подтвердили отсутствие рецидивов опухоли в течение 7 лет.
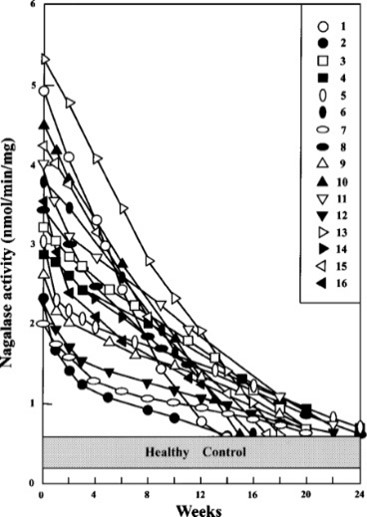
Исследование динамики терапии GcMAF у 16 пациентов с раком простаты с использованием сывороточной α- N -ацетилгалактозаминидазы (нагалазы) в качестве прогностического индекса.
Эффективность терапии GcMAF при раке простаты зависит от степени аномалии клеточной поверхности
Плохо дифференцированные (называемые недифференцированными) раковые клетки должны иметь больше аномалий клеточной поверхности, чем умеренно/непосредственно дифференцированные (сокращенно называемые дифференцированными) раковые клетки [ 34,36 ].
Поскольку активированные макрофаги эффективно распознают и быстро убивают раковые клетки, имеющие больше аномалий, активированные макрофаги убивают недифференцированные клетки быстрее, чем дифференцированные клетки [ 34,36 ].
Таким образом, быстрое снижение активности нагалазы в сыворотке во время терапии GcMAF предполагает наличие большего количества аномалий в недифференцированных клетках. Как показано в исследовании динамики терапии GcMAF вРисунок 3
Активность нагалазы в сыворотке пациентов №№ 2, 5, 7, 8, 9, 11, 12 и 16, например, резко снижались в первые несколько недель (до 4 недель), а затем медленно снижались в течение оставшегося терапевтического периода (примерно 8–14 недель). ).
Эти двухфазные графики регрессии опухоли предполагают, что недифференцированные клетки смешиваются с дифференцированными клетками внутри опухолей [ 34,36 ]. Таким образом, недифференцированные клетки быстро погибали в течение первых нескольких недель, а дифференцированные клетки погибали медленно в течение оставшегося терапевтического периода GcMAF.
Эти смешанные клеточные популяции, по-видимому, возникли в результате дифференцировки во время роста недифференцированных опухолевых клеток [ 34,36 ].
Напротив, пациент №. 1, 6, 10, 13 и 15 показали, что их активность нагалазы в сыворотке снижалась линейно и быстро достигала контрольных значений между 14 и 18 неделями.
Эти линейные, снижающиеся показатели излечения медленнее, чем показатели излечения недифференцированной популяции ранее упомянутой смешанной популяции (т.е. недифференцированного и дифференцированного) рака простаты.
Следовательно, последняя группа опухолей уже дифференцирована и дальнейшая дифференцировка этих опухолей в процессе опухолевого роста не происходила. Аналогичные результаты наблюдались также при терапии GcMAF у пациентов с метастатическим раком молочной железы [ 34 ].
Корреляция между активностью нагалазы в сыворотке и уровнями ПСА во время терапии GcMAF
Поскольку активность нагалазы в сыворотке является отличным показателем для оценки опухолевой нагрузки [ 26,32 ], уровни ПСА в сыворотке сравнивались с активностью нагалазы в сыворотке во время терапии GcMAF у пяти пациентов с раком простаты. Как показано вТаблица 3Уровни ПСА у пациентов с простатэктомией снижались по мере снижения сывороточной нагалазы во время терапии GcMAF.
Однако у пациентов без резекции опухоли, хотя активность нагалазы в сыворотке снижалась по мере прогрессирования терапии GcMAF, значения ПСА оставались неизменными.
Результат предполагает, что уровень ПСА, полученный из предстательной железы с опухолью, не изменился, в то время как опухолевая нагрузка уменьшилась. Поскольку вызванное опухолью воспаление в нераковых тканях простаты вызывает секрецию ПСА [ 38 ], ПСА, вырабатываемый этими воспаленными нераковыми тканями простаты, не может быть изменен за счет уменьшения опухолевой нагрузки.
Таблица 3
Корреляция между активностью нагалазы в сыворотке и ПСА во время исследования динамики терапии GcMAF у пациентов с раком простаты.
| Номер пациента. | Возраст (лет) | Анализ через несколько недель после первого GcMAF | Удельная активность нагалазы (нмоль/мин на миллиграмм) | ПСА (нг/мл) |
| А1 | 67 | 0 | 2.53 | 27.60 |
| 2 | 2.27 | 27.20 | ||
| 4 | 2.00 | 25.90 | ||
| 5 | 1,94 | 28.25 | ||
| 6 | 1,93 | 23,79 | ||
| 12 | 1,47 | 26,74 | ||
| 24 | 0,69 | 25.95 | ||
| А2 | 83 | 0 | 3,66 | 18.02 |
| 2 | 2,94 | 15,64 | ||
| 3 | 2,74 | 13.91 | ||
| 4 | 2,63 | 18.77 | ||
| 5 | 2,55 | 21.94 | ||
| 10 | 0,72 | 18.53 | ||
| А3 | 60 | 0 | 2.18 | 58,49 |
| 3 | 1,85 | 42,49 | ||
| 4 | 1,77 | 56,54 | ||
| 5 | 1,62 | 63,61 | ||
| 6 | 1,62 | 82.30 | ||
| 7 | 1,54 | 65,20 | ||
| 10 | 0,84 | 58,45 | ||
| А4 (простатэктомия) | 76 | 0 | 3,94 | 11.85 |
| 1 | 3.44 | 10.56 | ||
| 4 | 2,46 | 5.22 | ||
| 12 | 1,92 | 0,33 | ||
| 15 | 1,36 | 0,24 | ||
| 20 | 0,69 | 0,10 | ||
| А5 (простатэктомия) | 66 | 0 | 2.00 | 5,82 |
| 1 | 1,79 | 5.43 | ||
| 2 | 1,69 | 4.05 | ||
| 4 | 1,49 | 3.12 | ||
| 6 | 1,38 | 2,77 | ||
| 9 | 1.21 | 2,46 | ||
| 13 | 1.19 | 1,89 | ||
| 18 | 1.07 | 0,86 | ||
| 21 | 0,92 | 0,14 | ||
| 26 | 0,62 | 0,10 |
Обсуждение
Диагностике и прогнозу рака простаты способствовала доступность измерения ПСА [ 37,38 ]. Когда пациентам была проведена радикальная простатэктомия, наблюдалось внезапное падение высоких уровней ПСА до очень низких значений (Таблица 1). Таким образом, ПСА преимущественно вырабатывается из первичных опухолевых поражений предстательной железы по сравнению с метастазами. Хотя сывороточная нагалаза снижалась во время терапии GcMAF у пациентов с опухолевой предстательной железой, ПСА оставался неизменным (Таблица 3). Следовательно, значения ПСА не могут использоваться для прогностических исследований во время терапии GcMAF.
Специфический для простаты антиген, такой как сериновая протеаза, считается специфичным для злокачественных опухолей предстательной железы и одним из ферментов, разрушающих внеклеточный матрикс, который необходим для инвазивности раковых тканей [ 44,45 ].
Однако нормальная воспаленная ткань предстательной железы может выделять ПСА [ 38 ], особенно при определенных болезненных состояниях, таких как доброкачественная гипертрофия простаты и простатит.
Инвазивное ферментативное действие ракового ПСА на окружающие нераковые ткани простаты вызывает легкий воспалительный процесс, который может заставить нераковые клетки простаты выделять ПСА. Из-за преобладания продукции ПСА в тканях предстательной железы анализ ПСА не может точно оценить фракционную потерю опухолевой нагрузки. В настоящей статье это подтверждается сравнительным анализом активности нагалазы сыворотки крови с ПСА на фоне терапии GcMAF (Таблица 3).
Более того, ПСА, являющийся сериновой протеазой, может не ограничиваться простатой. Было показано, что простатспецифический антиген продуцируется экстрапростатическими тканями, включая новообразования слюнных желез, клоакогенный железистый эпителий, а также нормальные и раковые ткани женской молочной железы [ 46-48 ]. Таким образом, ПСА менее специфичен для злокачественных опухолей предстательной железы.
Напротив, нагалаза секретируется исключительно раковыми клетками, а не нормальными тканями (даже воспаленными нераковыми тканями). Таким образом, уровень активности нагалазы в кровотоке пропорционален опухолевой нагрузке у хозяев [ 25,28,29 ] и используется в качестве прогностического показателя терапии GcMAF для доклинических и клинических моделей рака [ 14,15,25, 32–34,36 ].
Сывороточная нагалаза дегликозилирует сывороточный белок Gc. Дегликозилированный белок Gc теряет свою активность предшественника MAF и не может быть преобразован в MAF, что приводит к отсутствию активации макрофагов, приводящей к иммуносупрессии [ 25,26 ]. Таким образом, измерение сывороточной активности нагалазы и активности предшественника MAF сывороточного белка Gc позволяет оценить степень иммуносупрессии и состояние заболевания.
Поскольку трисахарид белка Gc в кровотоке эффективно дегликозилируется сывороточной нагалазой [ 25–28 ] (Рисунок 1 б), сывороточная нагалаза, по-видимому, является эндо-нагалазой, но не экзоферментом в коллоидной сывороточной среде.
Когда GcMAF (100 нг) вводится онкологическим больным, на GcMAF не влияет сывороточная нагалаза пациента [ 34,36 ], он обходит дегликозилированный белок Gc и непосредственно действует на макрофаги, вызывая обширную активацию. Такие высокоактивированные макрофаги развивают значительные вариации рецепторов, распознают аномалии поверхности злокачественных клеток и уничтожают раковые клетки [ 34,36 ].
Эта фундаментальная способность макрофагов распознавать аномалии злокачественных клеток универсальна для всех типов рака. Фактически, введение GcMAF (100 нг/неделю) пациентам с раком без анемии показало лечебный эффект при различных видах рака без разбора [ 15,33,34,36 ]. К настоящему времени протестированы типы рака простаты, молочной железы, толстой кишки, желудка, печени, легких (включая мезотелиому), почек, мочевого пузыря, матки, яичников, головы/шеи, меланомы и фибросаркомы [34 ] .
Прогресс терапии GcMAF при этих видах рака контролируется путем измерения активности нагалазы, специфичной для злокачественных клеток сыворотки, которая повсеместно обнаруживается у пациентов с широким спектром видов рака [ 25,26 ].
Показатели излечения различных видов рака зависят от степени нарушения клеточной поверхности, которая соответствует степени дифференцировки злокачественных клеток. Точность измерения активности нагалазы позволила нам определить степень нарушения клеточной поверхности по скорости излечения во время терапии GcMAF. Недифференцированные опухолевые клетки уничтожаются более эффективно, чем дифференцированные клетки [ 34,36 ]. Фактически, аденокарциномы, такие как клетки рака молочной железы и простаты, недифференцированы и быстро уничтожаются активированными макрофагами, тогда как хорошо дифференцированные раковые клетки, такие как клетки плоскоклеточного рака, медленно уничтожаются активированными макрофагами.
Более быстрые показатели излечения, требующие менее 22 недель, всегда наблюдались во время терапии GcMAF при раке молочной железы [ 34 ].
Напротив, терапия GcMAF для высокодифференцированных плоскоклеточных карцином, таких как рак головы/шеи, требует более 75 недель. Таким образом, более высокая скорость излечения рака простаты обусловлена эффективным распознаванием макрофагами аномалий поверхности клеток рака простаты.
Однако различные виды рака содержат смешанную популяцию недифференцированных и дифференцированных клеток внутри опухоли (например, рак молочной железы и колоректальный рак) [ 34,36 ]. Этот тип тонкой дифференциации при раке предстательной железы известен уже много лет. В 1977 году Глисон [ 49] разделили гистологические паттерны рака предстательной железы на паттерны снижения дифференцировки от 1 до 5, при этом паттерн 1-й степени является наиболее дифференцированным, а паттерн 5-го класса — наименее дифференцированным (слабо дифференцированным или недифференцированным).
Опухолевая картина 3-й степени (3-я степень по Глисону) является наиболее распространенной гистологической картиной и считается умеренно хорошо дифференцированной.
Однако можно легко интерпретировать гистологическую картину степени 3 (схематическая диаграмма, разработанная Глисоном) как смесь дифференцированных клеток (степень 1) и наименее дифференцированных (недифференцированных) клеток (степень 5).
Это может объяснить графики двухфазной регрессии опухоли во время терапии GcMAF, поскольку в большинстве случаев рак простаты представляет собой смесь дифференцированных и недифференцированных клеток.
Благодаря доступности прецизионного измерения сывороточной нагалазы стало возможным измерение скорости излечения опухолей во время терапии GcMAF и оценка степени дифференцировки опухоли.
Таким образом, значение терапии GcMAF для лечения рака значительно возросло благодаря открытию специфичной для раковых клеток нагалазы, которая может точно отслеживать скорость регрессии опухоли во время терапии GcMAF [ 32–34,36 ].
Сноски
Это расследование было частично поддержано грантом Службы общественного здравоохранения США AI-32140 и грантом Фонда Эльзы У. Парди.
Рекомендации
- Клейн Л.А. Рак простаты. N Engl J Med. 1968 год; 300:824–833. [ PubMed ] [ Академия Google ]
- Айзенбергер М.А., Саймон Р., О’Двайер П.Дж., Виттс Р.Е., Фридман М.А. Переоценка негормональной цитотоксической химиотерапии в лечении рака предстательной железы. Дж. Клин Онкол. 1985 год; 3:827–841. [ PubMed ] [ Академия Google ]
- Maulard-Durdux C, Dufour B, Hennequin C, Chretien Y, Delaninian S, Housset M. Исследование фазы II пероральной комбинации циклофосфамида и пероральной этопозида у пациентов с гормонорефрактерной карциномой простаты. Рак. 1996 год; 77: 1144–1148. [ PubMed ] [ Академия Google ]
- Рагхаван Д. Негормональная химиотерапия рака предстательной железы: принципы лечения и применение к тестированию новых препаратов. Семин Онкол. 1988 год; 15: 371–389. [ PubMed ] [ Академия Google ]
- Таннок И.Ф. Есть ли доказательства того, что химиотерапия приносит пользу пациентам с раком простаты? Дж. Клин Онкол. 1985 год; 3: 1013–1021. [ PubMed ] [ Академия Google ]
- Мортон Д., Эйблер Ф.Р., Мальмгрен Р.А., Вуд У.К. Иммунологические факторы, влияющие на ответ на иммунотерапию при злокачественной меланоме. Операция. 1970 год; 68: 158–164. [ PubMed ] [ Академия Google ]
- Збар Б., Танака Т. Иммунотерапия рака: регрессия опухолей после внутриочаговой инъекции живой Mycobacterium bovis. Наука. 1971 год; 172 : 271–273. [ PubMed ] [ Академия Google ]
- Нгвенья Б.З., Ямамото Н. Активация перитонеальных макрофагов лизофосфатидилхолином. Биохим Биофиз Акта. 1985 год; 839:9–15. [ PubMed ] [ Академия Google ]
- Нгвенья Б.З., Ямамото Н. Влияние продуктов воспаления на иммунную систему: лизофосфатидилхолин стимулирует макрофаги. Рак Иммунол Иммунотер. 1986 год; 21: 174–182. [ PubMed ] [ Академия Google ]
- Нгвенья Б.З., Ямамото Н. Вклад неприкрепившихся клеток, обработанных лизофосфатидилхолином, в механизм активации макрофагов. Proc Soc Exp Biol Med. 1990 год; 193: 118–124. [ PubMed ] [ Академия Google ]
- Ямамото Н, Нгвенья БЗ. Активация макрофагов лизофосфолипидами и эфирными производными нейтральных липидов и фосфолипидов. Рак Рез. 1987 год; 47: 2008–2013. [ PubMed ] [ Академия Google ]
- Ямамото Н, Нгвенья Б.З., Пиринджер П.А. Активация макрофагов эфирными аналогами лизофосфолипидов. Рак Иммунол Иммунотер. 1987 год; 25: 185–192. [ PubMed ] [ Академия Google ]
- Ямамото Н., Сент-Клер Д.А., Хомма С., Нгвенья Б.З. Активация макрофагов мыши алкилглицеринами, продуктами воспаления раковых тканей. Рак Рез. 1988 год; 48: 6044–6049. [ PubMed ] [ Академия Google ]
- Ямамото Н., Уэда М. Лечение онкологических больных с помощью фактора активации макрофагов, связывающего витамин D (GcMAF), быстро уничтожает раковые клетки. Дж Иммунотер. 2006 г.; 29: 677–678. [ Google Scholar ]
- Ямамото Н., Уэда М. Иммунология, 2004 г.Болонья, Италия: Medmond Ltd; 2004. Терапевтическая эффективность фактора активации макрофагов (GcMAF), связывающего витамин D (белок Gc), при раке простаты и молочной железы; стр. 201–204. [ Google Scholar ]
- Хомма С., Ямамото Н. Процесс активации макрофагов после обработки in vitroмышиных лимфоцитов додецилглицерином. Клин Эксп Иммунол. 1990 год; 79 : 307–313. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
- Ямамото Н., Хомма С., Миллман И. Идентификация сывороточного фактора, необходимого для активации макрофагов in vitro: роль витамина D-связывающего белка (группоспецифического компонента, Gc) в лизофосфолипидной активации перитонеальных макрофагов мыши. Дж Иммунол. 1991 год; 147 : 273–280. [ PubMed ] [ Академия Google ]
- Ямамото Н., Хомма С., Хаддад Дж.Г., Ковальски М.Н. Белок, связывающий витамин D3 ,необходим для активации макрофагов in vitro после обработки додецилглицерином перитонеальных клеток мышей. Иммунология. 1991 год; 74 : 420–424. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
- Хомма С., Ямамото М., Ямамото Н. Белок, связывающий витамин D (группоспецифический компонент, Gc), является единственным сывороточным белком, необходимым для активации макрофагов после обработки клеток брюшины лизофосфатидилхолином. Иммунол Клеточная Биол. 1993 год; 71: 249–257. [ PubMed ] [ Академия Google ]
- Ямамото Н., Хомма С. Белок, связывающий витамин D 3(группоспецифический компонент, Gc), является предшественником сигнала активации макрофагов от лимфоцитов, обработанных лизофосфатидилхолином. Proc Natl Acad Sci США. 1991 год; 88 : 8539–8543. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
- Ямамото Н., Кумаширо Р. Преобразование белка, связывающего витамин D3 (группоспецифический компонент), в фактор активации макрофагов путем поэтапного действия β-галактозидазы В-клеток и сиалидазы Т-клеток. Дж Иммунол. 1993 год; 151: 2794–2802. [ PubMed ] [ Академия Google ]
- Нарапараджу В.Р., Ямамото Н. Роль β-галактозидазы В-лимфоцитов и сиалидазы Т-лимфоцитов в активации макрофагов, вызванной воспалением. Иммунол Летт. 1994 год; 43: 143–148. [ PubMed ] [ Академия Google ]
- Ямамото Н. Структурное определение мощного фактора активации макрофагов, полученного из белка, связывающего витамин D3, садъювантной активностью для производства антител. Мол Иммунол. 1996 год; 33 : 1157–1164. [ PubMed ] [ Академия Google ]
- Ямамото Н. Витамин D и иммунная система. В: Дельвес П.Дж., Ройтт И., редакторы. Энциклопедия иммунологии. 2-е изд. Лондон, Англия: Academic Press Ltd; 1998. стр. 2494–2499. [ Google Scholar]
- Ямамото Н., Нарапараджу В.Р., Асбелл С.О. Дегликозилирование сывороточного витамина D-связывающего белка и иммуносупрессия у онкологических больных. Рак Рез. 1996 год; 56: 2827–2831. [ PubMed ] [ Академия Google ]
- Ямамото Н., Нарапараджу В.Р., Ураде М. Прогностическая ценность сывороточной α- N-ацетилгалактозаминидазы и иммуносупрессия в результате дегликозилирования сывороточного белка Gc у пациентов с раком полости рта. Рак Рез. 1997 год; 57 : 295–299. [ PubMed ] [ Академия Google ]
- Ямамото Н., Уэда М. Иммунология, 2004 г.Болонья, Италия: Medmond Ltd; 2004. Искоренение ВИЧ путем лечения ВИЧ-инфицированных пациентов/пациентов со СПИДом витамин D-связывающим белком (белком Gc), полученным из фактора активации макрофагов (GcMAF), стр. 197–200. [ Google Scholar ]
- Ямамото Н., Нарапараджу В.Р., Сринивасула С.М. Структурная модификация сывороточного витамина D3 —связывающего белка и иммуносупрессия у ВИЧ-инфицированных пациентов. Ретровирусы СПИДа. 1995 год; 11 :1373–1378. [ PubMed ] [ Академия Google ]
- Ямамото Н. Патогенное значение α- N-ацетилгалактозаминидазы, обнаруженной в оболочочном гликопротеине gp160 вируса иммунодефицита человека типа 1. Ретровирусы СПИДа Res Hum. 2006 г.; 22 : 262–271. [ PubMed ] [ Академия Google ]
- Ямамото Н., Ураде М. Патогенное значение α- N-ацетилгалактозаминидазы, обнаруженной в гемагглютинине вируса гриппа. Микробы заражают. 2005 г.; 7 : 674–681. [ PubMed ] [ Академия Google ]
- Ямамото Н, Нарапараджу ВР. Структурно четко определенный фактор активации макрофагов, полученный из витамина D3 —связывающего белка, обладает мощной адъювантной активностью при иммунизации. Иммунол Клеточная Биол. 1998 год; 76 : 237–244. [ PubMed ] [ Академия Google ]
- Кога Ю., Нарапараджу В.Р., Ямамото Н. Противоопухолевые эффекты фактора активации макрофагов, связывающего витамин D 3 , на мышей с опухолью Эрлиха. Proc Soc Exp Biol Med. 1999 год; 220: 20–26. [ PubMed ] [ Академия Google ]
- Ямамото Н, Нарапараджу ВР. Иммунотерапия мышей BALB/c с асцитической опухолью Эрлиха с помощью фактора активации макрофагов, связывающего витамин D. Рак Рез. 1997 год; 57: 2187–2192. [ PubMed ] [ Академия Google ]
- Ямамото Н., Суяма Х., Ямамото Н.Ю., Ушидзима Н. Иммунотерапия пациентов с метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF), Int J Cancer. 2008 г.; 122: 461–467. [ PubMed ] [ Академия Google ]
- Чжан С., Чжан Х.С., Рейтер В.Е., Словин С.Ф., Шер Х.И., Ливингстон П.О. Экспрессия потенциальных целевых антигенов для иммунотерапии первичного и метастатического рака простаты. Клин Рак Рез. 1998 год; 4: 293–302. [ PubMed ] [ Академия Google ]
- Ямамото Н., Суяма Х., Наказато Х., Ямамото Н.Ю., Кога Ю. Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF. Рак Иммунол Иммунотер. 2008 г.; 57: 1007–1016. [ PubMed ] [ Академия Google ]
- Мерфи ГП. Вторая Стэнфордская конференция по международной стандартизации анализов ПСА. Рак. 1995 год; 75:1–7. [ PubMed ] [ Академия Google ]
- Мерфи Г.П., Баррен Р.Дж., Эриксон С.Дж., Боуз Б.В., Вулферт Р.Л., Барч Г., Клокер Х., Пойнтанер Дж., Рейсигл А., Леод Д.Г. и др. Оценка и сравнение двух новых маркеров рака простаты. Свободный простатический специфический антиген и простатический специфический мембранный антиген. Рак. 1996 год; 74:809–818. [ PubMed ] [ Академия Google ]
- Редди А.Л., Санкаранараянан К., Арулрадж Х.С., Деварадж Н., Деварадж Х. Сывороточная α- N-ацетилгалактозаминидаза связана с диагностикой/прогнозом пациентов с плоскоклеточным раком шейки матки. Рак Летт. 2000 г.; 158 : 61–64. [ PubMed ] [ Академия Google ]
- Линк Р.П., Перлман К.Л., Пирс Э.А., Шнос Х.К., ДеЛука Х.Ф. Очистка человеческого сывороточного витамина D-связывающего белка хроматографией на 25-гидроксивитамине D 3-сефарозе. Анальная биохимия. 1986 год; 157 : 262–269. [ PubMed ] [ Академия Google ]
- Ямамото Н., Уиллетт Н.П., Линдси Д.Д. Участие сывороточных белков в активации макрофагов, вызванной воспалением. Воспаление. 1994 год; 18: 311–322. [ PubMed ] [ Академия Google ]
- Ямамото Н., Кумаширо Р., Ямамото М., Уиллетт Н.П., Линдси Н.Д. Регуляция активации макрофагов, вызванной воспалением, с помощью двух сывороточных факторов: витамина D3 —связывающего белка и альбумина. Заразить иммунитет. 1993 год; 61 : 5388–5391. [ Бесплатная статья о PMC ] [ PubMed ] [ Google Scholar ]
- Брэдфорд ММ. Быстрый и чувствительный метод количественного определения микрограммов белка, использующий принцип связывания белка с красителем. Анальная биохимия. 1976 год; 72: 248–254. [ PubMed ] [ Академия Google ]
- Миньятти П, Рифкин ДБ. Биология и биохимия протеиназ при опухолевой инвазии. Физиол Ред.1993; 73 : 161–195. [ PubMed ] [ Академия Google ]
- Остерлинг Дж.Э. Специфический антиген простаты: критическая оценка наиболее полезного опухолевого маркера аденокарциномы простаты. Дж Урол. 1991 год; 145:907–923. [ PubMed ] [ Академия Google ]
- Камошида С., Цуцуми Ю. Внепростатическая локализация кислой фосфатазы простаты и простатспецифического антигена: распределение в клоакогенном железистом эпителии и зависимая от пола экспрессия в анальной железе человека. Хум Патол. 1990 год; 21: 1108–1111. [ PubMed ] [ Академия Google ]
- Ван Крикен Т.Х. Иммунореактивность маркера простаты при новообразованиях слюнных желез. Редкая ошибка в иммуногистохимии. Am J Surg Pathol. 1993 год; 17: 410–414. [ PubMed ] [ Академия Google ]
- Ю Х., Гиай М., Диамандис Э.П., Катсарос Д., Сазерленд Д.Дж.А., Левеск М.А., Роанья Р., Понцоне Р., Сисмонди П. Специфический антиген простаты является новым благоприятным прогностическим показателем для женщин с раком молочной железы. Рак Рез. 1995 год; 55: 2104–2110. [ PubMed ] [ Академия Google ]
- Глисон Д.Ф. Кооперативная урологическая исследовательская группа Администрации ветеранов: гистологическая классификация и клиническая стадия рака простаты. В: Танненбаум М, редактор. Урологическая патология: Простата. Филадельфия, Пенсильвания: Леа и Фебигер; 1977. стр. 171–198. [ Google Scholar ]
