PLOS is a nonprofit Published: October 18, 2010
Kalvin J. Gregory ,Bing Zhao ,Diane R. Bielenberg,Sami Dridi,Jason Wu,Weihua Jiang,Bin Huang,Steven Pirie-Shepherd,Michael Fannon
Vitamin D Binding Protein-Macrophage Activating Factor Directly Inhibits Proliferation, Migration, and uPAR Expression of Prostate Cancer Cells
Фактор активации белка-макрофагов, связывающий витамин D, непосредственно ингибирует пролиферацию, миграцию и экспрессию uPAR клеток рака простаты
Содержание
Фактор активации белка-макрофагов, связывающий витамин D, непосредственно ингибирует пролиферацию, миграцию и экспрессию uPAR клеток рака простаты
Фон
Витамин D-связывающий белок-фактор активации макрофагов (DBP-maf) является мощным ингибитором роста опухоли. Однако его активность объясняется косвенными механизмами, такими как усиление иммунного ответа за счет активации макрофагов и ингибирование роста кровеносных сосудов, необходимых для роста опухолей.
Методы и результаты
В этом исследовании мы впервые показываем, что DBP-maf оказывает прямое и мощное воздействие на клетки опухоли простаты в отсутствие макрофагов. DBP-maf продемонстрировал ингибирующую активность в исследованиях пролиферации линий клеток рака простаты LNCaP и PC3, а также метастатических клонов этих клеток. Исследования проточной цитометрии с аннексином V и йодидом пропидия показали, что эта ингибирующая активность не связана с апоптозом или гибелью клеток. DBP-maf также обладал способностью ингибировать миграцию клеток рака простаты in vitro . Наконец, было показано, что DBP-maf вызывает снижение экспрессии рецептора урокиназного активатора плазминогена (uPAR) в опухолевых клетках простаты. Есть данные, что активация этого рецептора коррелирует с метастазированием опухоли.
Выводы
Эти исследования показывают сильную ингибирующую активность DBP-maf в отношении опухолевых клеток предстательной железы независимо от его активации макрофагов.
Цифры
Цитирование: Грегори К.Дж., Чжао Б., Биленберг Д.Р., Дриди С., Ву Дж., Цзян В. и др. (2010)Фактор активации белка-макрофагов, связывающий витамин D, напрямую ингибирует пролиферацию, миграцию и экспрессию uPAR в клетках рака простаты. PLoS ONE 5(10): e13428. https://doi.org/10.1371/journal.pone.0013428
Редактор: Джозеф Наджбауэр, Национальный медицинский центр «Город надежды», США
Поступила: 21 января 2010 г.; Принято: 10 сентября 2010 г.; Опубликовано: 18 октября 2010 г.
Авторские права: © 2010 Грегори и др. Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания первоначального автора и источника.
Финансирование: Эта работа была поддержана грантом Министерства обороны (DOD) PC030286 и грантом «Исследование по предотвращению слепоты». Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Белок, связывающий витамин D (DBP), является основным переносчиком витамина D в кровотоке. Он имеет молекулярную массу 52–59 кДа и обнаруживается в кровотоке на уровне 300–600 мкг/мл [1] , [2] .
DBP является исходной молекулой DBP-maf [3] . DBP-maf является продуктом селективного дегликозилирования DBP и, как было показано, является мощной антиангиогенной и противоопухолевой молекулой [4] – [6] .
Ранее мы продемонстрировали на модели ксенотрансплантата на мышах, что DBP-maf является мощным ингибитором опухолей поджелудочной железы человека и что его способность ингибировать рост опухоли in vivo частично обусловлена его антиангиогенными свойствами [4] .
В этом исследовании было показано, что ДАД-маф обладает антиангиогенным действием, основанным на уменьшении сосудов в хориоаллантоисной мембране цыпленка и уменьшении плотности микрососудов в опухолях. В других исследованиях было высказано предположение, что его первичные противоопухолевые механизмы являются иммунологическими из-за активации макрофагов. Недавние клинические исследования Ямамото и др. показали мощную противоопухолевую активность, а также активность против ВИЧ [7] – [10] .
Эту активность измеряли как функцию снижения уровня фермента α-N-ацетилгалактозаминидазы (нагалазы) в сыворотке крови. Дегликозилирование DBP нагалазой предотвращает его активацию макрофагов и, следовательно, подавляет иммунный ответ [11] .
Основной механизм, предложенный во всех случаях, в основном заключается в активации макрофагов и последующих иммунных реакциях. Было высказано предположение, что при ВИЧ дефектная презентация антигена является фактором иммунодефицита [12] .
Наличие повышенного уровня нагалазы в плазме пациентов с ВИЧ позволяет предположить, что у этих пациентов может быть ингибирована активация макрофагов [13].
Кроме того, было показано, что нагалаза является внутренним компонентом белка оболочки, способствующим слиянию для инициации инфекции [11].
Установлено также повышение концентрации нагалазы в плазме у больных системной красной волчанкой. При волчанке аутоантитела образуют патогенные иммунные комплексы и откладываются в тканях. Клиренс этих комплексов макрофагами ингибируется, если активация макрофагов нарушена [14].
Было показано, что раковые клетки продуцируют нагалазу [15] , а повышенные концентрации в сыворотке были зарегистрированы у ряда онкологических больных, страдающих меланомой [16] , простатой, колоректальным раком и метастатическим раком молочной железы [7] – [9].
Полного понимания активности DBP-maf еще предстоит достичь, но его потенциал в качестве антиангиогенной и иммуногенной терапии ясен.
В этом исследовании использовались четыре линии клеток рака простаты, чтобы включить; линии, чувствительные к андрогенам (LNCaP) и нечувствительные (PC3M), а также линии с высокой степенью метастатического поражения (LNCaPLN3 и PC3MLN4), полученные из каждой родительской линии соответственно.
О способности ДАД-маф оказывать прямое воздействие на опухолевые клетки не сообщалось. В этом исследовании изучалась роль DBP-maf в прямом ингибировании таких активностей, как пролиферация, миграция и экспрессия uPAR, которые связаны с ростом опухоли и метастазированием.
Материалы и методы
Синтез ДАД-маф
(а) Приготовление гранул (1-3)β-D-галактозидаза-агарозы.
Приготовление шариков осуществляли с использованием модификации метода Ямамото и др. [17] . Гранулы, активированные бромцианом (0,5 г), промывали 1 мМ HCl (3 раза, 10 мл на промывку), используя фильтрацию с отсасыванием.
Затем гранулы промывали водой DDI и ресуспендировали в 2 мл буфера для связывания (0,1 М NaHCO 3 , 0,5 М NaCl, pH 8,3). (1-3)β-D-галактозидазу (1000 единиц) добавляли к гранулам/буферу для связывания и затем встряхивали с помощью вертикального и нижнего миксера в течение 2 часов при комнатной температуре. Затем гранулы промывали связывающим буфером и ресуспендировали в блокирующем буфере (сочетающий буфер плюс 0,2 М глицин).
Суспензию встряхивали в течение ночи при 4°С. Затем гранулы промывали связывающим буфером, а затем 0,1 М ацетатом натрия, 0,5 М NaCl, pH 4,0, и промывки повторяли в общей сложности четыре раза. Гранулы промывали последней промывкой буфером для связывания, затем центрифугировали и ресуспендировали в 1,0 М NaCl.
(б) Определение активности (1-3)β-D-галактозидазы-агарозы.
Определение активности шариков проводили с использованием модификации метода Ямамото и др. [17] . Чтобы определить активность гранул (1-3)β-D-галактозидаза-агароза, 50 мкл суспензии гранул добавляли к 0,95 мл аналитического буфера/хромогенного субстрата (PBS, 3 мМ 2-нитрофенил-β- D-галактопиранозид, 10 мМ MgCl 2 , 0,1 мМ β-меркаптоэтанол) и суспензию встряхивали при комнатной температуре в течение 15 мин. Реакцию останавливали добавлением 33 мкл 1 М карбоната натрия и измеряли поглощение при 405 нм. Активность выражали в единицах/мл суспензии шариков, где 1 единица определяется как количество мкмоль п-нитрофенола, образующегося в минуту. Для расчета концентрации п-нитрофенола использовали молярную поглощательную способность 18380 л/моль см и длину пути 0,25 см, соответствующую объему 200 мкл в 96-луночном планшете.
( c ) Дегликозилирование DBP с помощью (1-3) β-D-галактозидазы-агарозных шариков.
Дегликозилирование ДБФ осуществляли с использованием модификации метода Ямамото и др. [17] . DBP (CalBiochem, Сан-Диего, Калифорния) добавляли до конечной концентрации 0,05 мг/мл в PBS, pH 6,0, 10 мМ MgCl 2 , с 0,007 ед. (1-3) β-D-галактозидазы-агарозы и 0,004 ед. нейраминидазу-агарозу (Sigma, Сент-Луис) и встряхивают при комнатной температуре в течение 4 часов. Общий объем реакции составлял 1 мл. Затем гранулы осаждали центрифугированием и удаляли. ДБФ-маф хранили в аликвотах при -20°С.
Пептид DBP-maf
Был синтезирован пептид DBP-maf из 14 аминокислот (Ana Spec, Fremont, CA) с аминокислотной последовательностью: Ac-TPTELAKLVNKRSE. Чистота составляла >90%.
Культура клеток
Клетки PC3M, PC3MLN4, LNCaP и LNCaPLN3 были любезно предоставлены доктором Кертисом Петтауэем и доктором Исайей Дж. Фидлером (Онкологический центр доктора медицинских наук Андерсона).
Клеточная линия PC3M была выделена из метастазов печени, образовавшихся у голых мышей после внутриселезеночной инъекции андроген-нечувствительной линии клеток карциномы простаты человека PC3 [18] .
Метастатические сублинии, PC3MLN и LNCaPLN, были созданы путем ортотопической инъекции родительских клеток в дорсальную долю простаты голых мышей и культивирования клеток, метастазировавших в сторожевой (парааортальный) лимфатический узел.
После культивирования в течение 3–5 пассажей эти клетки повторно вводили в простату последующим голым мышам. Этот процесс повторялся в течение 3 циклов для создания метастатической линии LNCaPLN3 и в течение четырех циклов для создания метастатической линии PC3MLN4 [18].
Все опухолевые клетки культивировали в среде RPMI 1640 (Invitrogen) с 10% фетальной бычьей сывороткой (FBS), пенициллином (100 ед/мл)/стрептомицином (100 мкг/мл) и L-глутамином и инкубировали при 37°C, 10% СО 2 .
Колориметрический анализ кислой фосфатазы
По завершении каждого эксперимента клетки промывали PBS, затем в каждую лунку добавляли 450 мкл буфера кислой фосфатазы (10 мМ п-нитрофенолфосфат, 0,1 М ацетат натрия, 0,1% Тритон Х-100, pH 5,8). Клетки инкубировали при 37°С в течение 45 минут. В каждую лунку добавляли по пятьдесят мкл 1 N NaOH, чтобы остановить реакцию, и измеряли поглощение при 405 нм [19] , [20].
Количество клеток каждого типа клеток калибровали по поглощению с использованием гемацитометра, чтобы гарантировать, что уровни кислой фосфатазы линейно коррелируют с количеством клеток. Анализы и построение графиков для всех анализов проводились с использованием Origin Pro 8 (Нортгемптон, Массачусетс).
Анализы клеточной миграции
Анализы миграции проводились с использованием модифицированных культуральных вставок Millicell камеры Бойдена (Millipore, Billerica, MA) с порами 8 мкм [20] – [22] . Верхние мембраны предварительно инкубировали в течение ночи с фибронектином (10 мкг/мл в PBS), который аспирировали из лунок на следующее утро. Клетки (150000 клеток/лунка) высевали в базальную среду с 0,010% желатином с или без DBP-maf или DBP.
Некоторые лунки с образцами окрашивали по завершении инкубационного периода, чтобы гарантировать, что адгезия клеток на верхних мембранах была однородной при всех условиях. Базальную среду добавляли в нижние лунки с 10% FBS или без него. Клетки инкубировали в течение шести часов при 37°С, 10% CO 2 . Клетки, которые не мигрировали, удаляли с верхней части мембраны и количественно оценивали мигрировавшие клетки с использованием колориметрического анализа кислой фосфатазы.
Анализы пролиферации
Опухолевые клетки поддерживали в RPMI 1640 (Invitrogen) с 10% FBS, пенициллином/стрептомицином и L-глутамином и инкубировали при 37°C, 10% CO 2 . Клетки трипсинизировали и добавляли в 24-луночные планшеты (5000 клеток/лунку) в 0,5 мл культуральной среды. Клетки голодали в сыворотке в течение ночи, затем среду заменяли RPMI 1640, 1% FBS, пенициллином/стрептомицином и L-глутамином и инкубировали в течение 72 часов с или без DBP-maf или DBP [23] . Пролиферацию клеток оценивали с использованием колориметрического анализа кислой фосфатазы [4] , [23] .
Проточной цитометрии
Клетки выращивали до ~80% слияния в чашках площадью 100 мм 2 . Клетки обрабатывали DBP-maf или без него (1 мкг/мл) и инкубировали при 37°C в течение 48 часов. Клетки трипсинизировали, центрифугировали, аликвотировали в пробирки и метили аннексином V и йодидом пропидия с использованием набора для обнаружения апоптоза (APOAF, Sigma, Сент-Луис, Миссури). Окрашивание аннексином V и PI проводили в соответствии с рекомендациями производителя. Анализ проточной цитометрии проводили с использованием сортировщика клеток Cytomation MoFlo в соответствии с рекомендациями производителя.
Обратная транскрипция и количественная полимеразная цепная реакция в реальном времени (RTQPCR)
Тотальную РНК экстрагировали из клеток человека с использованием реагента Trizol (Invitrogen) в соответствии с рекомендациями производителя и обрабатывали ДНКазой, не содержащей РНКазы (Ambion). Целостность и качество РНК оценивали с помощью электрофореза в 1% агарозном геле, а концентрации определяли спектрофотометрически (спектрофотометр NanoDrop 1000 V3.7, ThermoFisher Scientific).
Тотальную РНК (1 мкг) подвергали обратной транскрипции, как описано ранее [24], с использованием кДНК qScript SuperMix (Quanta Biosciences). Продукты ОТ (кДНК) амплифицировали с помощью количественной ПЦР в реальном времени (система Applied Biosystems 7900 HT Fast Real-Time PCR) с Power SYBR green Master Mix. Олигонуклеотидные праймеры, специфичные для варианта 1 человеческого uPAR (номер доступа в банке генов NM-002659, прямой 5′-CAACGAGGGCCCAATCCT -3′ и обратный 5′-GTAACACTGGCGGCCATTCT -3′ ), варианта 2 uPAR (номер доступа в банке генов NM-001005376, прямой 5) ‘- CAACGAGGGCCCAATCCT -3′ и обратный 5′- CACTGGCGGCCATTCTG -3′ ), вариант 3 uPAR (номер доступа в банке генов NM-001005377, прямой 5′- GCCGTTACCTCGAATGCATT -3′ и обратный 5′- GGCCCCTCTCACAGCTCAT -3′ ) и 18S Использовали рРНК (прямую 5′-CGCAGCTAGGAATAATGGAATAGG-3′ и обратную 5′-GCCTCAGTTCCGAAAACCAA-3’ ).
Условия циклирования QPCR: 50°C в течение 2 минут, 95°C в течение 10 минут с последующими 40 циклами двухэтапной программы амплификации (95°C в течение 15 с и 58°C в течение 1 мин).
В конце амплификации применяли анализ кривой плавления с использованием протокола диссоциации системы Sequence Detection, чтобы исключить загрязнение неспецифическими продуктами ПЦР. Продукты ПЦР также были подтверждены с помощью агарозного геля и показали только одну специфическую полосу прогнозируемого размера. В случае отрицательного контроля продукты RT не использовались в качестве матриц в QPCR, и на геле не было обнаружено полос.
Относительную экспрессию генов-мишеней определяли методом 2 — ΔΔCt [25] .
В качестве калибраторов были выбраны необработанные клетки.
Иммуноблоттинг
Иммуноблоттинг проводили с использованием модификации метода Besch et al [26] . Клетки культивировали в чашках площадью 100 мм 2 и выращивали до ~80% слияния, затем выдерживали в течение ночи в условиях отсутствия сыворотки.
Среду заменили на RPMI (1% FBS). DBP или DBP-maf добавляли в указанных концентрациях. Клетки инкубировали в течение 24 или 72 часов при 37°C, затем лизировали с использованием буфера HTG (20 мМ HEPES, pH 7,4, 10% глицерин, 1% Triton X-100) и собирали с помощью скребка для клеток.
Добавляли фенилметансульфонилфторид (ФМСФ) (100 мкМ). Лизаты разделяли с помощью SDS-PAGE. Дорожки нормализовали с использованием равной загрузки белка (40 мкг/дорожка). Уровни белка определяли с использованием анализа BCA (Pierce, Rockford, IL). Полосы переносили на мембрану из ПВДФ. Мембрану блокировали на ночь в 10% сухом обезжиренном молоке и 0,10% Твине 20 в PBS. Мембрану гибридизовали с антителом против uPAR (Санта-Круз, Калифорния), с последующей гибридизацией со вторичным антителом, связанным с пероксидазой хрена, и визуализировали с помощью хемилюминесценции. Винкулин использовали в качестве контроля нагрузки.
Статистический анализ
Эффект DBP-maf тестировали отдельно для анализов миграции и пролиферации клеток. Односторонний t-критерий использовался для измерения статистической значимости снижения роста опухоли на различных уровнях.
Двусторонний Z-тест использовали для измерения эффекта DBP-maf при апоптозе или некрозе. Все анализы проводились с использованием статистического программного обеспечения SAS версии 9.1 (Институт SAS, Кэри, Северная Каролина), а для определения статистической значимости использовали значение P <0,01.
Полученные результаты
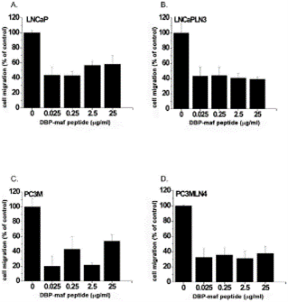
ДАД-маф ингибирует миграцию опухолевых клеток
Инвазия и миграция опухолевых клеток являются важными этапами роста опухоли и метастазирования. DBP-maf был протестирован на предмет его влияния на миграцию клеток в четырех опухолевых линиях — двух родительских линиях рака простаты (LNCaP и PC3M) и двух метастатических клонах этих линий (LNCaPLN3 и PC3MLN4) с использованием модифицированной камеры Бойдена.
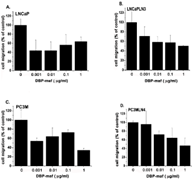
Базальный уровень миграции между каждой родительской линией и соответствующим метастатическим клоном остался неизменным. При всех испытанных дозах наблюдалось ингибирование миграции ( Фигура 1 ).
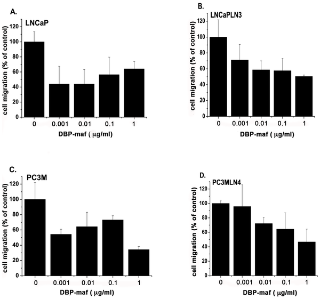
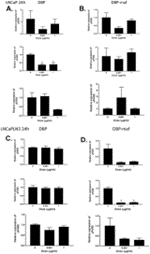
Рисунок 1. DBP-maf ингибирует миграцию опухолевых клеток.
Клетки LNCaP ( А ), LNCaPLN3 ( В ), PC3M ( С ) или PC3MLN4 ( D ) добавляли (150 000 на лунку) в верхнюю камеру модифицированной камеры Бойдена (+/- DBP-maf) с 10% FBS в нижняя камера. Через 6 часов удаляли клетки, которые не мигрировали, а количество оставшихся клеток определяли с использованием анализа кислой фосфатазы. Результаты нормализовали до контроля. Эксперименты проводились минимум три раза, ошибка отображается как +/- SD. По сравнению с ростом клеток без DBP-maf, добавление DBP-maf приводило к статистически значимому общему снижению миграции клеток на 30% (P = 0,0003) для объединенных четырех типов опухолевых клеток. Для каждого из этих типов опухолевых клеток была обнаружена индивидуальная значительная степень снижения. По сравнению с контролем значительное снижение наблюдалось при использовании DBP-maf при ( A ) 20% P = 0,0022 ( B ) 20% P = 0,0029 ( C ) 10% P = 0,0045 ( D ) 30% P = 0,0094. п = 3.
Пептид DBP-maf ингибирует миграцию опухолевых клеток
Получение DBP-maf включает многостадийный ферментативный процесс. Селективное дегликозилирование является необходимым шагом в этом процессе, поскольку экспрессия DBP-maf в E. coli приводит к образованию белка, не обладающего активностью [4] .
Активная, но более простая в формулировке версия молекулы сделает производство DBP-maf проще и дешевле. По этим причинам пептид DBP-maf был синтезирован с использованием последовательности родительской молекулы, которая продемонстрировала активность в других исследованиях [27] .
Пептид был протестирован, чтобы определить его способность ингибировать миграцию опухолевых клеток. Как показано на фигуре 2 , пептид продемонстрировал значительную способность ингибировать миграцию всех опухолевых линий. Ингибирующий эффект не увеличивался при более высоких дозах, что позволяет предположить, что его IC 50 был ниже, чем в тестируемом диапазоне доз.
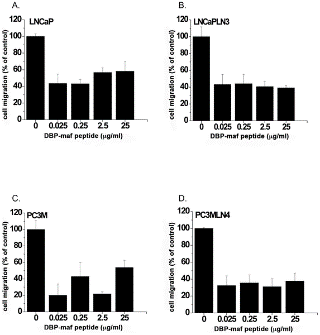
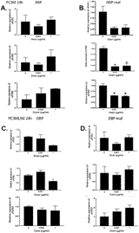
Рисунок 2. Пептид DBP-maf ингибирует миграцию опухолевых клеток.
Клетки LNCaP ( А ), LNCaPLN3 ( В ), PC3M ( С ) или PC3MLN4 ( D ) добавляли (150 000 на лунку) в верхнюю камеру модифицированной камеры Бойдена (+/- DBP-maf) с 10% FBS в нижняя камера. Через 6 часов удаляли клетки, которые не мигрировали, а количество оставшихся клеток определяли с использованием анализа кислой фосфатазы. Результаты нормализовали до контроля. Эксперименты проводились минимум три раза, ошибка отображается как +/- SD. По сравнению с миграцией без DBP-maf, добавление DBP-maf приводило к статистически значимому снижению миграции на 40% (P<0,0001) для комбинации всех четырех типов опухолевых клеток. Для каждого из этих типов опухолевых клеток была обнаружена индивидуальная значительная степень снижения. По сравнению с контролем значительное снижение наблюдалось при использовании DBP-maf при ( A ) 30% P = 0,0038 ( B ) 40% P = 0,0016 ( C ) 20% P = 0,0038 ( D ) 40% P = 0,0005. п = 3.
DBP-maf ингибирует пролиферацию опухолевых клеток
Затем четыре клеточные линии были протестированы для определения их чувствительности к DBP-maf в исследованиях пролиферации. Как показано на рисунке 3А , DBP-maf в концентрации 1 мкг/мл снижал пролиферацию до исходного уровня или ниже во всех клеточных линиях, за исключением PC3M. Было интересно, что, хотя клетки PC3M не были чувствительны к DBP-maf в этом анализе, метастатический клон PC3MLN4 развил к нему чувствительность.
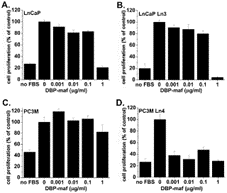
Рисунок 3. DBP-maf ингибирует пролиферацию опухолевых клеток.
Клетки LNCaP ( A ), LNCaPLN3 ( B ), PC3M ( C ) или PC3MLN4 ( D ) высевали в 24-луночные чашки на ночь, затем добавляли среду +/- DBP-maf с 1% FBS. Через 72 часа клетки количественно оценивали с использованием анализа кислой фосфатазы. Результаты нормализовали до контроля. Эксперименты проводились минимум три раза, ошибка отображается как +/- SD. По сравнению с контролем значительное снижение наблюдалось при использовании DBP-maf при ( A ) 50% P = 0,0001 ( B ) 50% P = 0,0001 ( C ) отсутствие значительного снижения ( D ) 40% P = 0,0073. п = 3.
При дозе 1 мкг/мл DBP-maf вызывал статистически значимое снижение роста клеток на 40% (P = 0,0073) для комбинации всех типов опухолевых клеток. Индивидуальные значительные показатели снижения (без DBP-maf по сравнению с 1 мкг/мл) также были обнаружены среди этих типов опухолевых клеток, за исключением PC3M, в котором не было обнаружено значительного снижения ( рис. 3 ).
Исследования пролиферации с использованием пептида DBP-maf не показали снижения пролиферации ни в одной из клеточных линий (данные не показаны). Это предполагает, что способность ингибировать миграцию и пролиферацию может находиться в отдельных областях белка и что эта пептидная последовательность может не играть никакой роли в ингибировании пролиферации. Также возможно, что сайт, ответственный за полную активность DBP-maf, более сложен и требует присутствия селективно дегликозилированной последовательности белка.
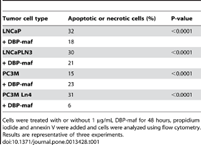
Чтобы определить, было ли ингибирование пролиферации опухолевых клеток вызвано гибелью клеток или апоптозом, был проведен анализ проточной цитометрии с использованием йодида пропидия и маркеров аннексина V. Эти исследования не выявили никаких доказательств значительной клеточной гибели или токсичности в результате обработки клеток DBP-maf ( таблица 1 ) и, за исключением родительской линии PC3M, показали снижение.
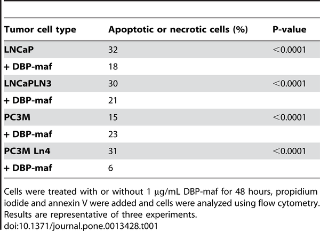
Таблица 1. FACS-анализ апоптоза или некроза.
ОТ-ПЦР показывает снижение экспрессии uPAR в клетках, обработанных DBP-maf.
Было показано, что экспрессия рецептора урокиназного активатора плазминогена (uPAR) коррелирует с увеличением метастазов в опухолевых клетках [28] – [30] и с лекарственной устойчивостью [31] (обзор см. в [32] ).
ОТ-ПЦР проводили на всех типах клеток с использованием трех известных изоформ предшественников uPAR, включая растворимый рецептор, изоформу 2 (см. « Методы» ).
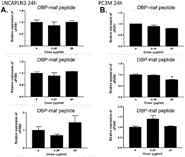
Как показано на рисунке 4D , снижение экспрессии РНК наблюдалось для LNCaPLN3 в присутствии DBP-maf как в концентрации 0,001, так и в 1 мкг/мл DBP-maf как для изоформ uPAR1, так и для uPAR2. Изоформы uPAR2 и uPAR3 показали одинаковое снижение экспрессии при обработке клеток PC3M DBP-maf.
Интересно, что хотя клетки PC3MLN4 не показали значимого ответа на DBP-maf ( рис. 5D ), наблюдалось статистически значимое снижение uPAR2 при использовании DBP в дозе 1 мкг/мл. Почти во всех исследованных условиях через 72 часа уровни uPAR вернулись к контрольным значениям (данные не показаны).
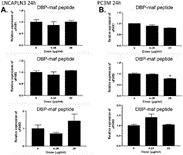
Пептид также тестировали с использованием клеточной линии (LNCaPLN3), которая была активна во всех анализах, и (PC3M), которая была активна в миграции, но не в пролиферации. Они не показали существенных изменений ни в одной из уровней изоформ uPAR при использовании пептида ( фигуры 6A и 6B ).
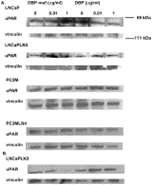
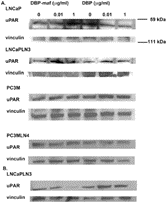
Затем опухолевые линии были протестированы для наблюдения за влиянием DBP-maf на экспрессию uPAR на уровне белка. Клетки собирали через 24 часа и лизаты подвергали иммуноблоттингу. Как показано на фигуре 4 , DBP-maf не ингибировал экспрессию uPAR ни в одной клеточной линии через 24 часа ( фигура 7A ), однако снижение наблюдалось через 72 часа только в клетках LNCaPLN3 ( фигура 7B ).
Клетки, обработанные DBP, не показали существенных изменений в экспрессии рецептора.
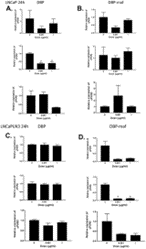
Рисунок 4. DBP-maf ингибирует экспрессию uPAR в клетках LNCaPLN3.
Клетки LNCaP и LNCaPLN3 обрабатывали DBP или DBP-maf (0,001 и 1 мкг/мл) и инкубировали в течение 24 часов, а затем собирали. Продукты ОТ (кДНК), идентифицированные как uPAR1, 2 и 3, амплифицировали с помощью количественной ПЦР в реальном времени.
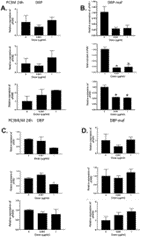
Рисунок 5. DBP-maf ингибирует экспрессию uPAR в клетках PC3M.
Клетки PC3M и PC3MLN4 обрабатывали DBP или DBP-maf (0,001 и 1 мкг/мл) и инкубировали в течение 24 часов, а затем собирали. Продукты ОТ (кДНК), идентифицированные как uPAR1, 2 и 3, амплифицировали с помощью количественной ПЦР в реальном времени. р<0,05.
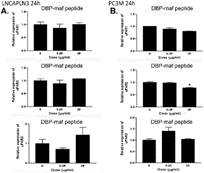
Рисунок 6. Пептид DBP-maf не ингибирует экспрессию uPAR в клетках PC3M или LNCaPLN3.
Клетки LNCaPLN3 ( А ) и PC3M ( В ) обрабатывали DBP или DBP-maf (0,001 и 1 мкг/мл) и инкубировали в течение 24 часов, а затем собирали. Продукты ОТ (кДНК), идентифицированные как uPAR1, 2 и 3, амплифицировали с помощью количественной ПЦР в реальном времени. р<0,05.
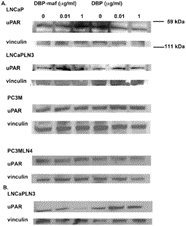
Рисунок 7. DBP-maf ингибирует экспрессию белка uPAR.
LNCaP, LNCaPLN3, PC3M и PC3MLN4 обрабатывали DBP или DBP-maf и инкубировали в течение 24 часов ( A ), затем собирали и подвергали иммуноблоттингу с использованием антитела против uPAR. Клетки LnCaPLN3 через 72 часа ( Б ). р<0,05.
Обсуждение
Было показано, что белок, связывающий витамин D, DBP-maf, ингибирует рост опухоли и кровеносных сосудов. Здесь мы впервые демонстрируем прямое воздействие на клетки рака простаты в отсутствие макрофагов, расширяя возможности DBP-maf за пределы его уже продемонстрированных антиангиогенных и иммуномодулирующих свойств. DBP-maf продемонстрировал мощное ингибирование как пролиферации, так и миграции опухолевых клеток.
Интересно отметить реакцию родительских клеток PC3M по сравнению с метастатическим клоном. Клетки PC3M не проявляли чувствительности к DBP-maf в анализах пролиферации, но их миграция ингибировалась DBP-maf. Было обнаружено снижение экспрессии uPAR, как было обнаружено с помощью RT-PCR, но экспрессия белка протестированных изотипов uPAR оказалась неизменной. Наконец, DBP-maf вызывал небольшое увеличение потерь вследствие апоптоза или некроза ( таблица 1 ), тогда как другие клеточные линии демонстрировали снижение апоптоза или некроза.
Метастатический клон PC3MLN4 продемонстрировал сильный ответ на лечение как в плане пролиферации, так и миграции даже при низких дозах (1 нг/мл), но не показал снижения экспрессии uPAR ни на уровне мРНК, ни на уровне белка. Были проведены дополнительные исследования пролиферации, чтобы определить, вызвано ли несоответствие в ответе между родительским и метастатическим клоном общим изменением чувствительности клеток.
Кальцитриол продемонстрировал мощное и последовательное ингибирование всех типов клеток в одинаковых диапазонах доз. Клетки PC3M и PC3MLN4 также были протестированы с этопозидом, и их ответы были схожими (данные не показаны), что позволяет предположить, что метастатический клон приобрел чувствительность к DBP-maf, которую не демонстрирует родительская линия. Влияние DBP-maf на клетки PC3MLN4 вызывало наиболее значительное снижение скорости пролиферации и миграции по сравнению с другими клеточными линиями. Исследования показали, что все линии опухолевых клеток чувствительны к DBP-maf в анализах миграции.
Наши наблюдения при культивировании этих клеток показали, что метастатические клоны как PC3M, так и LNCaP были более чувствительны к трипсинизации, чем родительские линии.
Многие факторы могут регулировать миграцию клеток, и хотя uPAR является возможным медиатором, он может быть не единственным механизмом, с помощью которого DBP-maf ингибирует миграцию.
Пептид оказался эффективным в исследованиях миграции, но не показал способности влиять на пролиферацию или экспрессию uPAR. Поскольку пептид представляет собой лишь часть белка, он не обладает всеми доменами нативного DBP-maf, такими как область связывания витамина D.
Возможно, способность регулировать миграцию и пролиферацию находится в отдельных доменах белка. Хотя все клеточные линии ответили на DBP-maf в одном или нескольких анализах, только LNCaPLN3 продемонстрировал снижение уровня белка uPAR. Однако возможно, что антитело распознает не все изоформы uPAR.
В настоящее время общепризнано, что микроокружение опухоли, а не только опухолевые клетки сами по себе, представляет собой эффективную мишень для терапии. Помимо исследования противоопухолевого действия изучаются способы доставки этих препаратов.
Биодоступность является важнейшим компонентом любой терапевтической стратегии. Плохая абсорбция, интернализация, короткий период полураспада в кровообращении и ряд других недостатков могут сделать терапию, показавшую большие перспективы in vitro , неэффективной в клинике.
Эффективные дозы DBP-maf (pg-ng) in vivo , как правило, ниже, чем дозы in vitro (диапазон нг-мкг) [4] , [6] – [10] . Возможно, это связано с множественностью механизмов его действия. Потенциал воздействия на рост кровеносных сосудов и опухолевых клеток, а также стимуляции мощного иммунного ответа посредством активации макрофагов трудно измерить в целом, используя подходы in vitro . Однако они дают возможность охарактеризовать эти эффекты индивидуально.
Влияние лечения DBP-maf на экспрессию uPAR в клетках опухоли простаты ранее было неизвестно. Экспрессия uPAR коррелирует с метастазированием опухоли в ряде опухолей [26] , [28] – [30] , [32] .
Исследования опухолей пищевода показали, что PAI-1 и uPA экспрессируются во всей опухоли, но не в нормальной ткани пищевода, и что uPAR экспрессируется на границах опухоли [33] , [34] .
Была продемонстрирована связь между раком поджелудочной железы и uPA, что может объяснить мощный эффект DBP-maf в наших предыдущих исследованиях опухолей поджелудочной железы [33] .
Взаимоотношения между родственными плазмину белками PAI-1, uPA и uPAR сложны [35] .
Хотя PAI-1 ингибирует экспрессию uPA, которая, как полагают, ингибирует прогрессирование опухоли, PAI-1 также сам по себе способствует росту опухоли и ангиогенезу [36] , [37] .
В этом смысле терапия, которая ослабила бы экспрессию uPAR, не стимулируя рост опухоли, была бы ценной. Поскольку метастазы являются основной причиной смерти онкологических больных, чувствительность uPAR к DBP-maf может представлять собой привлекательное направление для дальнейшего изучения.
Благодарности
Авторы хотели бы поблагодарить Джаякришну Амбати и Ройса Мохана за полезные обсуждения.
Вклад автора
Задумал и спланировал опыты: М.Ф. Эксперименты проводили: KJG BZ SD JW WJ. Проанализированы данные: СД БХ СПС МФ. Предоставленные реагенты/материалы/инструменты анализа: БД. Написал статью: М.Ф.
Рекомендации
1.Кук Н.Э., Дэвид Э.В. (1985)Сывороточный белок, связывающий витамин D, является третьим членом семейства генов альбумина и альфа-фетопротеина. J Clin Invest 76: 2420–2424.
2.Каваками М., Блюм С.Б., Рамакришнан Р., Делл Р.Б., Гудман Д.С. (1981)Обмен плазменного белка, связывающего витамин D и его метаболиты, у нормальных людей. J Clin Endocrinol Metab 53: 1110–1116.
3.Ямамото Н., Нарапараджу В.Р. (1996)Белок, связывающий витамин D3, как предшественник фактора активации макрофагов в каскаде активации макрофагов, вызванном воспалением, у крыс. Cell Immunol 170: 161–167.
4.Кискер О., Онидзука С., Беккер С.М., Фэннон М., Флинн Э. и др. (2003)Фактор активации макрофагов и белка, связывающего витамин D (DBP-maf), ингибирует ангиогенез и рост опухолей у мышей. Неоплазия 5: 32–40.
5.Канда С., Мотидзуки Ю., Мията Ю., Канетаке Х., Ямамото Н. (2002)Влияние витамина D(3)-связывающего белка-фактора активации макрофагов (GcMAF) на ангиогенез. J Natl Cancer Inst 94: 1311–1319.
6.Кога Ю., Нарапараджу В.Р., Ямамото Н. (1999)Противоопухолевый эффект фактора активации макрофагов, полученного из витамина D-связывающего белка, на мышей с асцитной опухолью Эрлиха. Proc Soc Exp Biol Med 220: 20–26.
7.Ямамото Н., Суяма Х. (2008)Иммунотерапия рака простаты с помощью фактора активации макрофагов, полученного из белка Gc, GcMAF. Перевод Онкол 1: 65–72.
8.Ямамото Н., Суяма Х., Наказато Х., Кога Ю. (2008)Иммунотерапия метастатического колоректального рака с помощью фактора активации макрофагов, связывающего витамин D, GcMAF. Рак Иммунол Иммунотер 57: 1007–1016.
9.Ямамото Н., Суяма Х., Ушиджима Н. (2008)Иммунотерапия пациентов с метастатическим раком молочной железы с помощью фактора активации макрофагов, связывающего витамин D (GcMAF). Int J Cancer 122: 461–467.
10.Ямамото Н., Ушидзима Н., Кога Ю. (2009)Иммунотерапия ВИЧ-инфицированных пациентов с помощью фактора активации макрофагов, полученного из белка Gc (GcMAF). J Med Virol 81: 16–26.
11.Ямамото Н. (2006)Патогенетическое значение активности альфа-N-ацетилгалактозаминидазы, обнаруженной в оболочочном гликопротеине gp160 вируса иммунодефицита человека типа 1. AIDS Res Hum Retroviruses 22: 262–271.
12.Хелберт М.Р., Л’Аге-Стер Дж., Митчисон Н.А. (1993)Презентация антигена, потеря иммунологической памяти и СПИД. Иммунол Сегодня 14: 340–344.
13.Ямамото Н., Нарапараджу В.Р., Шринивасула С.М. (1995)Структурная модификация сывороточного витамина D3-связывающего белка и иммуносупрессия у больных СПИДом. СПИД Res Hum Retroviruses 11: 1373–1378.
14.Ямамото Н., Нарапараджу В.Р., Мур М., Брент Л.Х. (1997)Дегликозилирование сывороточного белка, связывающего витамин D3, с помощью альфа-N-ацетилгалактозаминидазы, обнаруженного в плазме пациентов с системной красной волчанкой. Клин Иммунол Иммунопатол 82: 290–298.
15.Мохамад С.Б., Нагасава Х., Уто Ю., Хори Х. (2002)Активность альфа-N-ацетилгалактозаминидазы опухолевых клеток и ее участие в активации макрофагов, связанной с GcMAF. Comp Biochem Physiol A Mol Integr Physiol 132: 1–8.
16.Греко М., Митри М.Д., Кириако Ф., Лео Г., Бриенца Е. и др. (2009)Протеомный профиль сыворотки злокачественной меланомы кожи и связь с прогрессированием рака: связь с опухолевой активностью альфа-N-ацетилгалактозаминидазы. Cancer Lett 283: 222–229.
17.Ямамото Н. (1996)Структурное определение мощного фактора активации макрофагов, полученного из белка, связывающего витамин D3, с адъювантной активностью для производства антител. Мол Иммунол 33: 1157–1164.
18.Петтауэй К.А., Патхак С., Грин Г., Рамирес Э., Уилсон М.Р. и др. (1996)Отбор высокометастатических вариантов различных карцином предстательной железы человека с использованием ортотопической имплантации голым мышам. Clin Cancer Res 2: 1627–1636.
19.Коннолли Д.Т., Найт М.Б., Харакас Н.К., Виттвер А.Дж., Федер Дж. (1986)Определение количества эндотелиальных клеток в культуре с использованием анализа кислой фосфатазы. Анальная биохимия 152: 136–140.
20.Кискер О., Беккер С.М., Прокс Д., Фэннон М., Д’Амато Р. и др. (2001)Непрерывное введение эндостатина с помощью внутрибрюшинно имплантированного осмотического насоса повышает эффективность и эффективность терапии на модели опухоли ксенотрансплантата мышей. Рак Res 61: 7669–7674.
21.Чанг Л.К., Гарсия-Кардена Дж., Фарнебо Ф., Фэннон М., Чен Э.Дж. и др. (2004)Дозозависимый ответ FGF-2 на лимфангиогенез. Proc Natl Acad Sci USA 101: 11658–11663.
22.Трин Л., Норонья С.Б., Фэннон М., Шилоах Дж. (2000)Извлечение мышиного эндостатина, продуцируемого Pichia Pastoris, с использованием адсорбции в расширенном слое. Биосепарация 9: 223–230.
23.Фэннон М., Форстен-Уильямс К., Ньюджент М.А., Грегори К.Дж., Чу К.Л. и др. (2008)Октасульфат сахарозы регулирует связывание, транспортировку и активность фактора роста фибробластов-2: потенциал регуляции роста опухоли. J Cell Physiol 215: 434–441.
24.Такеда А., Баффи Дж.З., Кляйнман М.Е., Чо В.Г., Нозаки М. и др. (2009) CCR3 является мишенью для диагностики и терапии возрастной макулярной дегенерации. Природа 460: 225–230.
25.Ливак К.Дж., Шмиттген Т.Д. (2001)Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 (-Delta Delta C (T)). Методы 25: 402–408.
26.Беш Р., Беркинг С., Каммербауэр С., Дегитц К. (2007)Ингибирование рецептора активатора плазминогена урокиназного типа вызывает апоптоз в клетках меланомы путем активации p53. Клеточная смерть отличается 14: 818–829.
27.Шнайдер ГБ, Грекко К.Дж., Сафади Ф.Ф., Попофф С.Н. (2003)Анаболические эффекты фактора активации белка-макрофагов, связывающего витамин D (DBP-MAF), и нового небольшого пептида на кости. Crit Rev Eukaryot Gene Expr 13: 277–284.
28.Донг З., Салиганан А.Д., Мэн Х., Набха С.М., Саббота А.Л. и др. (2008)Происходящий из клеток рака простаты активатор плазминогена урокиназного типа способствует внутрикостному росту опухоли и обновлению костной ткани. Неоплазия 10: 439–449.
29.Серрати С., Маргери Ф., Фибби Дж., Ди Кара Дж., Минафра Л. и др. (2008)Эндотелиальные клетки и нормальные эпителиальные клетки молочной железы усиливают инвазию клеток карциномы молочной железы за счет CXCR-4-зависимой активации экспрессии рецептора активатора плазминогена урокиназного типа (uPAR, CD87). Дж. Патол 214: 545–554.
30.Дасс Ч.Р., Надесапиллай А.П., Робин Д., Ховард М.Л., Фишер Дж.Л. и др. (2005)Понижение уровня uPAR подтверждает связь с ростом и метастазированием остеосаркомы. Clin Exp Metastasis 22: 643–652.
31.Гутова М., Найбауэр Дж., Геворкян А., Мец М.З., Венг Ю. и др. (2007)Идентификация uPAR-положительных химиорезистентных клеток при мелкоклеточном раке легких. PLoS One 2: e243.
32.Дасс К., Ахмад А., Азми А.С., Саркар Ш., Саркар Ф.Х. (2008)Развивающаяся роль системы uPA/uPAR при раке человека. Лечение рака. Откр. 34: 122–136.
33.Бауэр Т.В., Фан Ф., Лю В., Джонсон М., Парих Н.У. и др. (2005)Опосредованная инсулиноподобным фактором роста-I миграция и инвазия клеток карциномы толстой кишки человека требуют активации c-Met и рецептора урокиназного активатора плазминогена. Энн Сург 241: 748–756; обсуждение 756–748.
34.Бауэр Т.В., Лю В., Фань Ф., Кэмп Э.Р., Ян А. и др. (2005)Нацеливание на рецептор урокиназного активатора плазминогена в клетках карциномы поджелудочной железы человека ингибирует миграцию и инвазию, опосредованную рецептором c-Met и инсулиноподобного фактора роста-I, а также рост ортотопической опухоли у мышей. Рак Res 65: 7775–7781.
35.Блази Ф., Кармелиет П. (2002) uPAR: универсальный оркестратор сигналов. Nat Rev Mol Cell Biol 3: 932–943.
36.Бажу К., Майяр С., Йост М., Лийнен Р.Х., Гилс А. и др. (2004)Концентрация ингибитора активатора плазминогена-1 (PAI-1), полученного от хозяина, имеет решающее значение для опухолевого ангиогенеза и роста in vivo. Онкоген 23: 6986–6990.
37.Бажу К., Массон В., Джерард Р.Д., Шмитт П.М., Альберт В. и др. (2001)Ингибитор активатора плазминогена PAI-1 контролирует васкуляризацию опухоли in vivo путем взаимодействия с протеазами, а не с витронектином. Последствия для антиангиогенных стратегий. J Cell Biol 152: 777–784.