Как макрофаг уничтожает бактерию?
Макрофаги — удивительные создания!
Вероятнее всего они продукт симбиоза амёб и более развитых организмов (как наш). Первым делом макрофаг обнаруживает бактерию с помощью своих рецепторов или с помощью антител, которые любят облепливать бактерии. Что же потом? Желудка у него нет, как и ротового отверстия. Как быть?
Макрофаг окружает бактерию и поглощает её. Живая бактерия плавает в специальном пузырьке внутри макрофага и надо бы её уничтожить.
Происходит это так… Внутри макрофага есть пузырьки с энзимами. Энзимы прекрасно разрушают белки, так что могут с лёгкостью разрушить и сам макрофаг. Поэтому хранить их приходится в пузырьках-лизосомах.
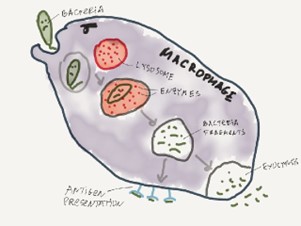
Суровый макрофаг на страже чистоты нашего организма.
Думаю вы уже догадались, что произойдет с бактерией дальше. Всё, что осталось сделать—это слить пузырёк с бактерией вместе с лизосомой. Энзимы и бактерия оказываются вместе, после чего бактерия разрушается.
Надо сказать, что макрофаг не особенно любит что-то выбрасывать просто так. Поэтому разрушенные части выставляются на всеобщее обозрение, чтобы другие молекулы иммунной системы могли увидеть, что там сожрал макрофаг и среагировать на проблемы быстрее (самые сообразительные заметили, что макрофаг является APC, то есть антигенпрезентующей клеткой).
Поразительная многозадачность!
Michael Dubakov. Oct 16, 2017. Иммунная система для простых смертных: 8 вопросов и ответов
https://medium.com/@mdubakov/immune-system-for-mere-mortals-74de44bdb733
Из сказанного выше следует, что первое условие формирования иммунитета — наличие «охраняемой» замкнутой территории с ее обязательным отграничением от внешней среды.
Второе условие — появление факторов, специализированных для обеспечения постоянства охраняемой внутренней среды путем ее освобождения от поступивших извне агентов (т.е. для обеспечения иммунитета в его прямом первоначальном смысле — освобождение).
Со времен И.И. Мечникова общепризнано, что таким фактором стали специализированные клетки мезенхимального происхождения — подвижные амебоциты, предки фагоцитов млекопитающих. Они обладают выраженной способностью к фагоцитозу — механизму, обеспечивающему элиминацию потенциально агрессивных клеток, проникших во внутреннюю среду организма.
Важное условие эффективной работы этого гомеостатического механизма — способность защитных клеток отличать потенциально агрессивные чужие клетки от собственных.
Принцип, на который опирается такое распознавание, стал основой иммунитета во всех его проявлениях. Таким образом, иммунная система, не имея возможности «дожидаться» проявления агрессивности проникших извне клеток, рассматривает в качестве потенциально опасных любые чужеродные клетки и молекулы.
По-видимому, такое «решение» эволюции наиболее универсально и оправдано: действительно чужеродные объекты практически всегда вредны, даже если они не проявляют активной агрессии.
Возникновение рецепторов, позволяющих «опознать» чужое, стало третьим основополагающим событием на пути формирования иммунитета (после возникновения внутренней среды многоклеточных и специализированных клеток-фагоцитов). Действительно, наличие патоген-распознающих рецепторов, как их теперь называют, — чрезвычайно древнее «изобретение» эволюции, общее для животных и растений. Отметим сразу, что иммунитет растений и животных эволюционировал в последующем разными путями, однако общий принцип распознавания чужеродных объектов сохранился.
В процессе эволюции вида закреплялись гены, кодирующие молекулы, предназначенные для распознавания не просто «чужого», но заведомо опасного для данного организма. Эти рецепторы — мембранные или растворимые молекулы, обладающие пространственным сродством (и потому способные их распознавать) к наиболее общим и связанным с патогенностью молекулярным маркерам чужеродных агентов: компонентам клеточной стенки бактерий, эндотоксинам, нуклеиновым кислотам и т.д. Каждый рецептор распознает не индивидуальную молекулу, а целую группу подобных молекул, служащих образами (паттернами) патогенности.
Молекулы- рецепторы представлены не только на поверхности клеток-эффекторов иммунитета, но и в гранулах, в которые попадают чужеродные агенты при фагоцитозе. Патоген-распознающие молекулы присутствуют также в жидких средах организма и способны инактивировать токсины и убивать чужеродные клетки. Относительно небольшое число генов, кодирующих такие рецепторы, обеспечивает распознавание практически всех патогенов, не составляя чрезмерной «обузы» для многоклеточного организма.
В результате распознавания образов патогенности происходит активация клеток — иммуноцитов, что позволяет им убивать и затем элиминировать патогены. Это происходит с помощью цитолиза — внутриклеточного (наиболее совершенного, связанного с фагоцитозом), внеклеточного (вызываемого секретируемыми факторами) и контактного. Патогены могут быть убиты или подготовлены к фагоцитозу растворимыми бактерицидными факторами и рецепторными молекулами. Во всех случаях окончательное расщепление убитых патогенов происходит в процессе фагоцитоза (с.23-24)
2.2.1. Toll-подобные рецепторы
Открытие толл-подобных рецепторов связано с созданием новой концепции врожденного иммунитета и формированием учения о распознавании во врожденном иммунитете. Толл-рецепторы впервые были описаны у дрозофилы как продукты генов, ответственных за формирование дорзовентральной ориентации тела (термин «Тoll» восходит к соответствующему немецкому междометию). Впоследствии выяснили, что мутации соответствующих генов приводят к утрате устойчивости дрозофил к грибковым заболеваниям. Вскоре Р. Меджитов и соавт. обнаружили у млекопитающих гомологи генов Toll и их продукты — рецепторы. Рецепторы были названы толл-подобными (TLR — Toll-like receptor).
Последующее активное изучение TLR выявило их роль в качестве рецепторов врожденного иммунитета.
TLR — эволюционно консервативные и очень древние молекулярные структуры (модули, составляющие их основу, выявляют у растений и низших многоклеточных животных). Эти рецепторы экспрессированы на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего TLR различных типов экспрессируют миелоидные клетки, прежде всего моноциты и макрофаги. В настоящее время не известны все лиганды TLR; свойства некоторых TLR изучены не до конца, однако ясно, что суммарная специфичность этих рецепторов охватывает «образы» всех основных групп одноклеточных патогенов и вирусов («образы» многоклеточных паразитов и распознающие их рецепторы пока не найдены). Число вариантов TLR у представителей разных видов невелико — у человека оно составляет 10, у мышей — 11. Различные TLR человека представлены в табл. 2.9.
Таблица 2.9. Характеристика толл-подобных рецепторов человека (с.81-82)
А.А. Ярилин. Иммунология. 2010. 749с.
